|
La aparición sistemática de series pediátricas dentro de las estadísticas
de adultos hace bastante complejo el delimitar los campos de actuación de los
diferentes especialistas que tratan la órbita y sus referencias son distintas
dependiendo del enfoque clínico, quirúrgico y su integración en unidades
craneofaciales y oculoplásticas.
Son ya clásicas las aportaciones de Reese (1), Lloyd (2), Henderson (3,6),
Jakobiec (4), Ira S. Jones (5), Rootman (7), Shields (8), Taylor (9) y en
nuestro país Gutiérrez Díaz (10,11), Pérez Moreiras (12), Gil-Gibernau
(13,15) y Zaragoza (14).
Mención especial merece John Wright con mucho el cirujano de órbita más
completo y con mayor experiencia en la historia, acumulada durante cuarenta
años como centro de referencia en Londres. Igualmente Carlos García Alíx,
pionero en España de la cirugía moderna orbitaria y un acérrimo defensor
dentro de su idea global y práctica de la órbita en abordajes anteriores y
laterales.Su visión multidisciplinaria y colaboración con otras especialidades
en la Clínica Puerta de Hierro (Dres. Bravo, Carrillo, Garzón, Parera, Nombela
y Brasa) en los dos primeros TAC que se introdujeron en España, hace 23 años,
permitió familiarizarnos con la imágenes anatómicas que la tomografía axial
computarizada aportaba en aquellos primeros prototipos de scanners (16,17). Su
amistad con el Dr. Wright del Moorfields Hospital en Londres nos consiguió
rotaciones y adquisición de experiencias en el mayor centro de referencia que
existía sobre tumores en aquella época.
Han pasado muchos años, con muertes, jubilaciones, cambio de especialidades
y creación de unidades de órbita, oculoplástica y craneofacial. Sin embargo,
en patología pediátrica, son los temas orbitarios que se relacionan con
modernos métodos de diagnóstico y terapéutica, cada vez más interesantes.
Por su variedad, las controversias y resultados interdisciplinarios se hacen
más complejos y es difícil conseguir una visión integrada de los procesos.

Figura 1. Carlos García Alix. In memoriam.
CONSIDERACIONES GENERALES
La incidencia de las diferentes proptosis y masas de afectación orbitaria en
niños varía dependiendo de los estudios, centros de referencia, fuentes de la
patología, países y continentes.
Así las publicaciones de los Shields en Filadelfia (18) basadas en cirugías
confirmadas con anatomía patológica, dada su especificidad como centro de
referencia oncológico mostraban que las lesiones quísticas eran la causa más
común de biopsias orbitarias. Al utilizar sólo las muestras quirúrgicas, los
procesos infecciosos que son tan corrientes en la infancia y dan
pseudoproptosis, no son contemplados y se hacen pocas tomas biópsicas al
curarse con antibióticos. Igualmente hay patologías en procesos sistémicos
con manifestación orbitaria (linfomas, leucemias), que se archivan por
Patología en otras especialidades diferentes a Oftalmología y sólo se
biopsian las zonas con mejor abordaje quirúrgico.
Los trabajos de Rootman (7) y Bullock (19) que incluyen casos diagnosticados
clínicamente, revelan que las patologías inflamatorias/infecciosas y los
tumores vasculares y neurales eran más comunes de lo habitual.
Paradójicas parecen en nuestro medio las series de Silva (20) en 1968 con 65
casos de tumores orbitarios infantiles por debajo de los 10 años de los cuales
20 correspondían a retinoblastomas con extensión orbitaria. Igualmente la de
Belmekki (21) en 1999 tenía 13 retinoblastomas extra oculares de un total de 54
tumores pediátricos.
Las variaciones geográficas también son llamativas. Templeton (22)
trabajando sobre neoplasias de la infancia en el continente africano manifiesta
que el linfoma de Burkitt es en su estadística la más significativa.
Figura 2. Lesiones quísticas encapsuladas.
K. Sindhu y F. Martin (23) difieren en su artículo con Shields, Rootman y
Bullock considerando tan solo 1 dermoide como causa de proptosis y excluyendo
los 55 quistes que tenían con afectación orbitaria por considerar su
incidencia en el desplazamiento ocular mínima.
Por otra parte en los estudios de neuroimagen, los mucoceles y las sinusitis
son la causa más frecuente de proptosis unilateral en Radiología (24,25).
Como resumen se aporta que pese a las variaciones en las publicaciones,
países, especialistas y centros de referencia (19,24,25).
|
El 90% de las lesiones ocupantes de espacio en la órbita infantil son
benignas. De ellas el 50% son quísticas y los dermoides son mayoría. El 10%
restante son malignas y los rabdomiosarcomas, neuroblastomas metastásicos,
leucemias/linfomas y extensión de retinoblastomas son los más corrientes.
|
Es muy importante para la cirugía de la órbita en edad pediátrica el
dominio del complejo entramado anatómico, las relaciones con estructuras
vecinas y el conocimiento de las manifestaciones clínicas de las lesiones
orbitarias (26,27).
La exploración en consulta de una órbita en la infancia, es muy diferente a
la revisión oftalmológica general (28).
La frecuencia y localización de la patología, unido al avance de las
técnicas neurorradiológicas (TC helicoidal, RNM) han desarrollado y mejorado
el diagnóstico y la actitud terapéutica (29).
INDICACIONES QUIRÚRGICAS
(30-35)
Lesiones encapsuladas
Como regla general las masas encapsuladas como hemangiomas, neurinomas o
quistes dermoides son más fácilmente extirpables. Sin embargo los coristomas,
que frecuentemente aparecen en el cuadrante superoexterno de la órbita y se
resecan con facilidad, pueden extenderse posteriormente hacia el ápex orbitario
e incluso llegar hasta el compartimento cerebral.

Figura 3. Infiltración leucémica subcutánea y orbitaria.
Lesiones infiltrativas
La excisión completa de tumores infiltrativos difusos es imposible de
realizar y el riesgo de lesionar estructuras vitales es importante. Los
pseudotumores responden bien a los corticoides y los rabdomiosarcomas se tratan
con quimioterapia y radioterapia requiriendo una extirpación subtotal dentro de
las posibilidades de cada cirujano. La cirugía sobre los gliomas del nervio
óptico produce la pérdida de la visión que tengan, por lo que se suele
esperar, pero hay que vigilarlos para que no lleguen al quiasma. La extirpación
por vía neuroquirúrgica y el momento de realizarla es muy controvertida. Si
recidivan en la órbita los retinoblastomas y rabdomiosarcomas tras consumir
todas las medidas oncológicas y de radiación, nos obligan extirpaciones
radicales previa confirmación histológica de recurrencia o remisión
incompleta del tumor.
Lesiones en glándula lagrimal
Afortunadamente en la infancia esta patología es poco frecuente pero es tan
comprometida como en los adultos, con gran riesgo de diseminación y
recurrencias. La mayoría de las veces son quistes o rabdomiosarcomas que
comprimen la glándula y artefactan los estudios neurorradiológicos
confundiéndolos con ella. Las inflamaciones glandulares son infiltrativas y se
adaptan a las paredes orbitarias contorneando el globo ocular. Los pseudotumores
y leucemias de diverso grado que se localizan en el cuadrante superoexterno de
la órbita siguen sin tipificarse claramente, son más sólidos y producen mayor
desplazamiento. Muchas veces los acinus son desestructurados por estas lesiones
con fibrosis intralacrimal. Por otra parte las neoplasias epiteliales en la
infancia son escasas y se manifiestan principalmente a partir de los 10 años.
Los tumores mixtos benignos y los adenoquistocarcinomas son mucho más
infrecuentes. Las parestesias por extensión perineural del tumor, el dolor y el
crecimiento rápido ensombrecen el pronóstico. El dilema que en los adultos se
plantea en cuanto a conservar la cápsula, programar las biopsias incisionales e
intraoperatoras y extirpar en bloque con márgenes de seguridad todo reborde
orbitario, se traslada igualmente a la infancia. Es fundamental diagnosticar el
tumor involucrando en el mismo acto quirúrgico a los diferentes especialistas
para conseguir buenas supervivencias. Resaltar la necesidad de hacer exhaustivos
controles sistémicos oncológicos con técnicas de imagen. Hay que consultar
con el anatomopatólogo el método óptimo para manejar el tejido extirpado.
Actualmente se necesita extraer bastante cantidad de muestras en fresco para
estudios de citología immunohistoquímica y genética.
Figura 4. Las leucemias infiltran el globo ocular, nervio óptico y
órbita en varias manifestaciones.
Lesiones residuales
Admiten múltiples variedades dependiendo del tipo de tumor, tanto por ciento
de extirpación realizada, tratamiento con quimio y/o radioterapia,
cicatrización y fibrosis en áreas con desestructuración quirúrgica. Tenemos
que valorar exhaustivamente las exploraciones complementarias para estar seguros
de la indicación operatoria y trasladar a la familia la necesidad de realizar
operaciones mutilantes en pacientes que han consumido todas las posibilidades
terapéuticas. Por suerte en la literatura (35) cada vez son más numerosos los
grupos interdisciplinarios que trabajan en unidades craneofaciales y la
publicación de series y posibilidades terapéuticas ordenadas y con gran
credibilidad, ajenas al lucimiento personal, son de gran ayuda para los que nos
dedicamos a esta patología.

Figura 5. Inflamación de glándula lagrimal en la infancia.

Figura 6. La inflamación de la glándula lagrimal se adapta a las
paredes orbitarias contorneando el globo ocular.

Figura 7. La lesión residual de un rabdomiosarcoma está
cicatrizada con una gran fibrosis.

Figura 8. Las técnicas neurorradiológicas son fundamentales en la
cirugía de la órbita.
QUISTES, ANOMALÍAS CONGÉNITAS Y ECTOPIAS
Coristomas (dermoides y otros quistes epiteliales)
Son más frecuentes en los cuadrantes superotemporales de la órbita. Durante
la embriogénesis acúmulos de células epiteliales quedan atrapados cerca de
las uniones frontozigomáticas y adoptan apariencias quísticas. En vez de
dermoide el término coristoma con proliferación de los componentes dérmicos
los define mejor. Contienen queratina, pelos y en sus cubiertas epiteliales
encontramos anexas glándulas sebáceas, folículos pilosos, glándulas
sudoríparas y lacrimales (36).
Figura 9. Dermoide orbitario.

Figura 10. Diversas localizaciones de los coristomas.

Figura 11. Dermolipomas de localización temporal superior con
malformaciones congénitas.
Si las cápsulas no son tan complejas se llaman epidermoides. Si hay mayor
proporción de tejido adiposo dermolipomas. En los quistes intraorbitarios puede
aparecer epitelio conjuntival e incluso del tracto respiratorio. Pueden
localizarse al momento del nacimiento o aparecer más tarde con el desarrollo.
Los quistes ductales del sistema lacrimal suelen aparecer en la parte
palpebral y glándulas accesorias. En la región orbitaria son más escasos y de
mayor complejidad (37).
Figura 12. Cirugía de los dermoides. Obsérvense los pelos
incluidos en el quiste tras la marsupialización.
La ruptura por traumatismos o maniobras quirúrgicas, producen una gran
reacción inflamatoria y granulomatosa en la órbita por lo que su resección in
toto, con disección completa de la cápsula es obligatoria. La
marsupialización de las masas cuando son muy grandes permite su extracción
posterior con más facilidad y la tenemos que emplear frecuentemente (38-41).
Craneosinostosis
Se producen por cierre de las suturas prematuramente produciendo proptosis
del contenido orbitario al crecer y antero posición del ala mayor del
esfenoides. Síndromes como el Crouzon, Apert etc., dan manifestaciones
oftalmológicas urgentes como luxaciones oculares, papiledema y atrofias
ópticas que precisan descompresiones neuroquirúrgicas urgentes y
centralización de los pacientes dentro unidades craneofaciales (42-46).

Figura 13. Herniación del globo ocular en malformaciones orbitarias
con órbitas de pequeño tamaño por cierre de suturas prematuro.

Figura 14. Distopias orbitarias. Obsérvese la diferencia de altura
de la órbita derecha.
Cefaloceles
Presencia de tejido glial en la órbita en anomalías del desarrollo y
malformaciones. Desplazan al globo ocular, siendo la proptosis pulsátil y
según su composición la herniación de los tejidos cerebrales adopta los
nombres de encefalocele, meningocele, meningoencefalocele, etc. (47).
Otras veces los quistes gliales parten de las cubiertas del nervio óptico o
se combinan con colobomas y microftalmías que obligan a reconstrucciones de
cavidades anoftálmicas complejas. La aparición de fístulas de líquido
cefalorraquídeo exige actuaciones combinadas con los neurocirujanos (47-49).
El control con técnicas de imagen resulta fundamental para delimitar campos,
evolución y actuaciones quirúrgicas.
Microftalmos o anoftalmos con quiste
Nunca hay un verdadero anoftalmos. En nuestra experiencia siempre existe un
rudimento minúsculo que puede identificarse como un esbozo ocular. Pueden ser
uni o bilaterales, asociados con colobomas y malformaciones cerebrales (50-52).
A veces el quiste persiste y crece lentamente durante años, permitiendo un
desarrollo armónico de la cavidad orbitaria. Si se dilata mucho tenemos que
extirparlo y ello conlleva sacrificar el ojo microftálmico colocándose un
implante integrado (52-55). Si hay comunicación con el líquido
cefalorraquídeo por algún componente glial y se rellena la órbita, tenemos
que localizar la fístula usando incluso abordajes craneales (56).
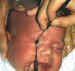
Figura 15. Microftalmos.

Figura 16. Rudimento de córnea, quistes microftálmicos y
colobomatosos.
Glándulas lacrimales ectópicas
En párpados, conjuntiva, cornea, coroides e iris. Dan proptosis y su
exéresis si no es total pueden dar tumores malignos como adenocarcinomas y
adenomas pleomorfos (57-58).

Figura 17. Granuloma secundario a suturas.
Quistes de inclusión y conjuntivales
Son congénitos o secundarios a traumatismos o cirugías. Si no se extirpan
en su totalidad, recurren al quedar restos de cápsulas. Son muy aparatosos y
son remitidos por oftalmólogos a las unidades infantiles con múltiples y
pintorescos diagnósticos (59-62).
Quistes hidatídicos
Infestación secundaria por parásitos intestinales (equinococus). Tienen
calcio en la cápsula y requieren su extirpación total, por el peligro de las
recidivas. La eosinofilia y el ELISA son patognomónicos.
La cisticercosis y triquinosis pueden dar también afectación quística
orbitaria (63-65).
Teratomas
Se desarrollan a partir de las 3 capas germinales, aunque en algunos solo hay
2 de ellas, siendo el mesodermo el que está siempre presente. A veces tiene
componentes dérmicos, del tracto respiratorio, intestinal y glandulares. Se ha
dado el caso de fetos pobremente diferenciados en la órbita.
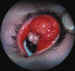
Figura 18. Teratoma orbitario.
Se da en niñas con una frecuencia de 2:1 y en recién nacidos. La proptosis
y el desplazamiento ocular son notorios (66-70).

Figura 19. Extracción de un teratoma con una incisión transeptal.
Pueden estar limitados al compartimento orbitario o acceder en su extensión
a la cavidad craneal y los senos paranasales (69-71). Igualmente son primarios o
secundarios a partir de estructuras vecinas. Adoptan formas quísticas y
fluctuantes. Su crecimiento es más agresivo y la extirpación es compleja
precisando la colaboración de la unidad craneofacial (70-72). Los orbitarios
raramente malignizan, aunque las recurrencias sí lo pueden hacer (72). Resecar
quirúrgicamente el teratoma sin compromiso del globo ocular a veces es
imposible (71-73).

Figura 20. Teratomas orbitarios en el que están incluidos todos los
componentes de las dos o tres capas germinales.
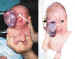
Figura 21. La reducción de los angiomas con corticoides y de las
malformaciones mediante embolización es rápida.
Hamartomas
Son crecimientos anómalos de tejido, compuesto por células maduras que se
desarrollan de una manera desproporcionada en el área orbitaria natural donde
habitualmente están presentes. Los angiomas capilares son los ejemplos más
representativos (74-75).
TUMORES MESENQUIMALES VASCULARES
Angiomas capilares
Es el más frecuente de los tumores vasculares en la infancia. Puede dar
proptosis en las primeras 2 semanas de vida del niño. Se puede asociar con
hemangiomas cutáneos y perioculares. Se exacerba con lloros y al colocarlos
boca abajo. Crece durante meses. Su regresión con corticoides es espectacular
aunque a veces si no se tratan disminuyen muy lentamente. El peligro de
comprometer la agudeza visual, marca el límite intervencionista (75-78).

Figura 22. Corticoides intralesionales y diversos tipos de angiomas.
Hay que descartar malformaciones arteriovenosas intraorbitarias.

Figura 23. Angiomas orbitarios-malformaciones arteriovenosas. Al
colocarlos boca abajo aumentan de tamaño. Hay que hacer diagnóstico
diferencial por técnicas de neuroimagen.
El Eco-Doppler color, la TC y la RNM los definen con gran flujo y
vascularización (76).
Bajo control pediátrico se acelera su regresión con esteroides sistémicos
en pautas de varios meses. Si no remiten el interferón es la última modalidad
terapéutica (79-80). Los corticoides intralesionales (betametasona y
triamcinolona) producen reducciones rápidas pero también están descritas
múltiples complicaciones ya que la embolización fortuita de los vasos
intratumorales por vía retrógrada causa ceguera. La ecografía permite un
correcto abordaje de la lesión. El TC helicoidal da mejor definición y es muy
rápido (77-80).

Figura 24. La resonancia nuclear magnética delimita claramente el
angioma cavernoso intraconal.

Figura 25. Una hemorragia palpebral puede ser el primer síntoma de
una proptosis orbitaria.
La embolización en sospechas de malformaciones arteriovenosas, el uso de las
sustancias esclerosantes y la excisión quirúrgica está muy contestada en la
actualidad (76). Sólo en casos especiales de fácil abordaje y cuando el tumor
manifiesta su regresión se podría intentar esta última técnica (77).
La radioterapia causa demasiados problemas secundarios y está
contraindicada. Su uso en casos dramáticos refractarios a toda terapia, da
complicaciones secundarias y posibilidad de osteosarcomas por radiación
(81-82).
Los modernos láseres estéticos no permiten la penetración en toda la masa
tumoral y sólo en regresiones y resecciones cutáneas tiene su indicación
plástica (78).
Durante la evolución se producen astigmatismos muy marcados por lo que las
correcciones ópticas y terapias oclusivas son fundamentales.
Angiomas cavernosos
Es la causa más frecuente de proptosis en el adulto, mientras que son muy
raros en la edad pediátrica. Son lesiones intracónicas y de localización en
los cuadrantes inferolaterales. Las técnicas de neuroimagen moderna los
diagnostican sin dificultad (82-83).
A veces si son muy posteriores es preciso realizar orbitotomías laterales y
transcraneales (83-84).
Hemangiopericitoma
Raros, encapsulados, similares a los angiomas cavernosos del adulto pero más
complejos. Crecimiento más rápido con quemosis conjuntival y muy infrecuentes
en la infancia. El diagnóstico suele ser por anatomía patológica y diferido
(85-88). La clínica y métodos de diagnóstico radiológicos nunca se
aproximan.
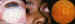
Figura 26. Fístula traumática arteriovenosa. Obsérvese el flujo
retrógrado y en el fondo de ojo vasos epiesclerales, con la proptosis
manifiesta por ingurgitación vascular orbitaria.
Su extirpación referida en la literatura debe ser total, porque puede
recurrir, malignizarse y dar metástasis, aunque con grandes intervalos de
tiempo (87,88). Sullivan refiere 5 características para diferenciarlo y llegar
a una presunción siendo la última una arteriografía carotídea. En su serie
(89) de 12 tumores en 23 años extraídos del Moorfields Eye Hospital reconoce
la dificultad en la exéresis completa y sobre todo su diagnóstico
preoperatorio.
SÍNDROMES DE ENMASCARAMIENTO
Fístulas arteriovenosas
Conexiones entre venas y arterias que previamente a un trauma eran normales.
En la infancia y en la literatura son muy raras. Las carótido cavernosas dan
las típicas cabezas de medusa epibulbares y epiesclerales, con proptosis
pulsátil, ruido, glaucoma y parálisis del sexto par. Las dúrales son más
insidiosas y producen ojo rojo crónico. En las técnicas de imagen se observa
dilatación de la vena oftálmica superior por arteriolización y engrosamiento
difuso de toda la musculatura orbitaria.
Arteriografías selectivas y embolizaciones son técnicas muy sofisticadas
que precisan gran especialización en el tema y muchas veces los resultados son
sólo paliativos (8,75,82).
El síndrome de Wiburn-Mason, consistente en aneurismas congénitos
arteriovenosos de la retina y cerebro a veces tiene afectación orbitaria
ipsilateral (90).
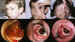
Figura 27. Linfangiomas orbitarios en diversos grados de evolución
dependiendo de las hemorragias en procesos catarrales y traumáticos.
Malformaciones vasculares/linfangioma
Son malformaciones vasculares con presencia de componentes venosos y
linfáticos. Muy infrecuentes, se presentan en el primer quinquenio de la vida.
Se localizan en la conjuntiva, párpados, órbita, orofaringe y senos
paranasales (82).
Pueden manifestar proptosis al nacimiento. Tras catarros o traumatismos se
exacerban debido a una probable respuesta inmunológica dentro del tejido
linfoide de la lesión. Lentos en su crecimiento, casi nunca regresan. La
afectación subcutánea hace que el párpado adquiera una coloración azul.

Figura 28. Malformación arteriovenosa orbitaria y epiescleral.
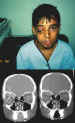
Figura 29. Traumatismo orbitario con gran hematoma que ocupa el
compartimento superióstico e intraconal.
Cuando sangran se forman en los canales linfáticos ectásicos los quistes de
chocolate y en la conjuntiva se aprecian dilatados y hemorrágicos (91-92).
El Eco-Dopler color, el TC y la RNM revelan masas no encapsuladas,
multiquísticas, irregulares de morfología anular con presencia de sangre
intratumoral y bastante captación de contraste (76).
El tratamiento quirúrgico es complicado porque nunca se consigue una
extirpación completa y se comprometen estructuras palpebrales y fondos de saco
que producen retracciones y hay que emplear cirugías reconstructoras complejas.
Al no estar encapsulados y ser infiltrativas si nos introducimos en la órbita
se pueden extirpar estructuras normales por no disponer de planos de clivaje
para diseccionarlas. Excisiones parciales y drenaje de quistes hemorrágicos
cuando son muy llamativos, solucionan temporalmente los cuadros clínicos y con
la edad los brotes disminuyen (93).
J.E. Wright ha publicado (94) que los linfangiomas orbitarios pertenecen al
complicado campo de las anomalías venosas que se interrelacionan, e incluso
parecen tener una solución de continuidad según su experiencia. Ya con el
paciente en la edad adulta tuvo que extirpar y realizar orbitotomías
descompresivas con abordajes laterales y transcraneales neuroquirúrgicos, por
el gran compromiso para el globo ocular y el nervio óptico que los macroquistes
producían.
Se recomienda buscar malformaciones vasculares cerebrales que se asocian con
linfangiomas en un 25% (92).
Malformaciones arteriovenosas
Son anomalías del desarrollo compuestas de anastómosis anómalas entre
arterias y venas sin lecho capilar que las interrelacione (94-97). A veces se
asocian con afectación cerebral y su tratamiento quirúrgico pasa por un buen
estudio angiográfico con oclusión selectiva de los vasos aferentes y excisión
de la malformación (76,96-98).
La radiocirugía con Gamma Knife o LINAC y las modernas técnicas de
implantes radiactivos intralesionales tienen futuro pero en la órbita por ahora
no están desarrolladas y en el cerebro puede haber recurrencias y
complicaciones (96-101).
Varices
Dilatación de las venas existentes en zonas orbitarias. Se manifiestan en
edad juvenil-adulta. Pueden dar hemorragias y trombosis con lo que la proptosis
intermitente que ordinariamente solo se observa en situación de pronación o
con la maniobra de valsalva se convierte en fija. En casos raros se pueden
asociar con varices intracraneales (94,102-103).
El Eco-Doppler color y el TC helicoidal hechos en decúbito prono, con
valsalva o presión sobre la yugular son diagnósticos. A veces se observan
flebolitos (76).
El tratamiento es conservador porque los hematomas desaparecen con el tiempo
y es imposible una completa resección quirúrgica. Los riesgos de afectación
visual y lesión de estructuras nobles en la órbita si les operamos son muy
grandes (102,103). La embolización con partículas (104) por vía venosa
retrógrada está referida en la literatura igualmente como paliativa con
mejorías parciales. La cirugía con extirpación, o con disección y
embolización in situ también está descrita, pero en las profundas implica un
alto riesgo para la visión que hay que valorar (102).
En la zona del saco lagrimal hay que hacer diagnóstico diferencial con
mucoceles etmoidales por su similar apariencia clínica (105).
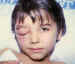
Figura 30. Celulitis orbitaria por herida perforante palpebral.
Hemorragias orbitarias
Secundarias a trauma, rotura de malformaciones arteriovenosas, linfangioma o
esfuerzos violentos (102). Están descritas hemorragias al practicar la maniobra
de valsalva (106). La RNM en series sucesivas de reabsorción del hematoma
permite observar la evolución sin ser intervencionista (76).
El drenaje y la aspiración sólo es necesario si la visión está
comprometida. La compresión del nervio óptico y el aumento de la presión
orbitaria impide la perfusión arterial del ojo. Son más frecuentes los quistes
hemáticos subperiósticos que tardan bastante en reabsorberse y que tenemos que
evacuar por vía transcutánea anterior si hay problemas (107-108).
INFLAMACIONES
La patología inflamatoria de la órbita adopta en su estructura diferentes
localizaciones y dentro de la infancia las infecciones son las más frecuentes.
Infecciosas
El considerar si la celulitis es preseptal u orbitaria, en disquisiciones sin
importancia artefacta los diagnósticos y retrasa los tratamientos, porque los
espacios están interrelacionados y el inicio de un orzuelo en condiciones de
inmunosupresión puede extenderse a otros compartimentos, desarrollar abscesos
subperiósticos, osteomielítis y afectación cerebral en diversas
manifestaciones y formas. Aun así el septum orbitario delimita la gravedad del
proceso y precisa cuando obligatoriamente debemos ingresar al niño en el
hospital (109-112).

Figura 31. Hipertiroidismo con engrosamiento de rectos inferiores.
Una sinustis etmoidal o un flemón dentario pueden continuarse con una
inflamación intraconal que afecta a la motilidad ocular, con un absceso y
extensión al ápex orbitario que compromete a la visión, e incluso llega al
seno cavernoso produciendo una trombosis que hace peligrar la vida del paciente
(112-115).
Si atraviesan las hendiduras y agujeros óseos alcanzan las meninges y el
cerebro dando inflamaciones y abscesos craneales (112-114).
El ingreso con estudio microbiológico, cobertura antibiótica apropiada y
exploraciones neuroradiológicas sensatas es obligatorio (112-114). Hay que
hacer tratamientos sintomáticos y de vecindad, teniendo las ideas claras. Si
evolucionan a abscesos hay que valorar cuándo deben ser drenados
quirúrgicamente. Es preceptivo utilizar las vías de abordaje correctas con
estudios de neuroimagen que descarten claramente la afectación de espacios
limítrofes (114,115).
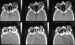
Figura 32. El TC delimita claramente la gran congestión de los
vasos y músculos orbitarios así como la proptosis.
Infecciones bacterianas.
Contigüidad de sinusitis, trauma, cuerpos
extraños y bacteriemia representan por este orden su incidencia etiológica. Si
realizamos cultivos y antibiogramas de las muestras y cavidades afectadas
sistemáticamente el Hemofilus influenza, estreptococo y estafilococo áureo son
los organismos más frecuentemente encontrados (115-118). García y Harris
proponen un tratamiento conservador para los abscesos orbitarios en niños
menores de 9 años. Consiguieron evitar en un 93% la cirugía de evacuación y
el drenaje subperióstico (117).
No infecciosas
Ya hemos explicado en otro capítulo que la orbitopatía tiroidea es muy
escasa en la infancia Tan sólo afectaciones palpebrales y mínimas
infiltraciones musculares se reflejan en la literatura (119,120).

Figura 33. Diferentes tipos de pseudotumores orbitarios.
Los pseudotumores, granulomas, miositis y adenitis al ser polimorfa su
composición inflamatoria admiten megadosis de corticoides y su respuesta
terapéutica es bastante eficaz. Con el tiempo la fibrosis reemplaza a la grasa
orbitaria y encapsula los músculos y el nervio óptico con lo que no hay
respuesta (121,123).
PSEUDOTUMOR ORBITARIO
Enfermedad inflamatoria idiopática de la órbita. Etiología desconocida.
Produce proptosis y/o desplazamiento del globo. Comienzo agudo o subagudo, con
dolor, restricción de movimientos, quémosis conjuntival y edema palpebral. Un
tercio de los casos son bilaterales. Son el 8,5% de las patologías orbitarias
de presentación tumoral. El 7% de los pseudotumores son pediátricos (123-124).
Las técnicas de imagen son variopintas en su diagnóstico. Varían en cada
caso. Las masas pueden ser irregulares o bien definidas con afectación única o
de varios tejidos orbitarios. Hay que descartar y establecer asociaciones con
enfermedades autoinmunes mediante estudios pediátricos completos que van más
allá de las atribuciones de un oftalmólogo. Por eso la importancia de
especialistas y oncoterapeutas (114).
Las miositis de uno o más músculos, compromiso de las vainas del nervio
óptico, de la esclera, coroides o de todos los tejidos son frecuentes. A veces
su presentación es atípica, sin dolor y con mínima inflamación (119,120).
Si se tratan con corticoides y antiinflamatorios orales responden bien en
etapas precoces. El peligro es enmascarar una metástasis (linfoma) que responde
espectacularmente y luego al rebrotar pasa a un estadio más avanzado. Los
pediatras y oncólogos aconsejan no usarlos pero cuando hay compromiso de la
agudeza visual nos vemos obligados a darlos intravenosos. Biopsias urgentes nos
facilitan su utilización (122,123). Hay que mantener la terapia corticoidea
durante meses, por el peligro de recurrencias.
La anatomía patológica resalta inflamación pleomorfa y reacción tisular
fibrovascular. La celularidad en su mayoría son linfocitos. A veces hay
eosinófilos. No hay las células gigantes ni epitelioides típicas de las
granulomato sis (122).
Los oncoterapeutas son reacios a la utilización de corticoides por el
peligro que los linfomas plantean en su diagnóstico diferencial. Éstos son
más silentes, con poco compromiso visual. El problema es que la batería de
pruebas diagnósticas que realizan e incluso la confirmación histológica
demora en varios días el tratamiento y la fibrosis sustituye al componente
inflamatorio por lo que la respuesta terapéutica es menor (122-125).
La radioterapia puede ser la última posibilidad e incluso no responden a
ella, quedando en la órbita masas densas que al resecarse quirúrgicamente
están necróticas.
GRANULOMATOSIS DE WEGENER
Patología multisistémica de etiología desconocida caracterizada como una
vasculitis necrotizante granulomatosa (126-128). Su rareza en la infancia, con
ocupación a veces de ambas órbitas, dolor, proptosis y afectación escleral es
realmente dramática (127). La respuesta a corticoides no era demasiado buena
antes de la combinación con antimitóticos (ciclofosfamida). También se
utiliza la ciclosporina para las recurrencias. Puede infiltrar la glándula
lacrimal y los músculos extraoculares. La cirugía sobre los granulomas no
parece tener mucho éxito, utilizándose sólo como descompresión (129,130).
Las biopsias y PAAF son complicadas. Para hallar el diagnóstico de vasculítis
y hay que combinarlas con múltiples pruebas de laboratorio y microbiología
(127,131,132). El tratamiento con trimetropin–sulfametoxazol se empleaba como
primera elección, pero no parece ser efectivo en la actualidad. La radioterapia
también es controvertida.
TUMORES ORBITARIOS MESENQUIMALES MUSCULARES
Rabdomioma
Hatsukawa presenta un niño de 16 meses con proptosis de 1 mes de evolución
y resección parcial quirúrgica. La histología demostró las características
benignas de la tumoración y durante 1,5 años de seguimiento no recibió
tratamiento adicional, sin mostrar signos de recidiva (133).

Figura 34. Rabdomiosarcoma de órbita izquierda.

Figura 35. La extirpación de rabdomiosarcomas utilizando la
crioterapia como elemento de tracción es una práctica habitual en la cirugía
de la órbita en la infancia.
Rabdomiosarcoma
Es la más frecuente de la tumoraciones orbitarias en la infancia. La media
de edad en su aparición son los 7-8 años. A veces es congénito. Resaltar que
en su origen provienen de células precursoras pluripotenciales que luego se
diferencian en músculo estriado. Así pues no salen de los músculos
extraoculares ni tienen solución de contigüidad con ellos. Pueden rodearlos y
establecer adherencias que resultan extremadamente difíciles de disecar. Es
raro en la edad adulta. Puede metastatizar. No suele afectar a las paredes
óseas. Actualmente los porcentajes de supervivencia sobrepasan el 95% si el
tumor está confinado en la órbita (134-139).

Figura 36. Diversas incisiones para extirpación o biopsia de
rabdomiosarcomas.
Proptosis y desplazamiento ocular son de rápida aparición. Traumatismos
accidentales o gradual crecimiento durante 1 mes, pueden retrasar el
diagnóstico al no ser tan aparentes. Edema palpebral y quemosis lo confunden
con pseudotumor orbitario o con alergias (140).
Eco Doppler color, TC y RNM son obligatorios y definen masas irregulares u
ovoideas, inicialmente bien circunscritas y posteriormente difusas, de
localización en tejidos blandos orbitarios, que captan contraste (141,142).
La biopsia intraoperatoria permite establecer el diagnóstico. Se necesita
bastante material para congelación, microscopia óptica, electrónica e
inmunohistoquímica. La cirugía pocas veces reseca todo el tumor ya que es
friable y casi nunca pequeño y circunscrito. La extracción con crioterapia,
sin dañar zonas vitales y ser meticuloso es fundamental. Saber concluir la
cirugía si las adherencias e infiltraciones hacen peligrar la estructura
orbitaria es de sentido común pero perjudica el ego de los cirujanos que
requieren resultados espectaculares (135,140,143).
Posteriormente la clasificación e inmunohistoquímica definen el tipo de
tratamiento.
Hay disparidad de criterios entre la escuela Europea y la Americana
(134-136).
En nuestro continente se somete a ciclos de quimioterapia que hacen
desaparecer la tumoración o la reducen significativamente. Trasforman en masas
menos friables y encapsuladas los restos del rabdomiosarcoma. De esta forma el
abordaje quirúrgico posterior permite extirpar los restos y la anatomía
patológica confirma un buen porcentaje de curaciones. Se evita los efectos
secundarios de la radioterapia y si es necesario utilizarla los niños son como
mínimo 1 año mayores con lo que resisten mejor la radiación (144).

Figura 37. Punción-extirpación medular y de líquido
cefalorraquídeo con análisis intraoperatorio en el Departamento de Anatomía
Patológica de la biopsia orbitaria previa congelación.
En Estados Unidos, se combinan las dos técnicas como primera terapia.
Son necesarias evaluaciones sistémicas por los onco y radioterapeutas ya que
hay posibilidad de metástasis tanto regionales como a distancia. TC de tórax,
biopsia y aspiración de médula ósea en combinación con la punción lumbar
son obligatorias (135,136).
Técnicas de futuro incluyen la radioterapia con control estereotáxico
usando Gamma Nyfe y TC helicoidal. Igualmente el LINAC y el Acelerador de
Protones están desarrollando protocolos para su uso en la edad pediátrica.
Abramson ha publicado (145) la utilización de implantes radiactivos dentro
de la órbita en recidivas pero la focalización de nuevas técnicas
radioterápicas está todavía en desarrollo para la infancia.
TUMORES MESENQUIMALES FIBROHISTOCITARIOS
Histiocitoma fibroso
Son tumores frecuentes en adultos y muy raros en la infancia pero los hay
descritos en niños de 6 meses (146,147). La localización es en la órbita nasal
superior. La histología revela una mezcla de histiocitos, fibroblastos y
células mesenquimales indiferenciadas. Aunque la mayoría son benignos hay
variedades malignas. Cuando aparecen mitosis, pleomorfismo y necrosis los
consideran malignos (148-150).
La extirpación quirúrgica, nuevas cirugías y quimioterapia son los
procedimientos de elección. La radioterapia adicional se emplea en la edad
adulta (151,152).
Tumor fibroso solitario de la órbita
Sólo había, en 1996, 8 casos descritos en la literatura. Proptosis de
aparición gradual. Benigno, se extirpa con facilidad. Puede recurrir. Es un
diagnóstico de anatomía patológica (153-156).
Fibromas
Son rarísimos en la órbita y se presentan en la adolescencia. Fibroblastos
y fibras de colágeno bien diferenciado son sus componentes. La cirugía extirpa
fácilmente los de localización anterior y subconjuntivales. Los localizados en
el saco y glándula lagrimal en sus disecciones son más complejos al estar
adheridos a las paredes óseas, con fibrosis en las estructuras subyacentes.
Nunca malignizan pero pueden recurrir. Los de cavidad nasal y áreas limítrofes
de afectación orbitarias requieren colaboración con otras especialidades
(18,156).
Fibromatosis
Es una lesión con proliferación de fibroblastos, benigna pero localmente
agresiva. Clínicamente y por anatomía patológica es una lesión intermedia
entre la fibrosis y el fibrosarcoma. Puede ser solitaria en un 73%,
multicéntrica (tejido subcutáneo, músculo esquelético, huesos largos) y
generalizada con afectación visceral. Más corriente en niños en 2:1 y crece
rápidamente en la órbita por lo que se confunde con fibrosarcoma. El
tratamiento es quirúrgico y suele haber recurrencias (148,157,158).
Fascitis nodular
Es una lesión fibrosa que afecta a párpados, conjuntiva, cápsula de tenon
y órbita. Puede ser solitaria, nodular o infiltrar los músculos vecinos. Crece
rápidamente, pareciendo una lesión maligna. La histología confirma su
benignidad. Apariencia inflamatoria, con erosión focal del hueso adyacente
(159,160).
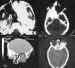
Figura 38. Diversos tipos de displasias fibrosas y osteomas en la
órbita y estructuras óseas abyacentes.
TUMORES ÓSEOS
Displasia fibrosa
Puede aparecer en la órbita o ser poliostótica. El síndrome de Albright
los asocia con hiperpigmentación cutánea y trastornos endocrinos. Se presenta
en las primeras tres décadas de la vida. Como consecuencia de alteraciones en
la maduración el hueso se desestructura, con estroma fibroso, focos líticos y
áreas muy vascularizadas (161,162). El tumor cruza las líneas de sutura y
afecta a múltiples huesos de la órbita. Se asocian con sarcomas óseos para
complicar las patologías (163). Puede ocurrir estrechamiento del canal óptico
y del sistema de drenaje lagrimal. Hay que practicar cirugía descompresiva en
la mayoría por vía neuroquirúrgica, aunque afortunadamente se puede demorar
hasta la edad juvenil sin compromiso de estructuras vitales (163-166).
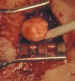
Figura 39. Osteoma del techo de la órbita.
Fibroma osificante juvenil
Es una variante de displasia fibrosa benigna con características
histológicas típicas y muchas espículas óseas con un estroma muy
vascularizado. Los localizados en el ápex orbitario dan alteraciones del nervio
óptico y defectos campimétricos. En el etmoides producen epífora por
obstrucción lagrimal (167,168).

Figura 40. Fibroma osificante juvenil diagnosticado en el Servicio
de Urgencias con gran proptosis y afectación de línea media.
Es monostótica y no cruza las líneas de sutura. En los senos paranasales se
complican con mucoceles (169,170).
Requiere grupos multidisciplinarios para su cirugía con vías de abordaje
consensuadas (171,172).
Osteomas
Tumores óseos benignos que aparecen casualmente en los bordes del seno
frontal o glabela sin causar problemas en su resección quirúrgica. Crecimiento
lento, bien circunscrito y composición de hueso maduro. No está claro si los
osteomas proceden de etiologías traumáticas, anomalías del desarrollo o
infecciones. Mayor afectación en varones y no suelen causar síntomas antes de
los 18 años. En el síndrome de Gardner (poliposis familiar) se asocian
múltiples osteomas (172).
La cirugía con extirpación del tumor se realiza cuando dan sintomatología
y afortunadamente son raras en pediatría. Las operaciones multidisciplinarias
con Neurocirujanos, Maxilofaciales y ORL se realizan cuando son adultos y hay
compromiso del nervio óptico en las lesiones del esfenoides (173,174).
Quistes aneurismáticos
Son masas benignas pseudotumorales de etiología desconocida. Parecen
lesiones reactivas a traumatismos, afectaciones óseas, vasculares, y fibromas
no osificantes de diversas localizaciones periorbitarias. Se tratan con
exéresis locales o curetajes en combinación a veces con otras especialidades
quirúrgicas. Se asocian más frecuentemente con displasias fibrosas. Los hay
descritos desde los 14 meses de edad (175-177).
Erosión de las paredes orbitarias y proptosis son sus características.
Suelen dar manifestaciones clínicas en la adolescencia. Los espacios quísticos
están rellenos de septos que contienen fibroblastos, histiocitos, osteoclastos
y trabéculas de hueso rellenas de osteoblastos. Hay calcificaciones
intalesionales (178,179).
La radioterapia está contraindicada en la actualidad. La embolizacion
selectiva de las lesiones favorece su calcificación (180-181).
Fibrosarcoma, condrosarcoma, osteosarcoma
Tumoraciones que tienen en común la mayoría de las veces un glioma o un
retinoblastoma radiado previamente con predisposición genética, apareciendo
como segundas neoplasias varios años después.
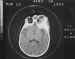
Figura 41. Sarcoma de Ewing con gran osteolisis de la órbita
derecha.
El fibrosarcoma congénito y el infantil son raros, de crecimiento rápido y
baja incidencia en metástasis. Los juveniles si se extirpan radicalmente tienen
buen pronóstico (18,146,182).
Tumor de Ewing
Representa el estadio final e indiferenciado de un espectro de células
tumorales óseas de origen neural. La célula original todavía es
controvertida. El tumor engloba huesos largos, costillas y pelvis. Afecta la
órbita secundariamente con metástasis. El 75% de los pacientes son jóvenes
menores de 20 años (183).
Comienzo insidioso. La oftalmoplejía y la ptosis preceden a la proptosis y
al desplazamiento del globo. La necrosis hemorrágica puede simular una
osteomielitis. Síntomas de fatiga, anorexia, pérdida de peso y fiebre se
asocian con metástasis sistémicas presentes entre el 10-30% de los pacientes
al momento del diagnóstico (184).
Se tratan con quimioterapia y radioterapia inicialmente. La cirugía se
reserva para un segundo estadio. Combinando esas 3 técnicas se consigue un 53%
de supervivencia a los 5 años y las metástasis disminuyen a un 5% (183,184).
TUMORES DEL NERVIO ÓPTICO Y DE DIFERENCIACIÓN NEURAL
Gliomas del nervio óptico
Suelen ser benignos y aparecen como media a los 9 años. Gliomas malignos son
muy raros y prácticamente no hay en la infancia. A menudo son bilaterales (185)
y afectan por igual a chicos y niñas. Según Dutton (29) la alteración
primaria orbitaria es en un 24%, el quiasma en un 76% y el cerebro medio y
tercer ventrículo en un 46%. 25-50% de ellos se asocian con neurofibromatosis
(186-189).

Figura 42. Gliomas de nervio óptico, papila, astrocitoma, con
shunts arteriovenosos en la retinografía del polo posterior. En la ecografía
se aprecia la ocupación de toda la órbita. Entre un 25 y un 50% se asocian con
neurofibromatosis.
Proptosis axial gradual y unilateral, no dolorosa, con pérdida progresiva de
visión y defecto pupilar aferente son sus características clínicas. La
atrofia óptica dobla en frecuencia al edema de papila.
En la mayoría de los casos son autolimitados y crecen muy lentamente. Hay
autores que los consideran hamartomas. Transformaciones quísticas de las
lesiones pueden hacerlos crecer sin que se demuestre crecimiento celular (190).
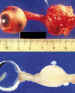
Figura 43. Gliomas extirpados antiguos. Piezas de anatomía
patológica.
Los gliomas ópticos se autolimitan en su crecimiento dentro del nervio sin
invadir la duramadre, mientras que los asociados a neurofibromatosis proliferan
en el espacio subaracnoideo siendo menos fusiformes (191).
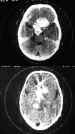
Figura 44. Glioma de quiasma y cintillas ópticas.
El TC y la RNM delimitan la extensión y características de la invasión de
canal óptico y quiasma, teniendo la RNM más definición.
Es innecesario realizar una biopsia de los gliomas, aunque la anatomía
patológica es definitiva. Hay falsos diagnósticos con meningioma debido a una
hiperplasia meníngea reactiva alrededor de la tumoración, teniendo que
profundizar en la biopsia para obtener la del glioma.
Hay mucha controversia en el tratamiento de los gliomas de nervio óptico
(189). Cada caso debe ser individualizado y las decisiones tomadas en función
de las características de crecimiento del tumor, el tamaño y extensión en el
nervio óptico, si está afectado el quiasma, etc.

Figura 45. Neurofibromatosis que ocupa el macizo craneofacial con
abombamiento de las paredes óseas.
Es importante la historia clínica, los tratamientos previos, la agudeza
visual del ojo afecto y la del sano. Resaltar la evolución radiológica con
controles periódicos de TC y RNM. Hay que evaluar alteraciones neurológicas,
la edad de los pacientes, su proptosis, molestias, alteraciones estéticas y
sistémicas (187).
En el Hospital Infantil La Paz somos partidarios de observarlos con controles
periódicos de neuroimagen mientras la agudeza visual sea buena. Hay muchos
pacientes en la literatura que mantienen la visión durante años y nunca
requieren cirugía.
En los masivos para evitar la infiltración quiasmática se usa una
orbitotomía transcraneal neuroquirúrgica. Se excinde el nervio óptico con
liberación del canal y colocamos una prótesis integrada en la órbita
suturándola a la musculatura extrínseca. El intentar conservar el ojo es una
utopía si crecen rápidamente o son muy desfigurantes.
Son casos límite la evidencia por RNM de estar a 3 mm del quiasma, el tener
buena visión y la presencia de lesiones quísticas intratumorales que
artefactan su real crecimiento. Sucede a veces que pese a la negatividad de las
exploraciones complementarias, la invasión del quiasma se comprueba por
anatomía patológica tras la cirugía y nos deja en mal lugar pese a los
avances de la tecnología (187).
La quimioterapia permite retrasar la necesidad de radioterapia con lo que las
funciones endocrinas y su desarrollo cerebral son mejores, pero no es la
panacea.
La radioterapia externa es la última posibilidad cuando no se puede resecar,
el tumor sigue creciendo a través de quiasma y cintillas ópticas y aparece
sintomatología neurológica. Las complicaciones secundarias de la radiación en
el crecimiento de estos niños y la aparición de segundos tumores son
importantes (186).
La mortalidad cuando llegan al quiasma es del 20% a los 10 años, en el
cerebro del 55% y en la orbita del 5% (189).
Las nuevas máquinas Gamma knyfe, LINAC (Acelerador lineal tridimensional) y
Protones, parecen aportar nuevas terapéuticas pero actualmente hay muy poca
experiencia en el ámbito mundial en oftalmología pediátrica.
Neurofibromas
Tumoraciones de los nervios periféricos en párpados, orbita, SNC y
vísceras. Durante la infancia sólo se manifiesta la neurofibromatosis tipo 1
que presenta un crecimiento plexiforme con afectación sistémica. Se conoce
como enfermedad de Von Recklinghausen y es autosómica dominante con penetrancia
incompleta. Es englobada en el grupo de las facomatosis y tiene múltiples
características (manchas de café con leche, displasia de paredes orbitarias,
glaucoma, gliomas del nervio óptico) (190).

Figura 46. Cirugía en un neurinoma plexiforme. Obsérvese los
neurofibromas que como gusanos afloran de la incisión quirúrgica. Tuvimos que
realizar suspensión al frontal con PTFe.
En la cirugía los neurofibromas aparecen como gusanos tortuosos que
infiltran los párpados y la órbita entre el tejido normal por lo que su
extirpación total es muy complicada al implicar los fondos de saco y las
conjuntivas, la glándula lagrimal y el elevador. Su resección implica afectar
a estas estructuras por lo que hay que realizar suspensiones al frontal,
injertos de mucosa para reconstruir los fórnix y cirugía plástica (191-193).
Si además presentan una proptosis pulsátil por displasia esfenoidal, puede
haber herniación cerebral. Las técnicas de reconstrucción con cirujanos
maxilofaciales y craneales son bastante complejas y los resultados estéticos
variables por la gran remodelación que precisan (193,194).
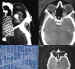
Figura 47. TC de meningiomas adultos. 1: Meningioma orbitario
calcificado. 2: Meningioma bilateral. 3: Análisis densitométrico del caso 1.
4: Meningioma de ala de esfenoides.
Un 15% de neurofibromatosis tipo 1 presentan gliomas del nervio ópticos
control y evaluación es similar a las descritas en el apartado gliomas, pero en
su pronóstico y dificultad quirúrgica son más complicados (195).
Meningiomas
Son tumores que derivan de los plexos aracnoideos, siendo la mayoría
intracraneales, en el surco olfatorio, ala mayor del esfenoides y supraselares,
invadiendo la órbita secundariamente a través del hueso, canal óptico y
hendidura esfenoidal (82,196,197).
De 100 meningiomas sólo el 2,8% (2,2% de los tumores cerebrales en la edad
evolutiva) corresponde a la infancia (196).
Los primarios orbitarios también son muy infrecuentes y se forman en la
aracnoides de la vaina del nervio óptico. Los bilaterales son raros a cualquier
edad. En 9% de todos los meningiomas se asocian con neurofibromatosis (198,199).
Defectos visuales, papiledema, proptosis, edema palpebral o quemosis son sus
manifestaciones.
El TC demuestra hiperóstosis y calcificaciones anormales intratumorales. La
RNM con gadolinio delimita claramente su extensión pudiendo definirse el nervio
óptico rodeado por la tumoración. Es la técnica de elección cuando el
meningioma está confinado en la órbita y tiene buena agudeza visual (200).
Otalmoplejía, defecto pupilar aferente y shunts opticociliares con distintas
imágenes en la papila son típicos y dependen de la evolución (201).
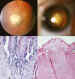
Figura 48. Una masa angiomatosa (1, 2 y 4) enmascaró en la papila
la presencia de un meduloepitelioma del nervio óptico (3).
El tratamiento como en los gliomas debe ser individualizado. La pérdida
visual y la extensión intracraneal son factores importantes. Con radiación
mejora la agudeza visual y se estabilizan (202,203). La cirugía es muy
complicada y requiere mucha meticulosidad para extirpar el tumor sin dañar la
visión. La quimioterapia no sirve para nada. Por suerte en niños no se dan
meningiomas con proptosis invalidante y pérdida de agudeza visual (204). No
precisan extirpaciones del tumor desde el globo ocular hasta el quiasma como
sucede en los adultos. La supervivencia es excelente no existiendo en la
literatura casos de muerte directa por el meningioma y sí por la cirugía. La
mejoría de la agudeza visual tras radioterapia no compensa las complicaciones
que puede producir en el desarrollo de los niños. Los hay que crecen hacia seno
cavernoso y carótida siendo zonas de difícil acceso neuroquirúrgico y con
posibilidades de producir iatrogenia (205,206).
Meduloepiteliomas del nervio óptico
Rara entidad tumoral definida como una neoformación constituida a partir de
restos embrionarios del primitivo epitelio medular, que incluye estructuras
derivadas de la vesícula óptica. Llama la atención revisada la literatura la
mayor incidencia de distal a proximal en la localización de los dictiomas
oculares. Así frente a los más de 70 casos descritos en la literatura mundial
en cuerpo ciliar, disminuye bruscamente su incidencia en la localización
retiniana y en papila sin afectación de la lamina cribosa, siendo rarísimos
los de nervio óptico (207,209).

Figura 49. Extirpación de un neurinoma orbitario con la ayuda de
crioterapia.
Sólo hemos encontrado 4 casos en la literatura mundial de estos últimos.
Al Hospital Infantil La Paz nos remitieron en 1982 un niño de 12 años con
una masa angiomatosa blanquecina-amarillenta que enmascaró en la papila durante
mucho tiempo la presencia de un meduloepitelioma (dictioma) del nervio óptico.
El curso clínico progresivo y la TC verificaron un diagnóstico de presunción
hacia otro tipo de patología. La anatomía patológica tras biopsia realizada
por neurocirugía, fue decisiva en el hallazgo tumoral que es el quinto
existente en la literatura mundial y el primero en nuestro país de
localización en el nervio óptico.
Los casos encontrados en aquel tiempo eran muy pocos para predecir un
pronóstico pese a su agresividad tumoral (210). La exenteración fue denegada
por la familia y se le sometió a radioterapia. Tras 18 años de supervivencia,
nuestro caso rompe todos los pronósticos existentes en la literatura.
Neurinomas (schwannomas)
Hay series publicadas que los delimitan como el 6,8% de los tumores
intracraneales, pero sólo el 1,1-5,7 de los intraorbitarios (82).
Aparecen en niños por encima de los 8 años. Son proliferación de células
de Schwan rodeadas por el perineuro de nervios orbitarios. Están bien
encapsulados por lo que su extirpación es sencilla. En la literatura se
manifiesta facilidad para la recurrencia incluso cuando la escisión fue
completa. Pueden malignizarse esos restos (11,211-215).
No se asocian con neurofibromatosis.
Tumor maligno periférico de las vainas de los nervios
Neoplasia que en pacientes con neurofibromatosis plexiforme se desarrolla
alrededor de los 10 años. También aparece espontáneamente o tras
radioterapia, en la segunda década. Afecta al supraorbitario principalmente y
puede invadir el cerebro por contigüidad dando metástasis a pulmones y
ganglios linfáticos regionales. La aparición de dolor, hipoestesia y rápido
crecimiento en pacientes con la enfermedad de Von Reklinghausen es muy
significativa. Hay destrucción ósea y aumento de las hendiduras orbitarias.
Pese a realizarles exenteraciones radicales, quimioterapia y radioterapia, el
pronóstico vital es funesto. Antiguamente se clasificaba como neurinoma o
neurilemoma maligno (215-219).
TUMORES NEUROEPITELIALES
Tumor neuroectodérmico melanótico
Tumor derivado de la cresta neural con marcada diferenciación hacia epitelio
pigmentario y poca maduración del componente neuroblástico. Infiltra la órbita
secundariamente desde el maxilar. Hay descrita afectación primaria. Es benigno
y se reseca sin problemas (220,221). Con PAAF Galera-Ruiz ha presentado en 1999
un artículo de diagnóstico preoperatorio sobre este raro tumor de la edad
neonatal (222).
Tumor neuroectodérmico periférico (pPNET)
El concepto de tumor neuroectodérmico primitivo está en constante
evolución. En el momento actual ya no están confinados en el sistema nervioso
central SNC (PNET) sino que han aparecido fuera de su primitiva localización y
se denominan pPNET. Son tumores que habían sido incluidos dentro de los Ewing
con los que comparten alteraciones genéticas y musculares con diferenciaciones
neuronales. En el capítulo de Patología los consideran extremos polares de un
mismo grupo tumoral. La inmunohistoquímica ha permitido diferenciarlos en estos
últimos años subdividiéndolos en varios subgrupos.
Los tumores ectodérmicos periféricos (pPNET) son rarísimos en la órbita.
Según Kiratli en su revisión de 1999 sólo 5 casos se conocen en la literatura
en edad pediátrica (223).
No hay consenso acerca el mejor tratamiento de estos tumores. Los de
localización orbitaria pueden tener afectación ósea y extensión
extraorbitaria regional. No metastatizan como los de otras localizaciones por lo
que su pronóstico es mejor. Pueden tratarse como los Ewing y se consideran más
agresivos que los rabdomiosarcomas (224,225).
En la cirugía nuestro caso parecía un rabdomiosarcoma y se siguió las
pautas de biopsia/ex tirpación que utilizamos habitualmente. La posterior
clasificación por immunohistoquímica definió la patología. Se trató como un
tumor de Ewing y en 2 años de evolución no ha habido incidencias.
TUMORES HEMATOPOYÉTICOS
Es una compleja y confusa miscelánea de lesiones de la órbita, anejos
oculares y globo con interrelación en entidades, con clínica, histología,
inmunología y genética molecular muy variada. La incidencia a medida que
avanzamos en sus conocimientos es cada vez más frecuente, pero todavía no
hemos descifrado los factores que la producen.

Figura 50. Los tumores hematopoyéticos (leucemias) se presentan en
la órbita como infiltración de una manifestación sistémica.
Han pasado muchos años y la interfase entre la hiperplasia linfoide y los
linfomas pasa por una gran variedad de patologías intermedias con gran cantidad
de manifestaciones que se escapan a este capítulo.
Linfomas
Knowles y Jakobiec señalan en 1983 que nunca habían visto un linfoma en la
órbita como parte de una enfermedad sistémica en niños. El único linfoma que
aparece en la órbita es el de Burkitt y en la infancia se pueden
localizar en África. Es un tumor linfocítico altamente indiferenciado que
afecta el doble a los varones africanos, con localización maxilar y en la
glándula lacrimal. Uni o bilateralmente la malaria y el virus de Epstein Bar se
relacionan con esta patología africana (22,226).
Las variedades no africanas son escasísimas en órbita. Sólo hay 2 ó 3
casos descritos en la literatura. J. Shields (228) presenta el caso de un niño
americano diagnosticado de linfoma primario.
La inmunosupresión, los trasplantes de médula ósea y el SIDA en la
infancia pueden aumentar la incidencia de metástasis en la órbita.
Responden bien a la quimioterapia con remisión prolongada en la mayoría.
Algunos remiten espontáneamente. La radioterapia en dosis de 2.500-3.000 rads
se emplea en los orbitarios con excelente control. Metastatizan con frecuencia
en la órbita (227,228).
Tumores de células plasmáticas
Infrecuente en la infancia por ser predominantemente una neoplasia de variada
virulencia desde benignas y reactivas a malignas.
Las lesiones orbitarias pueden ser la primera manifestación de la enfermedad
sistémica. Proptosis dolorosa y ptosis con infiltración subconjuntival,
afectación de los senos paranasales con destrucción ósea, celulitis
orbitaria, diplopía y edema palpebral. Todos los familiares deben ser
examinados oftalmológicamente (229-231).

Figura 51. Sarcoma granulocítico (cloroma).
El tratamiento quirúrgico debe ser realizado con precaución. La
radioterapia muestra buena respuesta aunque los hay radiorresistentes. Asociada
al mieloma múltiple cuando progresa a través de los ganglios linfáticos tiene
una supervivencia de menos de 2 años (232,233).

Figura 52. PAAF, punción medular y orbitotomía para localización
y extirpación parcial del cloroma.
Leucemias
Son características las afectaciones oculares y orbitarias. Se aprecian por
infiltración en casi todas las estructuras del ojo. En la órbita dan
infiltraciones difusas. La alteración hematológica produce hemorragias y
hematomas que enmascaran los procesos (233-236).
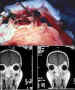
Figura 53. Granuloma eosinófilo con afectación del techo de la
órbita y pared frontal cerebral.
En las linfoblásticas se afecta predominantemente el nervio óptico. Las
mieloblásticas pueden debutar con manifestación orbitaria dando el denominado
Cloroma o Sarcoma granulocítico. Hay más frecuentemente afectación orbitaria
en las agudas que en las crónicas (237-239).
Por regla general las manifestaciones sistémicas y afecciones cutáneas no
hacen preciso la realización de biopsias orbitarias. Con PAAF se diagnostican y
el tratamiento con quimioterapia sistémica reduce las alteraciones en el ojo y
la órbita. Hay que tomar muestras del centro de la lesión porque en la
periferia los cambios inflamatorios secundarios pueden dar falsos negativos
(240-242).
Puede haber afectación osea. En la actualidad hay mejores expectativas de
supervivencia si el tratamiento con quimioterapia precede a la aparición de
infiltración leucémica en la médula ósea y sangre periféricas. Precisan
trasplante de médula osea para completar su evolución. La radioterapia es la
última posibilidad (243).
La genética está desarrollándose en este tipo de tumores intentando
mejorar el diagnóstico y el tratamiento (244).
Histiocitosis y TUMORES ÓSEOS
|
Granuloma eosinófilo, histiocitosis X, Hand-Schüller Christian,
Letterer-Siwe son conceptos antiguos que han sido desplazados por los términos
granuloma eosinófilo unifocal o multifocal del hueso e histiocitosis difusa de
tejidos blandos.
|
Hay localización solitaria (granuloma eosinófilo) con proliferación de
histiocitos en varios tejidos en la primera década de la vida, lesión lítica
del techo de la órbita o del ala del esfenoides e inflamación perilesional del
tejido limítrofe (245).
Aunque la manifestación orbitaria sea única, el seguimiento debe de ser
minucioso porque pueden aparecer manifestaciones multiorgánicas con
diseminación sistémica (246).

Figura 54. Xantogranuloma juvenil en diversas fases de reabsorción
de las hemorragias en cámara anterior. Manifestaciones cutáneas.
Por debajo de los 2 años la supervivencia se refiere en la literatura como
del 50%. Después aumenta hasta el 87% (245).
La confirmación histológica con PAAFS, raspado de la lesión, corticoides
intralesionales o bajas dosis de radiación define la evolución. Se dan falsos
positivos de malignidad y la resección en bloque con los neurocirujanos del
hueso para mejor preservar los márgenes quirúrgicos es obligada. Al analizar
las piezas se confirma el fallo diagnóstico de las biopsias in situ. Algunas
veces se han descrito remisiones espontáneas (247,248).

Figura 55. Inflamación de la glándula lagrimal. Tenemos que hacer
diagnóstico diferencial con pseudotumor.
Xantogranuloma juvenil
También llamado nevoxantoendotelioma y es en su rareza una afectación que
pocas veces tiene localización orbitaria. Se da en niños por debajo de los 2
años y afecta a la piel y al iris dando hemorragias en cámara anterior,
glaucoma, dolor y fotofobias. Son proliferación de histiocitos preferentemente
siendo una histiocitosis no Langerhans' y las características células de
Touton están descritas en todos los tratados. Tienen tendencia a regresión
espontánea. Se presentan con proptosis unilateral y en la mayoría de los casos
antes de los 6 meses de vida afectando a la órbita y músculos extraoculares
(249-251).
Figura 56. Angiofibroma maxilar con afectación orbitaria.
Corticoides sistémicos y radioterapia en dosis bajas son las elecciones de
tratamiento si se agravan y no se aprecia remisión (252,253).
Tumores de glÁndula lacrimal
En la fosa lagrimal el dermoide es la patología más diagnosticada de todas
las exploraciones complementarias neurorradiológicas por paradójico que
resulte (17).
Clínicamente las dacrioadenitis como variantes de los pseudotumores son
masas inflamatorias de etiología desconocida que conviene diferenciar con las
neoplasias. Las proliferaciones linfoides, linfomas de bajo grado y asociaciones
con patologías inflamatorias están muy poco definidas en la literatura y en la
infancia (254).
Las técnicas de neuroimagen delimitan los procesos pero hay diagnósticos
erróneos que pueden resultar fatales. El tratamiento con corticoides y las
biopsias para evitar enmascarar los linfomas pueden dar sorpresas con la
aparición de otras tumoraciones
Tumores epiteliales. El 50% son adenomas pleomorfos también llamados tumores
mixtos benignos. La otra mitad son carcinomas y de éstos en el adulto los
adenoquistocarcinomas son mayoría (255).
El tumor epitelial primario es el más infrecuente de todos en la infancia y
se da a partir de los 10 años.

Figura 57. Exentación radical por un tumor sinusal.
El mixto benigno también conocido como adenoma pleomórfico, en los adultos
debe ser resecado con su pseudocápsula intacta por el peligro de recidivas que
pueden dar degeneraciones malignas. Desde el año 1979 todavía nadie ha
rebatido la experiencia personal de John E. Wright contraindicando las punciones
y biopsias. Lo lógico es intentar resecarlo in toto con cápsula y márgenes de
seguridad. Como a veces se rompe la cubierta se puede mandar una muestra
intraoperatoria y maniobrar dependiendo del resultado. Por desgracia hay
extensiones microscópicas del tumor fuera de la cápsula y recurren si no se
quita suficiente margen del tejido orbitario cicunferencial. En los niños hay
división de opiniones y se preconiza biopsiar primero en los últimos años. El
problema en las recidivas es su riesgo de degeneración maligna. Con todo es muy
importante planificar interdisciplinariamente la operación con los diversos
servicios hospitalarios en un primer abordaje, porque si las extirpaciones
radicales se hacen en segundos tiempos o tras las recidivas el pronóstico es
muy malo (256).
El adenoquistocarcinoma de glándula lagrimal o cilindroma también es raro
pero hay varios artículos en la literatura sobre la infancia en los que se
muestra la tendencia a desarrollar rápidamente y erosionar el hueso, con dolor
por invasión perineural. Rootman refiere que la ausencia de erosión no excluye
la malignidad por la gran remodelación ósea que se puede ver en la niñez con
crecimientos rápidos (257).
Tellado en 1997 presenta 11 casos con una media de edad de 14 años (2-18) y
mayoría niñas con mejores perspectivas de supervivencia.
Su pronóstico pese a la quimioterapia, radioterapia y cirugías mutilantes
interdisciplinarias con extirpaciones en bloque del macizo facial no da
resultado. Aunque se combinen todos los procedimientos, el índice de
supervivencia es malo pese a tener menor agresividad histológica que en los
adultos (258).
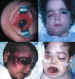
Figura 58. Diversas extensiones extraoculares del retinoblastoma.
TUMORES ORBITARIOS SECUNDARIOS
Son los que se extienden a la órbita desde las estructuras contiguas como
globo ocular (retinoblastomas), párpados (carcinomas), senos paranasales
(mucoceles, mucopioceles, angiofibromas, carcinomas, sarcomas, displasias y
osteomas) o cerebro (meningiomas). Algunos como los meningiomas, displasias y
alteraciones óseas se han tratado brevemente y otras se incluirán dentro de
las especialidades respectivas en otros capítulos (259).
Extensión extraocular del retinoblastoma
El retinoblastoma en el momento que atraviesa las envolturas oculares ha
tenido a lo largo de los años un pronóstico vital muy malo, pese a la mejoría
de las medidas terapéuticas empleadas.
No hay sintomatología orbitaria si la extensión es microscópica. La
importancia de un buen patólogo es fundamental para delimitar la infiltración
del ojo (260).
Las vías de extensión que debemos tener en mente al utilizar exploraciones
complementarias con RNM cada 6 meses y TC cada 2 años en gran parte debido a la
evolución y mantenimiento de los globos oculares gracias a la quimioterapia
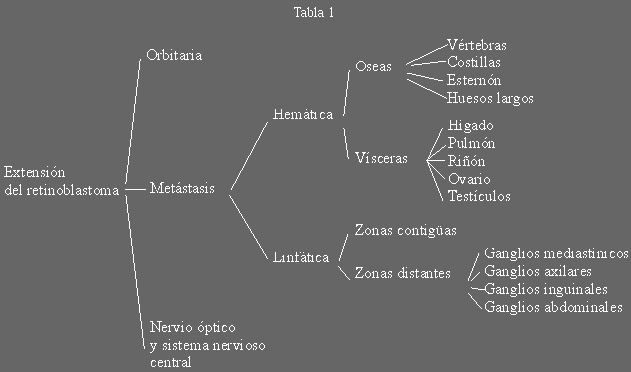
están descritas en la tabla 1 (261,262).
La genética es fundamental para el despistaje de portadores y pacientes con
riesgo de desarrollar la enfermedad. Los estudios neurorradiológicos siempre
deben incluir cortes craneales porque el pinealoblastoma debe estar presente en
nuestras mentes pese a su rareza.
Igualmente segundos tumores y tumores por radiación pueden aparecer durante
toda su vida. No es aconsejable radiar antes del año de edad por el riesgo que
representa. Debemos mantener con quimioterapia al niño durante meses para
conseguirlo (263-265).
Hay que mentalizar a la familia diciéndoles que los oftalmólogos controlamos la
parte que nos corresponde, pero las revisiones oncológicas con estudios de
neuroimagen, analíticos, etc. deben simultanearse por pediatras con práctica
en tumores oculares y orbitarios. Cuando más seguros estamos y menos se piensa
puede saltar la liebre (266-268).
Igualmente participarles y que se involucren en el sinvivir de las
revisiones. Que conozcan el riesgo que representa intentar conservar la poca
agudeza visual que tienen cuando al ser bilaterales, hemos agotado todas las
medidas terapéuticas y nos vemos en la obligación de enuclear el ojo con mejor
agudeza visual (269).

Figura 59. Metástasis de neuroblastoma con desestructuración de
toda la cavidad orbitaria.
Estéticamente una prótesis interna vascularizable (270) es preferible a un
ojo amaurótico radiado cuando da problemas en su control.
En Estados Unidos el porcentaje de supervivencia en series publicadas es del
90-95%. Afortunadamente aparecen resultados esperanzadores en otros países
donde las condiciones médicas no son tan buenas. Kiratli presenta en 1998 (271)
un estudio sobre 16 casos límite de retinoblastoma, tratados agresivamente con
exenteración orbitaria, quimioterapia y/o radioterapia con magníficos
resultados. Estas técnicas tienen absoluta vigencia hoy en día, pero si la
extensión en la órbita es masiva las posibilidades de metástasis y mal
pronóstico vital son muy elevadas.
Se están desarrollando implantes intraorbitarios radiactivos en las
recidivas y las nuevas técnicas de estereotaxia con LINAC, Gamma Nyfe y
Protones usando el TC helicoidal pueden tener un gran futuro.
Melanomas
Sólo 2 casos en la literatura con afectación orbitaria por melanomas de
uvea son referidos en la literatura en edad neonatal (272). Broadway presenta un
caso dramático de extensión extraocular y melanoma diseminado (273). Según
Barr en su serie de 42 pacientes obtuvo un 25% de mortalidad. Los factores de
mal pronóstico son semejantes a los de los adultos (274).
TUMORES METASTÁSICOS
Neuroblastomas
Es un tumor embrionario de la cresta neural que aparece en cualquier lugar
del sistema nervioso simpático con un comportamiento variable. Puede crecer
rápidamente, regresar o incluso madurar a ganglioneuroma. Requiere un completo
examen oncológico y exploraciones complementarias por su diversificacion. La
primera manifestación orbitaria a veces es una proptosis brusca y equimótica.
La aparición de sangre en el párpado inferior da la impresión equivocada de
traumatismo. Hay destrucción ósea. Los neuroblastomas congénitos de la cadena
simpática cervical pueden producir un Horner homolateral con heterocromía
(275-277).
La biopsia orbitaria a veces es innecesaria por ser la clínica y la
especificidad de los estudios sistémicos e inmunohistoquímicos definitivos.
Con todo es obligatoria una confirmación histopatológica aunque sea de otras
estructuras diferentes a las orbitarias (278,279).
La órbita y los párpados son afectados bilateralmente a veces dando una
imagen similar a los ojos de un oso panda.
El pronóstico es muy malo pese a utilizar todas las posibilidades de
quimioterapias, radioterapia y transplantes de médula ósea (280-282).
BIBLIOGRAFÍA
- Reese AB. Tumours of the eye. New York: Hoeber; 1963.
- Lloyd GAS. Radiology of the orbit. Philadelphia: WB Saunders; 1975.
- Henderson JW. Orbital tumours. Philadelphia:WB Saunders; 1977.
- Jakobiec FA. Ocular and adnexal tumours. Birminghan, Alabama: Aesculapius
Publishing Co; 1978.
- Jones IS, Jakobiec FA. Diseases of the orbit. Hagerstown, Maryland: Harper
&Row; 1979.
- Henderson JW, Campbell RJ, Farrow GM,et al. Orbital tumours. 3ª ed. Brian
G Decker Thieme Straton. New York; 1980.
- Rootman J. Diseases of the orbit. A multidisciplinary aproach.
Philadelphia: Lippincot; 1988.
- Shields JA. Diagnosis and management of orbital tumours. Philadelphia: WB
Saunders; 1989.
- Taylor D. Paediatric Ophthalmology. Oxford: Blackwell Science; 1990.
- Gutiérrez Díaz A. Tomografía axial computarizada. Tumores de órbita.
Madrid: Universidad Complutense de Madrid. 1978. Tesis doctoral.
- Gutiérrez Díaz A, Abelairas JM, Sebastian de Erice M. Orbital neurinoma
(Schwamnoma, neurilenmoma). Orbit 1982; 1(4): 241-250.
- Pérez Moreiras J. Patología orbitaria. Exploración clínica,
diagnóstico y cirugía. LXII Ponencia Oficial de la Sociedad Española de
Oftalmología. Barcelona: Comercial Pujades; 1986.
- Gil-Gibernau JJ. Oftalmología en la infancia. Clínica, diagnóstico y
tratamiento. Barcelona: Scriba SA. 1991.
- Zaragoza P. Cirugía básica de anejos oculares. LXX Ponencia Oficial de
la Sociedad Española de Oftalmología. Madrid: Tecnimedia Editorial; 1996.
- Gil-Gibernau JJ. Tratado de Oftalmología Pediátrica. Barcelona:
Comercial Pujades; 1997.
- Abelairas J. Análisis densitométrico de la patología tumoral de
afectación orbitaria. Madrid: Universidad Autónoma de Madrid. 1979.Tesis
doctoral
- Abelairas J, Nombela L, Parera C, García Alix C. Experiencia de 10 meses
en el uso de la tomografía axial computarizada en patología orbitaria. Arch
Soc Esp Oftalmol 1977; 37(9): 811-824.
- Shields JA, Bakewell B, Augsburger JT, et al. Space ocuping orbital
masses in children. A review of 250 consecutive biopsies. Ophthalmology 1986;
93: 379-384.
- Bullock JD. Orbital tumours in childhood.Ophthalmology 1986; 93: 384-387.
- Silva D. Orbital tumors. Am J Ophthalmol 1968; 65: 318-339.
- Belmekki M, El Bakkali M, Abdellah H, et al. Epidemiology of orbital
processes in children. 54 cases. J Fr Ophtalmol 1999; 22: 394-398.
- Templeton AC. Orbital tumours in african children. British J Ophthalmol
1971; 55: 254-261.
- Sindhu K, Downie J, Ghabrial R , Martin F. Aetiology of chilhood
proptosis. J Paediatr Child Health 1998; 34: 374-376.
- Youssefi B. Orbital tumours in children. J Pediatr Ophthalmol Strabismus
1969; 6: 177-181.
- Lyons C, Rootman J. In: Taylor ed. Pediatric Ophthalmology.Orbital
diseases in children. Oxford: Blackwell SC; 1997; 27: 302-308.
- Koornneef L. Sectional anathomy of the orbit. Amsterdam: Aeolus Press;
1981.
- Blodi FC, Mackensen G, Neubaer H. Surgical Ophthalmology. Berlin:
Springer-Verlag; 1991.
- Bullock JD, Goldberg SH, Rakes SM. Orbital tumors in children. Ophthal
Plast Reconstr Surg 1989; 5: 13-16.
- Dutton JJ, Byrne SF, Proia AL. Diagnostic Atlas of Orbital diseases.
Philadelphia: W.B. Saunders; 2000.
- Albert DM, Jakobiec FA. Principles and practice of Ophthalmology. 2nd
ed.: Philadelphia: W.B. Saunders; 1994; 2.359-2.370.
- Albert DM. Ophthalmic Surgery. Principles and Techniques. Oxford:
Blackwell Science S C; 1999.
- Aliseda D. Cirugía oncológica de los párpados. Pamplona: EUNSA; 1999.
- Crawford JS. Diseases of the orbit. In: Crawford JS, Morin JD eds. The
eye in childhood. New York: Grune & Straton; 1983.
- McLean IW, Burnier MN, Zimmerman LE, et al. Tumors of the Eye and Ocular
Adnexa. Washington: Armed Forces Institute of Pathology; 1994.
- Kiratli H, Bilgic S, Ozerden U. Management of massive orbital involvement
of intraocular retinoblastoma. Ophthalmology 1998; 105: 322-326.
- Sherman RP, Rootman J, La Pointe JS. Orbital dermoids: clinical
presentation and management. Br J Ophthalmol 1984; 68: 642-652.
- Shields JA, Kaden IH, Eagle RC, et al. Orbital dermoid cysts:
Clinicopathologic correlations, classification, and management. Ophthal Plast
Recons Surg 1997; 13: 265-276.
- BartlleTT, Lin KY, Katowitz J. The surgical management of orbitofacial
dermoids in the pediatric patients. Plast Reconstr Surg 1993; 91: 1.208-1.215.
- Bonavolonta G, Tranfa F, De Conciliis C, et al. Dermoid cysts: 16 years
survey. Ophthal Plast Recons Surg 1995; 11: 187-192.
- Fry CL, Leone CR. Safe management of dermolipomas. Arch Ophthalmol 1994;
112: 114-116.
- Emerick GT, Shields CL, Shields JA, et al. Chewing induced visual
impairment from a dumbbell dermoid cyst. Ophthal Plast Recons Surg 1997; 13:
57-61.
- Archer DB, Gordon DS, Maguire CJF,et al.Ophthalmic aspects of
craniosinostosis. Trans Ophthalmol Soc UK 1974; 94: 172-196.
- Dufier JL, Vinurel MC, Renier D, et al. Les complications
ophthalmologiques des craniofaciostenoses. A propos de 244 obsevations. J Fr
Ophthalmol 1986; 9: 273-280.
- Wong GB, Kakulis EG, Mulliken JB. Analysis of fronto-orbital advancement
for Apert, Crouzon, Pfeiffer and Saethre-Chotzen syndromes. Plast Reconstr Surg
2000; 105: 14-23.
- Pai L, Kohout MP, Mulliken JB. Prospective anthropometric analysis of
sagittal orbital-globe relationship following fronto-orbital advancement in
childhood. Plast Reconstr Surg 1999; 103: 1.341-1.346.
- Oh AK, Kim S, Wang KC, et al. Complications of pediatric craniofacial
surgery in the Orient: analysis of 10 year experience. J Craniofac Surg 1997; 8:
340-351.
- Nidiaye PA, Nidiaye MR, Sakho Y, et al. Kyste sereux congenital de l’orbite
avec anoftalmie. J Fr Ophtalmol 1991; 14: 195-198.
- Duke Elder S. Congenital Deformities of the orbit. In: Duke Elder S, ed.
System of Ophthalmol. London: Kimpton; 1964; III: 949-956.
- Plaza Mayor G, Raboso, García Baquero E, San Miguel Fraile P, et al.
Nasal encephalocele: diferencial diagnosis with nasal glioma. An
Otorrinolaringol Ibero Am 1999; 26: 595-605.
- Helveston EM, Malone E, Lashmet MH, et al. Congenital cystic eye. Arch
Ophthalmol 1970; 84: 622-624.
- Baghdassarian SA,Tabbara KF, Matta CS. Congenital cystic eye. Am J
Ophthlmol 1973; 76: 269-275.
- Fisher YL. Microphthalmos with ocular communicating orbital
cyst-ultrasonic diagnosis. Ophthalmology 1978; 85: 1.208-1.211.
- Golberg SH, Farber MG, Bullock JD, et al. Bilateral congenital ocular
cysts. Ophthalmic Paediatr Genet 1991; 12: 31-38.
- Kodama T, Shybuya Y, Setogawa T, et al. A case of microphthalmos with
cyst and partial trisomy 22. Ophthalmic Genetics 1998; 19: 93-97.
- Warburg M. Classification of microphthalmos and coloboma. J Med Genet
1993; 30: 664-669.
- Havashi N, Repka MX, Ueno H, et al. Congenital cystic eye: report of two
cases and review of the literature. Surv Ophthalmol 1999; 44: 173-179.
- Green WR, Zimmermam LE. Ectopic lacrimal gland tissue; report of 8 cases
with orbital involvement. Arch Ophthalmol 1967; 78: 318-327.
- Jacobs L, Sirkin S, Kinkel W. Ectopic lacrimal gland in the orbit
identified by computerized axial transverse tomography. Ann Ophthalmol 1977; 9:
591-593.
- Jakobiec FA, Bonnanno PA, Sigelman J. Congenital adnexal cyst and
dermoid. Arch Ophthalmol 1978; 96: 1.404-1.409.
- Ho VT, Rao VM, Flanders AE. Postsurgical conjunctival epithelial cysts.
Am J Neuroradiol 1994; 15: 1.181-1.183.
- Martinez LM, Cohen KL. Conjunctival dermoid cyst seen on examination as a
chronically red eye. Arch Ophthalmol 1998; 116: 1.109-1.111.
- Goldstein MH et al. Conjunctival cysts of the orbit. Ophthalmology 1998;
105: 2.056-2.060.
- Morales GA, Croxatto JO, Crovetto L, et al. Hydatid cysts of the orbit. A
review of 35 cases. Ophthalmology 1988; 95: 1.027-1.033.
- Toledo EC, Szelagowskiy JC. Unilateral exoftalmos in orbital
echinococciasis. J Comput Assist Tomogr 1980; 4: 127.
- Aouchiche M, Benrabah R, Abanou A, et al. Computed X ray tomographic
aspects of intraorbital hydatid cyst. A propos of 10 cases. J Fr Ophthalmol
1983; 6: 901-916.
- Levin M, Leone CR, Kinkaid MC.Congenital orbital teratoma. Am J
Ophthalmol 1986; 102: 476-481.
- Bilgic S, Dayanir V, Kiratli H, et al. Congenital orbital teratoma: A
clinicopathologic report. Opthal Plast Reconstr Surg 1997; 13: 142-146.
- Abdelmoula M, Gdoura A, Feki J. Primary teratoma of the orbit. A propos
of a case. Rev Stomatol Chir Maxillofac 1997; 98: 7-11.
- Guyuron B, Schlechhter B. Pseudomeningocele as a complication of teratoma
resection and aseptic meningitis following craniofacial reconstruction: a case
report. J Craniofac Surg 1990; 1: 179-181.
- Neiger R, Sacks LM. Massive orbital and intracranial teratoma in the
newborn: a case report. J Med Assoc Ga 1989; 78: 811-813.
- Weiss AH, Greenwald MJ, Margo CE, Myers W. Primary and secondary orbital
teratomas. J Pediatr Ophthalmol Strabismus 1989; 26: 44-49.
- Soares E, Lopes K, Adrake J, et al. Orbital malignant teratoma. A case
report. Orbit 1983; 2: 235-240.
- Sreenan C, Johnson R, Russell L, et al. Congenital orbital teratoma. Am J
Perinatol 1999; 16: 251-255.
- Deady JP, Willshaw HE. Vascular hamartomas in childhood.Trans Ophthalmol
Soc UK 1986; 105: 712-716.
- Harris G. Orbital vascular malformations: a consensus statement on
terminology and its clinical implications. Am J Ophthalmol 1999; 127: 453-455.
- Bilaniuk LT. Orbital vascular lesions. Radiol Clin North Am 1999; 37 (1):
169-183.
- Aldave AJ, Shields CL, Shields JA. Surgical excision of selected
amblyogenic periorbital capillary hemangiomas. Ophthalmic Surg Lasers 1999; 30:
754-757.
- Burstein FD, Simms C, Cohen SR, et al. Intralesional laser therapy of
extensive hemangiomas in 100 consecutive pediatric patients. Ann Plast Surg
2000; 44: 188-194.
- Hastings MM, Milot J, Barsoum-Homsy M, et al. Recombinant interferon
alfa-2b in the treatment of vision –threatening capillary hemangiomas in
infants JAAPOS 1997; 1(4): 226-230.
- Neuman D, Isenberg SJ, Rosembaum AL, et al. Ultrasonographically guided
injection of corticosteroids for the treatment of retroseptal capillary
hemangiomas in infants. JAAPOS 1997; 1: 34-70.
- Foroozan R, Shields CL, Shields JA, Eagle RC, Silber DI. Congenital
orbital varices causing extreme nenonatal proptosis. Am J Ophthalmol 2000; May
129(5): 693-694.
- Battistella PA, Pisan P, Carollo C. Neoplasie endoorbitarie in etá
evolutiva. Minerva Pediatr 1998; 50: 519-528.
- D’Hermies F, Elmalch C, Mourier K, et al. Hemangiome caverneux de l’orbite.
J Fr Ophtalmol 1993; 16: 195-198.
- Taylor W, Moseley I. Visual loss in retrobulbar cavernous haemangiomas
investigated by computed tomography. Neuroradiology 1994; 36: 166-168.
- Kapoor S, Kapoor MS, Aurora AL, et al. Orbital hemangiopericytoma: A
report of a three year old child. J Pediatr Ophthalmol Strabismus 1977; 15:
40-42.
- Croxotto JO, Font RL. Hemangiopericytoma of the orbit. A
clinicopathologic study of 30 cases. Hum Pathol 1982; 13: 210-218.
- Karcioglu ZA, Nasr AR, Haik BG, et al. Orbital
hemangiopericitoma:clinical and morphological features. Am J Ophthalmol 1997;
124: 661-672.
- Shields JA, Shields CL, Rashid RC. Clinicopathologic correlation of
choroidal folds: Secundary to massive cranioorbital hemangiopericitoma. Ophthal
Plast Reconstr Surg 1992; 8: 62-68.
- Sullivan N, Wright JE, Wulc AE, et al. Hemangiopericytoma of the orbit.
Aust N Z Ophthalmol 1992; 20: 325-332.
- Wyburn-Mason R. Arterial-venous aneurysm of midbrain and retina, facial
naevi and mental changes. Brain 1943; 66: 165-203.
- Iliff WJ, Green WR. Orbital limphangiomas. Ophthalmology 1979; 89:
914-929.
- Katz SE, Rootman J, Vangveeravongs S, Graeb D.Combined venous lymphatic
malformations of the orbit (so-called lymphangiomas). Association with
noncontiguos intracranial vascular anomalies.Ophthalmology 1998; 105: 176-184.
- Rootman J, Hay E, Graeb D, et al. Orbital-adnexal lymphangiomas. A
spectrum of hemodinamically isolated vascular hamartomas. Ophthalmology 1986;
93: 1.558-1.570.
- Wright JE, Sullivan TJ, Garner A, et al. Orbital venous
anomalies.Ophthalmology 1997; 104: 905-913.
- Cotton JB, Ligeon-Ligeonnet P, Ranchin B. Exophtalmie de l’enfant par
neoformation vasculaire orbitaire. Arch Pediatr 1994; 1: 1.111-1.114.
- Rodríguez Arias C, Martínez Rey R, Rey G , Bravo G. Recurrence in a
different location of a cerebral arteriovenous malformation in a child after
radiosurgery. Childs Nerv Syst 2000; 16: 363-365.
- Kurita H, Kawamoto S, Sasaki T, et al. Results of radiosurgery for brain
stem arteriovenous malformations. J Neurol Neurosurg Psych 2000; 68: 563-570.
- Vymazal J, Liscak R, Novotny J, et al.The role of Gamma Knife
radiosurgery in arteriovenous malformation with aneurysms. Stereotact Funct
Neurosurg 1999; 72: 175-184.
- Kim MS, Lee SI, SIm JH. A case of very large cyst formation with Gamma
Knife radiosurgery for an arteriovenous malformation. Stereotact Funct Neurosurg
1999; 72: 168-174.
- Schlienger M, Atlan D, Lefkopoulos D, et al. LINAC Radiosurgery for
cerebral arteriovenous malformations: results in 169 patients. Int J Radiat Oncl
Biol Phys 2000; 46: 1.135-1.142.
- Miyawaki L, Dowd C, Wara W, et al. Five years of LINAC radiosurgery for
arteriovenous malformations:outcome for large AVMS. Int J Radiat Oncl Biol Phys
1999; 44: 1.089-1.096.
- Kremer I, Nissenkorn I, Feuerman P, et al. Congenital orbital vascular
malformation complicated by massive retrobulbar haemorrhage. J Pediatr
Ophthalmol Strabismus 1987; 24: 190-193.
- Garrity JA. Orbital venous anomalies. A long–standing dilemma.
Ophthalmology 1997; 104: 903-904.
- Weill A, Cognard C, Castaings L, et al. Embolization of an orbital varix
after surgical exposure. Am J Neuroradiol 1998; 19: 921-923.
- Nasr AM, Huaman AM. Anterior orbital varix presenting as a lacrimal sac
mucocele. Ophthal Plas Reconstr Surg 1998; 14: 193-197.
- Kersten RC, Kersten JL, Bloomh R, et al. Chronic hematic cysts of the
orbit. Ophthalmology 1988; 95: 1.549-1.553.
- Goldberg SH, Sassani JW, Parnes RE. Traumatic intraconal hematic cyst of
the orbit. Arch Ophthalmol 1992; 110: 378-380.
- Johnson TE, Bergin DJ, Mc Cord CD. Aneurysmal bone cyst of the orbit.
Ophthalmology 1988; 95: 86-90.
- Harris GJ. Subperiosteal abscess of the orbit: computed tomography and
clinical course. Ophthal Plast Reconstr Surg 1996; 12: 1-8.
- Harris GJ. Subperiostel abscess of the orbit: age as a factor in the
bacterology and response to treatment. Ophthalmology 1994; 101: 585-595.
- Greenberg MF, Pollard ZF. Medical treatment of pediatric subperiosteal
orbital abscess secondary to sinusitis. JAAPOS 1998; 2: 351-355.
- Sankrithi UM, Li Puma JJ. Clinical inapparent meningitis complicating
periorbital cellulitis. Pediatr Emerg Care 1991; 7: 28-29.
- Ciriallo L, Rowe CP. Lumbar puncture in children with periorbital and
orbital cellulitis. J Pediatr 1993; 122: 355-359.
- Ferguson MP, McNab AA. Current treatment and outcome in orbital
cellulitis. Aust N Z J Ophthalmol 1999; 27: 375-379.
- Gómez CJ, Aránguez MG. Celulitis orbitaria en la infancia.Tratamiento
médico-quirúrgico. Acta Otorrinolaringol 2000; 51: 113-119.
- Barkin RM, Todd JK, Amer J. Periorbital cellulitis in children.
Pediatrics 1978; 62: 390-392
- Garcia GH, Harris GJ. Criteria for nonsurgical management of
subperiosteal abscess of the orbit (2): analysis of outcomes 1988-1988.
Ophthalmology 2000; 107(8): 1.454-1.456.
- Donahue SP, Schwartz G. Preseptal and orbital cellulitis in chilhood. A
changing microbiologic spectrum. Ophthalmology 1998; 105: 1903-1905. Discussion:
1.905-1.906.
- Mannor GE, Rose GE, Moseley IF, et al. Outcome of orbital myositis.
Clinical features associated with recurrence. Ophthalmology 1997; 104: 409-414.
- Mombaerts I, Koornneef L. Current status in the treatment of orbital
myositis. Ophthalmology 1997; 104: 402-408.
- Pollard ZF. Acute rectus muscle palsy in children as a result of orbital
myositis. J Pediatr 1996; 128: 230-233.
- Stidham DB, Sondhi N, Plager D, et al. Presumed isolated inflammation of
the superior oblique muscle in idiopathic orbital myositis. Ophthalmology 1998;
105: 2.216-2.219.
- Mombaerts I, Goldschmeding R, Schlingemann RO, et al. What is orbital
pseudotumor? Surv Ophthlmol 1996; 41: 66-78.
- Mottow-Lippa L, Jakobiec FA, Smith M. Idiopathic inflammatory orbital
pseudotumor in childhood. II. Results of diagnostic tests and biopsies.
Ophthalmology 1981; 88: 565-574.
- Rootman J. Why orbital pseudotumor is no longer a useful concept. Br J
Ophthalmol 1998; 82: 331-332.
- Singer J, Suchet I, Horowitz T. Paediatric Wegener´s granulomatosis:
Two case histories and rewiew of the literature. Clin Radiol 1990; 42: 50-51.
- Perry SR, Rootman J, White VA. The clinical and pathologic constellation
of Wegener's granulomatosis. Ophthalmology 1997; 104: 683-694.
- O'Sullivan RM, Nugent RA, Satorre J, Rootman J. Granulomatous orbital
lesions: computed tomographic features. Can Assoc Radiol J 1992; 43: 349-358.
- Kwan AS, Rose GE. Orbital Wegener's granuloma resulting from direct
extension of nasal disease through a surgical rhinostomy. Br J Ophthalmol 1998;
82: 198.
- Parelholf ES, Chavis RM, Friendly DS. Wegener's granulomatosis
presenting as orbital pseudotumor. J Pediatr Ophthalmol Strabismus 1985; 22:
100-104.
- Satorre J, Antle M, O'Sullivan R, et al. Orbital lesions with
granulomatous inflammation. Canad J Ophthalmol 1991; 26: 174-195.
- Kalina PH, Lie JT, Campbell RJ, et al. Diagnostic value and limitations
of orbital biopsy in Wegener's granulomatosis. Ophthalmology 1992; 99: 120-124.
- Hatsukawa Y, Furukawa A, Kawamura H, et al. Rhabdomyoma of the orbit in
a child. Am J Ophthalmol 1997; 87: 142-143.
- Notis CM, Abramson DH, Sagerman RH, et al. Orbital rhabdomyosarcoma:
Treatment or overtreatment. Ophthalmic Genet 1995; 16: 159-162.
- Wharam M, Beltangady M, Hays D, Heyn R, Ragab A, Soule E, Tefft M,
Maurer H. Localized orbital rhabdomyosarcoma. An interim report of the
Intergroup Rhabdomyosarcoma Study Committee. Ophthalmology 1987; 94: 251-254.
- Rousseau P. Primary Chemotherapy in Rhabdomyosarcomas and Other
Malignant Mesenchymal Tumors of the Orbit: Results of the International Society
of Pediatric Oncology MMT 84 Study; for the International Society of Pediatric
Oncology Malignant Mesenchymal Tumor Committee (Montreal Gen Hosp). J Clin Oncol
1994; 12: 516-521.
- Stevens MC, Oberlin O, Rey A. Non metastasic Rhabdomyosarcoma;
experience from the SIOP MMT 89 Study. For the SIOP MMT Committee. Med Ped Oncol
1994; 23: 171 (Abstract).
- Mannor GE,Rose GE, Plowman PN et al. Multidisciplinary management of
refractory orbital rhabdomyosarcoma. Ophthalmology 1997; 104: 1.198-1.201.
- Mamalis N, Grey AM, Good JS, et al. Embryonal rhabdomyosarcoma of the
orbit in a 35 year old man. Ophthalmic Surg 1994; 25: 332-335.
- Walton RC, Ellis GS, Haik BG, et al. Rhabdomyosarcoma presumed
metastasic to the orbit. Ophthalmology 1996; 103: 1.512-1.516.
- Sohaib SA, Moseley I, Wright JE. Orbital rhabdomyosarcoma.The radiologic
characteristics. Clin Radiol 1998; 53: 357-362.
- Mahmood FM, Pai E, Philip B. Rhabdomyosarcoma of the orbit. Evaluation
with MR imagin and CT. Radiol Clin North Am 1998; 36(6): 1.215-1.227.
- Knowles DM, Jakobiec FA, De Potter GD, Jones IS. Ophthalmic striated
muscle neoplasms. Surv Ophthalmol 1976; 21: 219-261.
- Fiorillo A, Migliorati R, Vassallo P, Canale G, Tranfa F, Fariello I, De
Chiara C, D'Amore R, Muto P, Bonavolonta G. Radiation late effects in children
treated for orbital rhabdomyosarcoma. Radiother Oncol 1999; 53: 143-148.
- Abramsom DH, Fass D, McCormik B, et al. Implant brachyterapy: A novel
treatment for recurrent orbital rhabdomyosarcoma. JAAPOS 1997; 1: 154-157.
- Font RL, Hidayat AA. Fibrous histiocytoma of the orbit: A
clinicopathologic study of 150 cases. Hum Pathol 1982; 13: 199.-209.
- Larkin DF, O'Donaghue HN, Mullaney J, et al. Orbital fibrous
histiocytoma in an infant. Acta Ophthalmol 1988; 66: 585-588.
- Dalley RW. Fibrous histiocytoma and fibrous tissue tumors of the orbit.
Radiol Clin North Am 1999; 37(1): 185-194.
- Al-Hazzaa SA, Specht CS, McLean IW, et al. Benign orbital fibrous
histiocytoma simulating a lacrimal gland tumor. Ophtalmic Surg Lasers 1996; 27:
140-142.
- Ros PR, Kursunoglu S, Batle JF, et al. Malignant fibrous histiocytoma of
the orbit. J Clin Neuroophthalmol 1985; 5: 116-119.
- Choi G, Lee U, Won NH. Fibrous histiocytoma of the lacrimal sac. Head
and Neck 1997; 19: 72-75.
- Jacomb HJ, Moseley IF. Orbital fibrous histiocytoma: CT in 10 cases and
rewiew of radiological findings. Clin Radiol 1991; 43: 117-120.
- Sciot R, Goffin J, Fossion E, et al. Solitary fibrous tumour of the
orbit. Histopathology 1996; 28: 188-191.
- Westra WH, Gerald WL, Rosa IJ. Solitary fibrous tumour. Consistent CD34
immunoreactivity and ocurrence in the orbit. Am J Surg Pathl 1994; 18: 992-998.
- Fukunaga M, Ushigome S, Nomura K, Ishikawa E. Solitary fibrous tumor of
the nasal cavity and orbit. Pathol Int 1995; 45: 952-957.
- Lang P, Suh KJ, Gramp S, et al. CT and MRI in elastofibroma. A rare,
benign soft tissue tumor. Radiology 1995; 35: 611-661.
- Campbell RJ, Garrity JA. Juvenile fibromatosis of the orbit: A case
report with review of the literature. Br J Ophthalmol 1991; 75: 313-316.
- Ramdial PK, Nadvi S. An anusual cause of proptosis. Orbital solitary
fibrous tumor: case report. Neurosurgery 1996; 38: 1.040-1.043.
- Kaw IT, Cuesta RA. Nodular fasciitis of the orbit diagnosed by fine
needle aspiration ciytology. A case report. Acta Cytol 1993; 37: 957-960.
- Sakamoto T, Ishibashi T, Ohnishi Y, Inomata H. Immunohistological and
electron microscopical study of nodular fasciitis of the orbit. Br J O phthalmol
1991; 75; 636-638.
- Katz BJ, Nerald JA. Ophtalmic manifestations of fibrous dysplasia: a
disease of children and adults. Ophthalmology 1998; 105: 2.207-2.215.
- Moore AT, Buncie JR, Munro I. Fibrous dysplasia of the orbit in
childhood. Ophthalmology 1985; 92: 12-20.
- Huvos AG, Higginbotham NL, Miller TR. Bone sarcomas arising in fibrous
displasia. J Bone Joint Surg 1972; 54: 1.047-1.056.
- McCluskey P, Wingate R, Benger R, McCarthy S. Monostotic fibrous
dysplasia of the orbit: An unusual lacrimal fosa mass. Br J Ophthalmol 1979; 63:
611-616.
- Papay FA, Morales L, Flaharty P, et al. Optic nerve decompression in
craneal base fibrous dysplasia. J Craniofac Surg 1995; 6: 5-14.
- Seiff SR. Optic nerve decompression in fibrous dysplasia: Indications,
efficacy, and safety. Plast Reconstr Surg 1997; 100: 1.611-1.612.
- Shields JA, Peyster RG, Hanndler SD, et al. Masive juvenile ossifying
fibroma of maxilary sinus with orbital involvement. Br J Ophthalmol 1985; 69:
392-395.
- Margo CE, Ragsdale BD, Perman K, et al. Psammomatoid ossifying fibroma
of the orbit. Ophthalmology 1985; 92; 150-159.
- Margo CE, Weis A, Habal MB. Psammomatoid ossifying fibroma. Arch
Ophthalmol 1986; 104: 1.347-1.348.
- Fajadej A, Boynton JR. Juvenile ossifying fibroma of the orbit. Ophthal
Plast Reconstr Surg 1996; 12: 174-177.
- Haertstein ME, Grove AS, Woong JJ, et al. The multidisciplinary
management of psammomatoid ossifying fibroma of the orbit. Ophthalmology 1998;
105: 591-595.
- Whitson WE, Orcutt JC, Walkinshaw MD. Orbital osteoma in Gardner's
syndrome. Am J Ophthalmol 1986; 101: 236-241.
- Alper M, Gurler T, Bilkay U, et al. Intraorbital osteoma and surgical
strategy. J Craniofac Surg 1998; 9: 464-467.
- Van Gehuchten DV, Lemagne JM, Weber S, et al. A case of exoftalmos as an
early symptom of Gardner's syndrome. Orbit 1982; 1: 61-69.
- Ronner HJ, Jones IS. Aneurysmal bone cysts of the orbit: a review. Ann
Ophthalmol 1983; 15: 626-629.
- Bealer LA, Cibis GW, Barker BF, et al. Aneurysmal bone cysts: report of
a case mimicking orbital tumor. J Pediatr Ophthalmol Strabismus 1993; 30:
199-200.
- Yee RD, Cogan DG, Thorp R, et al. Optic nerve compression due to
aneurysmal bone cyst. Arch Ophthalmol 1997; 95: 2.176-2.179.
- Johnson TE, Bergin DJ, McCord CD. Aneurysmal bone cysts of the orbit.
Ophthalmology 1988; 95: 86-90.
- Hino N, Ohtsuka K, Hashimmoto M, et al. Radiographic features of
aneurysmal bone cyst of the orbit. Ophthalmologica 1998; 212: 198-201.
- Iraci G, Giordano R, Fiore D, et al. Exophthalmos from aneurysmal bone
cyst of the orbital roof. Childs Brain 1980; 6: 206-217.
- Hunter JV, Yokoyama C, Moseley IF, Wright JE. Aneurysmal bone cyst of
the sphenoid with orbital involvement. Br J Ophthalmol 1990; 74: 505-508.
- Lee MJ, Cairns RA, Munk PL, Poon PY. Congenital infantile fibrosarcoma:
Magnetic resonance imaging findings. Can Assoc Radiol J 1996; 47: 121-124.
- Lam DS, Li CK, Cheng LL, et al. Primary orbital Ewing's sarcoma: report
of a case and review literature. Eye 1999; 13: 38-42.
- Chynn EW, Rubin PA. Metastatic Ewing cell sarcoma of the sinus and
osteoid osteoma of the orbit. Am J Ophthalmol 1997; 123: 565-569.
- Ersahin Y, Yunten N. Bilateral optic nerve glioma. Pediatric
neurosurgery 1999; 31: 168-169.
- Jenkin D, AngyalfI S, Becker L, et al. Optic glioma in children:
surveillance, resection, or irradiation? Int J Radiation Oncology Biol 1993; 25:
215-225.
- Massry GG, Morgan CF, Chung SM. Evidence of optic pathway gliomas after
previously negative neuroimaging. Ophthalmology 1997; 104: 930-935.
- Nomura S, Suzuky R, Sugiyama S, et al. Optic glioma with characteristic
bilateral optic atrophy in a 3-year-old girl. Pediatr Neurosurg 1999; 31:
213-218.
- Dutton JJ, Byrne SF, Proia AL. Diagnostic Atlas of Orbital diseases.
Philadelphia: W.B. Saunders; 2000; 5: 120-121.
- Farris SR, Grove AS. Orbital and eyelid manifestations of
neurofibromatosis: a clinical stydy and literature review. Ophthal Plast
Reconstr Surg 1996; 12: 245-259.
- Khairallah M, Messaoud R, Ladjimi A, et al. Association of
spheno-orbital dysplasia with plexiform neuroma in von Recklinghausen's
neurofibromatosis. J Fr Ophtalmolol 1999; 22: 975-978.
- Tada M, Sawamura Y, Ishii N, et al. Massive plexiform neurofibroma in
the orbit in a child with von Recklinghausen's disease. Childs Nerv Syst 1998;
14: 210-212.
- Mamalis N, Apple DJ, Williams RD, Crandall AS, Mantley R. Surgical
removal of an inoperable neurofibroma. Ophthalmic Surg 1998; 19(1): 37-41.
- Chung CJ, Armfield KB, Mukerji SK, et al. Cervical neurofibromas in
children with NF-1. Pediatr Radiol 1999; 29: 353-356.
- Pascual Castroviejo I, Martínez Bermejo A, López Martín V, Roche C,
Pascual Pascual SI. Optic gliomas in neurofibromatosis type 1 (NF-1).
Presentation of 31 cases. Neurologia 1994 May; 9(5): 173-177.
- Terstegge K, Schorner W, Henkes, et al. Hyperostosis in meningiomas: MR
findings in patients with recurrent meningioma of the sphenoid wings. Am J
Neuroradiol 1994; 15: 555-560.
- Dutton JJ. Optic nerve sheath meningioma. Surv Ophthalmol 1992; 37:
167-183.
- Margo CE, Mulla ZD. Malignant tumors of the orbit. Analysis of the
Florida Cancer Registry. Ophthalmology 1998; 105(1): 1.998-2.006.
- Sheikh BY, Siqueira E, Dayel F, Di Rocco C. Meningioma in children; a
report of nine cases and review of the literature. Surg Neurol 1996; 45:
328-335.
- Ortiz O, Schochet SS, Kotzan JM, et al. Radiologic-pathologic
correlation. Meningioma of the optic nerve sheath. Am J Neuroradiol 1996; 17:
901-906.
- Wright JE, Mc Nab AA, Mc Donald WI. Primary optic sheath meningioma. Br
J Ophthalmol 1989; 73: 960-966.
- Peele KA, Kennerrdell JS, Maroon JC, et al. Role of postoperative
irradiation in the management of the sphenoid wing meningiomas. A preliminary
report. Ophthalmologe 1996; 103: 1.766-1.767.
- Lee AG, Woo SY, Miller NR, et al. Improvement in visual function in a
eye with a presumed optic nerve sheat meningioma after treatment with three
dimensional conformal radiation theraphy. J Neuro Ophthalmol 1996; 16: 247-251.
- Cristine L. Surgical treatment of meningiomas of the optic canal: A
retrospective study with particular attention to the visual outcome. Acta
Neurochir (Wien) 1994; 126: 27-32.
- Lieb WE, Rochels R, Wallenfang T, et al. Opthalmologic symptoms in
meningioma of the orbit and in the anterior and medial cranial fossa.
Oftalmologe 1994; 91: 341-345.
- Lindblom B, Truwit CL, Hoyt WF. Optic nerve sheat meningioma. Definition
of intraorbital, intracanalicular, and intracranial components with magnetic
resonance imaging. Ophthalmology 1992; 99: 560-566.
- Bergin DJ, Johnson TE, Spencer WH, et al. Ganglioglioma of the optic
nerve. Am J Ophthalmol 1988; 105: 146-150.
- Shields JA, Eagle RC Jr, Shields CL, De Potter P. Congenital neoplasm of
the nonpigmented ciliary epithelium (medulloepithelioma). Ophthalmology 1996;
103: 1.998-2.006.
- Abelairas JM, Perera A, Regules E , Gutiérrez M, Fernández Guardiola
JM, Morales C, Romo A, Chacon A, Villarejo JM, Pérez Higueras A, Alfonso JM,
Prieto C, Pascual Castroviejo I. Meduloepitelioma (dictyoma) del nervio óptico.
Arch Soc Esp Oftal 1990; 58: 385-392.
- Zimmerman LE, Font RL, Anderson SR. Rhabdomyosarcomatous differentiation
in malignant intraocular medulloepitheliomas. Cancer 1972; 30(3): 817-835.
- Carrol GS, et al. Peripheral nerve tumors of the orbit. Radiol Clin
North Am 1999; 37(1): 195-202.
- Ratsumata Y, Maehara T. Neurinoma of the oculomotor nerve: CT and MR
features. J Comput Asst Tomogr 1990; 14: 658-661.
- Shen WC, Yang DY, Ho WL, et al. Neurilemmoma of the oculomotor nerve
presenting as an orbital mass. Am J Neuroradiol 1993; 14: 1.253-1.254.
- Delfini R, Missori P, Tarantino R, et al. Primary bening tumors of the
orbital cavity: comparative data in a series of patients with optic nerve
glioma, sheath meningioma or neurinoma. Surg Neurol 1996; 45: 185-190.
- Gunalp I, Gunduz K, Duruk K, Kanpolat Y. Neurogenic tumors of the orbit.
Jpn J Ophthalmol 1994; 38: 185-190.
- Fezza JP, Woffley DE, Flynn SD. Malignant peripheral nerve sheat tumor
of the orbit in a new born: A case report and review of the literature. J
Pediatr Ophthalmol Strabismus 1997; 34: 118-131.
- Bharghava R, Parham DM, Lasater OE, et al. MR imaging differentiation of
benign and malignant peripheral nerve sheath tumors: Use of a target sign.
Pediatr Radiol 1997; 27: 124-129.
- Erzurum SA, Melen O, Lissner G, et al. Treatment with surgical resection
and radiation theraphy. J Clin Neuro Ophthalmol 1993; 13: 1-7.
- Mortada A. Solitary orbital malignant neurilemmoma. Br J Ophthalmol
1968; 52: 188-190.
- Pettinato G, Manivel JC, D'Amore ES, Jaszcz W, Gorlin RJ. Melanotic
neuroectodermal tumor of infancy. A re-examination of a histogenetic problem
based on inmunohistochemical, flow citometry, and ultrastructural study of 10
cases. Am J Surgical Pa thology 1991; 15: 223-245.
- Kapadia SB, Frisman DM, Hitchcock CL, Popek EJ. Melanotic
neuroectodermical tumor of infancy. Clinicopathological, inmunohistochemical,
and flow cytometric study. Am J Surg Pathol 1993; 17: 566-573.
- Galera-Ruiz H, Gómez-Ángel D, Vázquez-Ramírez FJ, Sanguino-Fabre JC,
Salazar Fernández E, González-Hachero J. Fine needle aspiration in the
preoperative diagnosis of melanotic neuroectodermal tumor of infancy. Journal of
Laringology and Otology 1999; 113: 581-584.
- Kiratli H, Bilçic S, Gedikoglu G, et al. Primitive neuroectodermic
tumor of the orbit in an adult. Ophthalmology 1999; 106: 98-102.
- Arora R, Sarkar C, Betharia SM. Primary orbital primitive
neuroectodermal tumour with immunohistochemical and electron microscopic
confirmation. Orbit 1993; 12: 217-221.
- Sing AD, Husson M, Shields CL, et al. Primitive neuroectodermal tumor of
the orbit. Arch Ophthalmol 1994; 112: 217-221.
- Cuadra-Garcia I, Proulx GM, Wu CL, et al. Sinunasal linfoma: a
clinicopathologic analysis of 58 cases from MGH. Am J Surg Pathol 1999; 23:
1.356-1.369.
- Letschert JG, Gonzalez D, Oska J, et al.Results of radiotherapy in
patients with stage I orbital non-Hodkin's linfoma. Radiother Oncol 1991; 22:
36-44.
- Reddy EK, Bhatia P, Evans R. Primary orbital lymphomas. Int J Radiation
Oncology Biol Phys 1988; 15: 1.239-1.241.
- Sharma MC, Mahapatra AK, Gaikwad S, Biswal A. Primary extramedullary
orbital plasmacitoma in a child. Childs Nerv Syst 1996; 12: 470-472.
- Rappaport K, Liesegang TJ, Menke DH, et al. Plasmacytoma manifesting as
recurrent cellulitis and hematic cyst of the orbit. Am J Ophthalmol 1996; 122:
595-597.
- Adkins JW, Shields JA, Shields CL, et al. Plasmocytoma of the eye and
orbit. Int Ophthalmol 1997; 20: 339-343.
- Ezara E, Mannor G, Wright JE, Rose GE. Inadequately irradiated solitary
extramedullary plasmacytoma of the orbit requiring exenteration. Am J Ophthalmol
1995; 120: 803-805.
- Uyesugy WY, Batave J, Peterman G. Orbital and facial granulocytic
sarcoma (chloroma): a case report. Pediatr Radiol 2000; 67: 276-278.
- Stockl FA, Dolmetsch AM, Saornil MA, et al. Orbital granulocytic
sarcoma. Br J Ophthalmol 1997; 81: 1.084-1.988.
- Jakobiec FA. Granulocytic sarcoma. Am J Neuroradiolol 1991; 12: 263-264.
- Cavdar AO, Arcasoy A, Babacan E, et al. Ocular granulocitic
sarcoma(chloroma) with acute mielomyelocytic leukemia in turkish children.
Cancer 1978; 41: 1.606-1.609.
- Aboud N, Sullivan T, Whitehead K. Primary extramedullary plasmacytoma of
the orbit. Aust NZ J Ophthalmol 1997; 20: 339-343.
- Puri P, Grover AK. Granulocytic sarcoma of orbit preceding acute myeloid
leukaemia; a case report. Eur J Cancer Care 1999; 8: 113-115.
- Humayun M, Bernstein S, Gould H, Charis R. Orbital childhood acute
lymphoblastic leucemia as the initial presentation. J Pediatr Ophthalmol
Strabismus 1992; 29: 252-254.
- Davis JL, Parke DW, Font RL. Granulocytic sarcoma of the orbit. A
clinicopathologic study. Opthalmology 1985; 92: 1.758-1.762.
- Bulas RB, Laine FJ, Da Narla L. Bilateral orbital granulocytic sarcoma
(chloroma) preceding the blast phase of acute myelogenous leukemia: CT findings.
Pediatr Radiol 1995; 25: 488-489.
- Pui MH, Fletcher BD, Langston JW. Granulocytic sarcoma in childhood
leukemia: Imaging features. Radiology 1994; 190: 698-702.
- Watkins LM, Remulla HD, Rubin PA. Orbital granulocytic sarcoma in an
elderly patient. Am J Ophthalmolol 1997; 123: 854-856.
- Schwyzer R, Sherman GG, Cohn RJ, Poole JE, et al. Granulocytic sarcoma
in children with acute lymphoblastic leucemia and t(8;21). Med Pediatr Oncol
1998; 31: 144-149.
- Moore AT, Pritchard J, Taylor D. Histiocytosis X: An ophtalmological
review. Br J Ophthalmol 1985; 69: 7-14.
- Glover AT, Grove AS. Eosinophilic granuloma of the orbit with spontaneus
healing. Ophthalmology 1987; 94: 1.008-1.012.
- Writing Group of the Histiocyte Society: Histiocytosis syndromes in
children. Lancet 1987; 24: 208-209.
- Poe LB, Dubowy RL, Hockhauser L, et al. Demyelinating and gliotic
cerebellar lesions in Langerhans cells histiocytosis. Am J Neuroradiol 1994; 15:
1.921-1.928.
- Sanders TE, Miller JE. Infantile xanthogranuloma of the orbit: Report of
a case. Trans Am Acad Otolaryngol Ophthalmol 1965; 69: 458-464.
- Sanders TE. Intraocular juvenile xanthogranuloma
(Nevoxanthoendotelioma): A survey of 20 cases. Trans Am Ophthalmol Soc 1960; 58:
59-64.
- Sanders TE. Infantile xanthogranuloma of the orbit. Report of three
cases. Am J Ophthalmol 1966; 61: 1.299-1.306.
- Hidayat AA, Mafee MF, Laver NV, Noujaim S. Langerhans' cell
Histiocytosis and Juvenile Xanthogranuloma of the Orbit. Clinicopathologic, CT,
and MR Imaging Features. Radiologic Clinics of North America. 1998; 36(6):
1.229-1.240.
- Hamburg A. Juvenile xanthogranuloma of the uvea in an adult.
Ophthalmologica 1976; 172: 273-281.
- Wright JE. Symposium on orbital tumors: methods of examination.Trans
Ophthalmol Soc UK 1979; 99: 216-219.
- Rose GE, Wright JE. Pleomorphic adenoma of the lacrimal gland. Br J
Ophthalmol 1992; 76: 395-400.
- Font RF, Smith SL, Bryan RG. Malignant epithelial tumors of the lacrimal
gland. Arch Ophthalmol 1998; 116: 613-616.
- Tellado MV, Mclean IW, Specht CS, et al. Adenoid cystic carcinoma of the
lacrimal gland in childhood and adolescence. Ophthalmology 1997; 104:
1.622-1.625.
- Wright JE, Rose GE, Garner A. Primary malignant neoplasms of the
lacrimal gland. Br J Ophthalmol 1992; 76: 401-407.
- Johnson LN, KroheL GB, Yeon EB, et al. Sinus tumors invading the orbit.
Ophthalmology 1984; 91: 209-217.
- Abramsom DH, Niksarly K, Ellsworth RM, et al. Changing trends in the
management of retinoblastoma: 1951-1965 vs 1966-1980. J Pediatr Ophthalmol
Strabismus 1994; 31: 32-37.
- Rootman J, Hofbauer J, Ellsworth RM,et al. Invasion of optic nerve by
retinoblastoma: A clinicopathologic study. Can J Ophthalmol 1976; 11: 106-114.
- Rootman J, Ellsworth RM, Hofbauer J, et al. Orbital extension of
retinoblastoma: A clinicopathologic study. Can J Ophthalmol 1978; 13: 72-80.
- Abramsom DH, Frank CM. Second nonocular tumors in survivors of bilateral
retinoblastoma: A possible age effect on radiation related risk. Ophthalmology
1998; 105: 573-579.
- Shields JA, Pesin SR, Shields CL.Trilateral retinoblastoma. J Clin Neur
Ophthalmol 1989; 9: 222-223.
- Amoaku WM, Willshaw HE, Parkes SE, et al. Trilateral retinoblastoma. A
report of five cases. Cancer 1996; 78: 858-863.
- Kaste SC, Chen G, Fontanesi J, et al. Orbital development in long term
survivors of retinoblastoma. J Clin Oncol 1997; 15: 1.183-1.189.
- Bagley LJ, Hurst RW, Zimmerman RA, et al. Imaging in the trilateral
retinoblastoma syndrome. Neuroradiology 1996; 38: 166-170.
- Ainbinder DJ, Haik BG, Frei DF. Gadolinium enhancement: Improved MRI
detection of retinoblastoma extension into the optic nerve. Neuroradiology 1996;
38: 778-781.
- Notis CM, Niksarli K, Abramson DH, et al. Parents with unilateral
retinoblastoma: Their affected children. Br J Ophthalmol 1996; 80: 197-199.
- Shields JA, Shields CL, Sivalingam V. Decreasing frecuency of
enucleation in patients with retinoblastoma. Am J Ophthalmol 1989; 108: 185-188.
- Kiratli H, Bilgic S, Ozerden U. Management of masive orbital involvement
of intraocular retinoblastoma Ophthalmology 1998; 105: 322-326.
- Barr CC, Mc Lean IW, Zimmerman LE. Uveal melanoma in children and
adolescents. Arch Ophthalmol 1981; 99: 2.133-2.136.
- Strempel I, Krol P. Conjunctival malignant melanoma in
children.Ophthalmologica 1999; 213(2): 129-132.
- Greer CH. Congenital melanoma of the anterior uvea. Arch Ophthalmol
1966; 76: 77-78.
- Slamovits TL, Rosen CE, Suhrland MJ. Neuroblastoma presenting as acute
lymphoblastic leukemia but correctly diagnosed after orbital fine-needle
aspiration biopsy. J Clin Neuro Ophthalmol 1991; 11: 158-161.
- Grosfeld JL. Neuroblastoma. In: O'Neil JA, Rowe MI, Grosfeld JL, eds.
Pediatric Surgery. 5th ed. St Louis: CV Mosby; 1998; 405-409.
- Black CT, Haase GM. Neuroblastoma and other adrenal tumors. In: Carachi
R, Azmy A, Grosfeld JL eds.The Surgery of Childhood Tumors. London: Arnold
Publishers; 1999; 140-177.
- Miller NR. Neuroblastoma. In Miller NR, ed. Walsh and Hoyt’s
Neuro-Ophthalmology. 4th ed. Baltimore: Williams & Wilkins 1998; 3 :
1.296-1.300.
- Belgaumi AF, Kauffman WM, Jenkins JJ, et al. Blindness in children with
neuroblastoma. Cancer 1997; 80: 1.997-2.004.
- Edema QT, Oviawe Q, Akenzua GL. Orbitocephalic metastases from
neuroblastomas: report on three cases. West Afr J Med 1998; 17: 286-289.
- Kai T, IshiI E, Matsuzaki A, et al. High-dose chemotherapy and
autologous blood stem transplantation in children with metastatic neuroblastoma.
Acta Paediatrica Jpn 1997; 39: 54-60.
- Char DH, Miller T, Kroll S. Orbital metastases: diagnoses and course. Br
J Ophthalmol 1997; 81: 386-390.
|