|
INTRODUCCIÓN
Una causa frecuente de consulta oftalmológica infantil es la presencia de
epífora, conjuntivitis de repetición y secreción persistente en niños de
corta edad.
Una vez descartadas patologías como glaucoma congénito, queratitis, etc.
que puedan explicar la epífora por hipersecreción, nos planteamos la
exploración explícita de la vía lagrimal para objetivar alteraciones
específicas que nos permitan un tratamiento adecuado.
Las causas más frecuentes de obstrucción de la vía en niños son
congénita y traumática. En este capítulo expondremos su abordaje terapéu
tico.
EMBRIOLOGÍA Y ANATOMÍA
El aparato de drenaje lagrimal procede de un cordón ectodérmico ubicado
entre los procesos maxilar y nasal que aparece hacia la sexta semana de edad
gestacional. La canalización de la vía comienza entre las semanas 12 y 13,
completándose en el séptimo mes. El ducto es la última parte que se canaliza
(1) (figura 1).

Figura 1. A: Visión frontal del sistema lagrimal. B: Drenaje en el
meato inferior.
El drenaje de la lágrima comienza en ambos puntos lagrimales localizados 5 a
6 mm lateralmente al canto medial en el borde palpebral. Cada punto se abre a un
canalículo inicialmente vertical, aproximadamente 2 mm, que se hace horizontal
desplazándose medialmente en un tramo de unos 8 mm para abocar, en el 90% de la
población, al canalículo común (2). El canalículo común drena en el saco
lagrimal sufriendo una angulación (3) y presentando una pequeña dilatación a
este nivel formando el seno de Maier. El sistema canalicular está rodeado por
fibras del músculo orbicular pretarsal que actúan como un esfínter. El saco
lagrimal mide unos 12 a 15 mm de longitud y de extiende inferior y medialmente
para drenar en el meato inferior a través de ducto nasolagrimal. El saco se
ubica en la fosa lagrimal, delimitada anteriormente por la cresta lagrimal
anterior en el proceso frontal del hueso maxilar y posteriormente por la cresta
posterior en el hueso lagrimal. El tendón cantal medial es una compleja
estructura conformada por las cabezas superficial y profunda del músculo
orbicular pretarsal. La cabeza superficial se ancla a la cresta anterior y la
profunda a la posterior abrazando a la porción proximal del saco (4).
OBSTRUCCIÓN CONGÉNITA DE LA VÍA LAGRIMAL
La localización más frecuente de obstrucción es en el ducto nasolagrimal a
nivel de la válvula de Hasner. La obstrucción congénita de la vía lagrimal
(OCVL) aparece con una frecuencia aproximada del 6 % en recién nacidos a
término y en un 11% de pretérminos (5) (figura 2).

Figura 2. Infección del saco lagrimal.
Obstrucciones envolviendo las otras estructuras de la vía son menos
frecuentes incluyendo agenesia de puntos o canalículos, fístulas y quistes del
ducto que pueden aflorar por meato inferior. Se ha encontrado una importante
correlación entre la agenesia del punto y la del canalículo, pudiendo asociar
igualmente otro tipo de malformaciones (6).
AGENESIA DE PUNTOS Y CANALÍCULOS
La agenesia de punto o canalículo superior o inferior aislado no suele ser
motivo de epífora en los niños. Si aparece, el tratamiento inicial suele ser
el sondaje de las estructuras aparentes, pudiendo asociar una
dacriocistorrinostomía. Pero más frecuentemente la epífora se produce ante
cuadros de afectación superior e inferior. En estos casos lo recomendado es la
práctica de una conjuntivodacriocistorrinostomía con implante de un tubo de
Jones. El diseño del tubo de cristal de Pyrex junto con la técnica para
implantarlo fue realizado por Jones en 1960 (7). El método clásicamente
descrito consistía en la práctica de una dacriocistorrinostomía estándar
asociada a la crea ción de una fístula entre conjuntiva y pared lateral del
saco realizada con un cuchillete de cataratas. Posteriormente se coloca el tubo
con una longitud de unos 18 mm para abarcar el espacio entre conjuntiva y saco,
y se fija a piel mediante un punto de seda. El paciente debe estar perfectamente
instruido para sujetar el tubo con un dedo cada vez que necesite sonarse la
nariz evitando la extrusión (8) (figura 3).

Figura 3. A: Excisión parcial o total de la carúncula. B:
Inserción de una aguja de 18 G desde la carúncula hacia la rinostomía. Se
sitúa anteriormente a los colgajos posteriores. C: Dilatación. D:
Confirmación del trayecto con sonda de Bowman. E: Colocación del tubo. F:Vista
final.
Esta técnica ha sufrido modificaciones orientadas a simplificar la cirugía
evitando hacer la dacriocistorrinostomía. Así lo exponen, por ejemplo, Klapper
y Jordan en 1999. Tratan a dos niños con agenesia canalicular usando la vía
endonasal para visualizar una aguja de 18G que hacen pasar desde el área donde
han extirpado la carúncula, a través de la fosa lagrimal y hasta el meato
medio, anteriormente al cornete medio. En un segundo tiempo dilatan el conducto
creado e introducen el tubo de Jones. Generalmente éste no se recomienda en
niños menores de 10 años dados los cuidados postoperatorios que requiere para
que no se extruya, pero estos autores realizaron la técnica comentada en niños
de 4 y 5 años de edad y tuvieron buenos resultados (7). Nos abren una nueva
página en el campo de estas patologías difíciles de tratar.
Si la malformación afecta únicamente al punto lagrimal el tratamiento es
sencillo mediante punctoplastia.
FÍSTULAS CONGÉNITAS
Las fístulas suelen localizarse entre la piel y el canalículo común o el
saco, y están conformadas por epitelio. En numerosas ocasiones son
asintomáticas en el nacimiento y años posteriores y la pigmentación de la
piel que las rodea hace que pasen desapercibidas. Pero también pueden dar
sintomatología como epífora, secreción o dacriocistitis de repetición.
En el caso de las fístulas nos podemos encontrar con casos que se resuelven
espontáneamente y casos que precisan cirugía.
No hay acuerdo definitivo en cuanto al método quirúrgico a emplear en estos
pacientes. Lo más practicado hasta ahora era cerrar la piel tras su
cauterización; pero no era exitoso en muchos casos.
Según los estudios realizados en los noventa, lo más indicado es hacer un
examen individual de cada paciente y realizar excisión del tejido anómalo,
asociando o no dacriocistorrinostomía si se observa obstucción del ducto. La
intubación bicanalicular se hace necesaria cuando se ve envuelto el canalículo
común (9).
OBSTRUCCIÓN CONGÉNITA DEL DUCTO NASOLAGRIMAL
Ante un niño con OCVL nos podemos plantear diferentes posibilidades en
función de una serie de factores como son la edad y la severidad de los
síntomas (10). En general hay consenso para pautar tratamiento inicial con
masajes hidrostáticos y aplicación de antibióticos tópicos varias veces al
día durante los primeros meses de vida. El tema de discusión afecta a niños
con edades comprendidas entre 4 y 12 meses.
Hay autores que promueven un tratamiento inicial mediante sondaje de la vía
en la consulta con anestesia tópica, comprobando posteriormente la
permeabilidad mediante lavado, de forma precoz. A favor de esta pauta alegan
varias ventajas como son: menor coste, menor morbilidad en comparación con los
sondajes realizados en quirófano bajo anestesia general, menor estrés de los
padres que a su vez se impacientan si no se pone remedio rápido a la epífora
de sus hijos y un índice de éxitos de un 95% (11) (figuras 4 y 5).
Figura 4. Varios tipos de sondaje y lavado.

Figura 5. Material para sondaje e intubación.
Otros prefieren esperar a que el niño se haga mayor y directamente lo meten
en quirófano alegando que se evitan realizar un tratamiento en una patología
que se resuelve espontáneamente en un 96% en el primer año de vida (12), mayor
confort del paciente durante el proceso, posibilidad de inspeccionar la fosa
nasal, menor riesgo de crear una falsa vía con las consecuentes complicaciones
posibles como celulitis preseptal, estenosis o formación de divertículos (11).
Por otro lado en un estudio realizado en 1998 Robb demuestra que el éxito
del sondaje de la vía lagrimal es independiente de la edad del paciente. Entre
sus pacientes se encontraban niños de hasta 5 años de edad y no encontró
descenso significativo del éxito de los sondajes conforme avanzaba la edad;
concluyendo que parece probable que es eficaz a cualquier edad en la que una
sonda pueda acceder al ducto nasolagrimal si la obstrucción es a este nivel
(13).
En otros estudios se ha llegado ha alcanzar un índice de éxitos de hasta un
100% con 2 sondajes en niños de hasta 7 años de edad, aunque claramente aquí
hablamos ya de su realización en quirófano (13) (figura 6).

Figura 6. Sondaje e intubación de la vía en quirófano con control
endoscópico por el otorrinolaringólogo para la tutorización endonasal.
Con todos estos datos parece lógico establecer una pauta de tratamiento en
base a un árbol de decisiones parecido al que exponen Kassoff y Meyer
proponiendo realización de sondajes en consulta a los pacientes de 6 meses de
edad con repetición del mismo en dos o tres semanas si no se resuelve y
programación para quirófano posteriormente si persiste el problema; mientras
que si el niño acude con más edad se puede programar directamente (11).
En nuestro hospital la presión asistencial y por parte de los padres nos
lleva a la realización de sondajes precoces en consulta bajo anestesia tópica,
empleando para ello una sonda de Bowman. Realizamos hasta dos o tres antes de
programar a un niño para quirófano. Si llegamos a este punto la intervención
se realiza en colaboración con los otorrinolaringólogos para poder explorar
las fosas nasales e intubar al niño si fuese necesario o practicar
dacriocistorrinostomía endoscópica (DCR END) o turbinectomía.
Ya se ha comentado previamente la posibilidad de aparición de una
complicación posible, si bien poco frecuente, al realizar los sondajes en la
consulta, y es que provoquemos la aparición de una falsa vía, que, incluso,
podremos «recanalizar» en sucesivos sondajes. Este tipo de dificultades
solamente se pueden subsanar, en general, con la experiencia del oftalmólogo.
MÉTODOS DE INTUBACIÓN
El ducto nasolagrimal se abre a meato inferior en la pared lateral nasal y a
este nivel dicha pared se incurva en pendiente hacia el suelo; por otra parte el
cornete inferior puede tener una inserción baja que lo aproxime en exceso al
ostium (14). Esta disposición anatómica origina posibles dificultades a la
hora de intubar a un niño.
El tipo de sonda más usado habitualmente es la de Crawford (figura 6),
diseñada en 1977, que permite una fácil extracción mediante un gancho a
través del meato gracias al engrosamiento que posee en su extremo distal y
tiene unas tasas de resultados positivos del 100% (5). Esta sonda se puede
modificar practicando en ambos extremos una angulación que permita una entrada
más fácil hacia el suelo de la fosa por un lado, extremo distal, y como
referencia de ésta otra angulación en el extremo proximal que es el que
podemos ver en todo momento (14).
El método Ritleng consiste en un tubo de silicona unido a una guía de
Prolene monofilamento que se pasa a través del sistema lagrimal mediante una
sonda rígida hueca. La extracción del tubo con esta técnica también es
sencilla permitiendo intubaciones bi y monocanaliculares con un índice de
éxitos del 97%; considerando como éxito la desaparición de signos y síntomas
de la OCVL (5).
La sonda de Quickert-Dryden consiste en un tubo de silicona dirigido
anterógradamente por un director acanalado (1).
En 1992 se diseñó una nueva técnica para realizar intubaciones
monocanaliculares introduciendo en el mercado el tubo de Monoka. Aquí el tubo
de silicona presenta en su extremo proximal un platillo de 2 mm de diámetro
(figura 7) que impide el desplazamiento del mismo hacia la nariz al hacer tope
en el punto lagrimal. Este tubo ha precisado modificaciones como son el aumento
del diámetro del platillo a 3 mm, pues 2 mm no es lo suficiente como para que
se evite la migración a través del punto. Por otra parte el estudio realizado
con este sistema se basa en intubaciones de canalículo superior solamente. En
un caso en que se intubó el inferior apareció una erosión corneal que
necesitó tratamiento con antibióticos tópicos así como extracción del tubo.
Otras complicaciones que pueden aparecer con el implante de este sistema son
granulomas piogénicos a nivel del punto y desplazamientos del tubo con o sin
extubación prematura. Esta última se relaciona con un menor índice de éxitos
en el tratamiento. El tiempo óptimo de permanencia del tubo recomendado para
obtener la permeabilidad de la vía es de 4 a 6 meses. Respetando este tiempo se
obtienen resultados satisfactorios en un 93% de casos y las complicaciones
comentadas se pueden evitar colocando muy cuidadosamente el tubo con una
pequeña dilatación del punto y aplicando lubricante en abundancia para
facilitar su paso. Una vez cumplido el tiempo de permanencia del tubo, éste se
extrae fácilmente a través del punto (15).

Figura 7. Tubos de Monoka.
En general las complicaciones que observamos con el implante de un tubo de
Monoka son las mismas que se observan en intubaciones bicanaliculares con
cualquier método. Estas complicaciones son básicamente: desplazamiento del
tubo que puede conllevar una extubación prematura o caída del mismo hacia la
profundidad de la fosa bien espontáneamente o al intentar su extracción,
lesiones de los canalículos por fijar con excesiva tensión el tubo en la fosa
nasal y aparición de granulomas u otro tipo de afectaciones de la mucosa nasal
donde se fija la silicona (16-21).
Velodius y cols. confirmaron que de todas ellas la más frecuente es el
prolapso del tubo, lo cual ocurre con mayor probabilidad en los tres primeros
meses (21). Métodos empleados para evitarlo y facilitar a su vez la extracción
posterior son la realización de múltiples nudos seriados, dispositivos como
los utilizados para fijar los cerclajes usados en la cirugía de retina,
manguitos de Silastic, botones de silicona, clips, etc. Todo ello asociado o no
a la sutura del tubo a la mucosa nasal mediante puntos de seda. Parece claro que
los niños son pacientes peculiares de los que no se puede esperar una
cooperación absoluta para evitar que se toquen los ojos si tienen alguna
molestia, lo que hace más problemático el asunto que nos ocupa (figura 8).

Figura 8. Métodos de fijación en las intubaciones lagrimales con
tutorización de silicona.
En nuestra experiencia, lo que nos da bastante buen resultado es la
colocación de un manguito de silicona englobando ambos terminales con dos o
tres nudos entre ellos posteriormente. No suturamos a mucosa y el manguito suele
ser de un color llamativo para favorecer la extubación posterior. Es de gran
ayuda la presencia del otorrinolaringólogo que con el uso del video-endoscopio
se aproxima al meato y facilita la visualización del mismo con la extracción
del tubo.
La extubación la realizamos en quirófano bajo anestesia general en
colaboración igualmente con los otorrinolaringólogos por vía endonasal usando
un espéculo nasal y unas pinzas. Si no nos es posible localizar el tubo en la
fosa, lo cortamos a nivel superior, entre los puntos lagrimales, y lo dejamos
caer. Así hemos comprobado que el niño se lo suele tragar y no hemos tenido
ninguna complicación en este sentido. El tiempo que consideramos necesario para
que la intubación sea eficaz es de 5-6 meses, si bien otros autores lo acortan
a 6 semanas si han desaparecido los síntomas en ese período, dejándolo 12
semanas si persiste alguna molestia o más tiempo si los síntomas claramente no
han disminuido (18).
Si se produce una extubación espontánea no recolocamos el tubo y adoptamos
actitud expectante para ver si reaparecen los síntomas en cuyo caso proponemos
nueva intubación.
Si en la exploración oftalmológica del paciente objetivamos que el ducto no
es susceptible de intubación indicamos la realización de una DCR previa
exploración por parte de los especialistas en ORL.
DACRIOCISTORRINOSTOMÍA EXTERNA
En 1904 Toti fue el primero en describir la técnica de DCR externa (DCR EXT)
para el tratamiento de la dacriocistitis crónica; posteriormente se idearon
modificaciones por Dupuy-Dutemps y Bourguet en 1920 constituyendo la clásica
DCR que se practica hasta nuestros días (22). Tras infiltrar anestésico local,
se practica una incisión de aproximadamente 20 a 25 mm en la pared lateral de
la raíz nasal a unos 8-10 mm del canto medial. La incisión comienza justo por
debajo del tendón cantal medial y se dirige inferolateralmente. Se diseca
posteriormente el tendón y las estructuras adyacentes procurando no dañar la
vena angular. Se desplaza el saco lateralmente dejando a la vista el periostio
de la fosa lagrimal permitiendo entonces la realización de una osteotomía. A
la vista de la mucosa nasal se realiza una incisión vertical en la misma
generando un flap anterior y uno posterior. En la pared medial del saco se crean
igualmente dos flaps con una incisión semejante. Tras suturar los dos flaps
posteriores y anteriores se cierran los tejidos de alrededor y la herida
quirúrgica (8) (figura 9). Hay diferentes opiniones en cuanto a colocar o no
tubos de silicona para mantener la permeabilidad de la vía en el postoperatorio
inmediato. Allen y Berlin aportaron un estudio en 1989 en el que se objetivaban
peores resultados en las DCR EXT con intubación. Walland y Rose en 1994
encontraron que no había diferencia estadísticamente significativa. Finalmente
se ha recomendado intubar en aquellos casos con lesión asociada del canalículo
común y la presencia de un saco de pequeño tamaño y fibroso o con septos
(23).
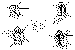
Figura 9. Dacriocistorrinostomía externa.
El índice de éxitos de la DCR EXT en niños con OCVL es del 93% según
describe Welham en 1985 (24). En adultos viene a ser de un 85% a un 99%
dependiendo del cirujano (23). Las mayores desventajas descritas en DCR EXT son
la herida quirúrgica visible con queloides, riesgo de hemorragias copiosas en
el acto quirúrgico, peligro de lesionar la anatomía del canto medio afectando
o no a la funcionalidad del parpadeo y complicaciones como rinorrea de LCR,
entre otras. Como beneficios de esta técnica encontramos que no es necesario
disponer de un material muy especializado y de gran coste al que no todos los
hospitales pueden acceder (25), buena visibilidad intraoperatoria, posibilidad
de tomar una biopsia si observamos alguna anomalía sospechosa y facilidad de
extracción de dacriolitos (25). En general es poco frecuente la necesidad de
emplear esta técnica en niños y ante casos que precisen la apertura de un
ostium entre saco y fosa nasal preferimos la realización de una DCR
endoscópica (DRC END.).
DACRIOCISTORRINOSTOMÍA ENDONASAL
Ya en 1893 Caldwell había introducido el acceso endonasal para el
tratamiento de la obstrucción del ducto (22).
No ha sido fácil el desarrollo de una técnica que permitiera el acceso
endonasal en estas cirugías. Era necesaria la creación de endoscopios rígidos
lo suficientemente finos, más aún en los niños. En nuestro hospital se
utilizan ópticas rígidas de 0° con un grosor de 2,7 mm si se trata de niños
pequeños y de 4 mm si son mayores. La iluminación se obtiene con una fuente de
luz fría de 250w o halógena si se quiere grabar en vídeo la intervención.
También es necesario un buen equipo de imagen. Estos sistemas han permitido no
solamente la innovación de los actos quirúrgicos sino también el seguimiento
posquirúrgico de los pacientes (20). El seguimiento postoperatorio endonasal ha
permitido, por ejemplo, observar y manejar los diferentes tipos de cierre de la
osteotomía que ocurren en pacientes intervenidos mediante DCR END con láser,
como son: cierre primario del ostium, formación de una cicatriz con el cornete
medio o con el septum nasal o formación de un granuloma en el ostium (26). Es
importante disponer de un buen aparato de fresado para realizar la osteotomía
pues hay que ser muy cuidadoso con la mucosa de las zonas próximas para evitar
secuelas cicatriciales. Hay que recordar aquí que la causa más frecuente de
fallo, no sólo en este procedimiento sino en la DCR EXT, es la aparición tras
la cirugía de cierres cicatriciales membranosos del agujero así como sinequias
entre el ostium y el septo nasal adyacente o la mucosa del cornete medio (22).
Con este instrumental (figura 10) podemos realizar los sondajes en quirófano y
las intubaciones como comentamos anteriormente; y también la DCR END si es
preciso. En este caso el acto quirúrgico es esencialmente practicado por el
otorrinolaringólogo, diestro en el manejo del endoscopio, dejando para el
oftalmólogo la posterior intubación de la vía (figura 10).
Figura 10. Diverso instrumental utilizado en la apertura de la
rinostomía endonasal.
Otras posibilidades que tenemos, no obstante, para acceder a la nariz es el
mismo microscopio binocular, como describen Eloy, Bertrand y cols. Ellos colocan
al paciente en decúbito supino permitiendo una buena alineación con el
microscopio. En un primer paso exponen el hueso lagrimal practicando la fractura
del cornete medio y separando pared lateral nasal por un lado y cornete con
pared medial por otro mediante dos separadores. Posteriormente realizan un flap
de mucosa nasal con bisturí eléctrico y la osteotomía con una fresa hasta
observar el saco. Tras incidir sobre el mismo se crea un segundo flap con
electrocauterio. Finalmente se unen ambos flaps con clips de titanio. Solamente
en casos de gran fibrosis o si hay afectación de canalículos o puntos dejan al
paciente intubado durante tres o cuatro meses (27) (figura 11).
Figura 11. Dacriocistorrinostomía vía endonasal con láser.
LÁSER EN LA DACRIOCISTORRINOSTOMÍA ENDOSCÓPICA
Durante los últimos 9 años se han modernizado este tipo de cirugías
gracias a la introducción del láser (figura 11) como elemento para crear la
fístula entre saco y meato medio. Los primeros que lo usaron fueron Massaro y
cols. en 1990 empleando láser Argón azul-verde (22). Desde entonces la
técnica inicialmente descrita ha sufrido modificaciones y se han empleado otros
tipos de láseres como el de CO2 y Nd-YAG de emisión continua y KTP, Ho-YAG,
Erbium-YAG; con combinaciones entre ellos (28-30). Según describen Massaro y
cols. las ventajas que presenta el uso de láser son además de las relacionadas
con el propio acceso quirúrgico endonasal, una excelente hemostasia y menor
morbilidad postoperatoria gracias a una menor inflamación (figura 12).
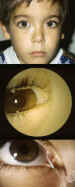
Figura 12. Diversos tipos de tutorización de canalículos.
Es importante decidir qué tipo de láser se utiliza si queremos practicar
esta técnica. El objetivo actual es causar el menor daño posible a las
estructuras adyacentes a la zona de la fístula al mismo tiempo que se
administra una energía con la suficiente potencia como para producir la
vaporización del hueso. Nuss y cols. en 1988 investigaron cuál sería la
longitud de onda óptima para ello (31). Los láseres de CO2, Holmium-YAG y
Erbium-YAG son muy útiles para la ablación del hueso. Los dos últimos actúan
por efecto térmico. El Holmiun-YAG además es vehiculado con facilidad a
través de una fibra óptica, lo cual facilita notablemente la cirugía. No
obstante Woog y cols. comentan en su estudio que observaron la necesidad de
aumentar la osteotomía con una fresa para mejorar los resultados. Para crear la
osteotomía solo con el láser era necesario disparar muchas veces y durante
mucho tiempo por lo que se quemaba en parte el tejido de alrededor y el mejor
método para eliminar este tejido así como para ampliar el ostium era la fresa,
consiguiendo finalmente un agujero de 6 a 10 mm de diámetro (29). Más tarde
Sadiq y cols. usan también este tipo de láser y realizan todo el proceso
solamente con la fibra (32). Kong y cols. encontraron las mismas dificultades
que Woog y emplearon varios herramientas combinadas en sus cirugías para
mejorar la técnica como pinzas, fresa, instrumentos de radiofrecuencia,
Holmium-YAG y Nd-YAG (30). Con el de CO2 se obtiene una excelente vaporización
del hueso pero no se puede vehicular más que a través de un brazo articulado y
no tiene buen efecto hemostático (28). El Erbium-YAG tiene una enorme
absorción por el colágeno, el agua y las sales inorgánicas siendo de mucha
eficacia en la destrucción del hueso (31). El láser de Neodinio tiene mínimo
efecto térmico por lo que no daña los tejidos de alrededor pero no se obtiene
con él una buena hemostasia. Con una fuente de Neodinio emitiendo hacia un
cristal de doble frecuencia de KTP se consigue un láser de KTP (28). Boush y
cols. utilizan Argon con potencias entre 5 y 15 W y se ayudan de pinzas y un
punch para practicar la osteotomía, teniendo un índice de éxitos del 70% en
una sola intervención y del 83% si se ha precisado de dos procedimientos (26).
Hartikainen y cols. en 1998 presentaron un estudio en el que trabajaban con un
aparato de láser combinado de CO2 y Nd (23).
Ya Nuss había especificado que ambos, siendo de emisión continua, eran
mucho menos precisos que los de emisión en pulsos. En el trabajo referido los
autores hallaron buena eficacia en la ablación del tejido y el efecto
hemostático. El método para evitar el daño térmico periférico consiste
sencillamente en empujar la pared lateral del saco hacia el meato con la fuente
de luz para focalizar el efecto del láser en esta zona (23). Todos estos
autores practican unas osteotomías de 6 a 12 mm de diámetro localizadas a
nivel más inferior y lateral de la pared del saco de la fosa lagrimal, con
implicación en algunos casos de cresta lagrimal anterior o posterior, pared
anterior de celdillas etmoidales anteriores o desplazamientos del cornete.
Hay que asociar a la DCR END la intubación con tubo de silicona ya que hay
relación entre la intubación y el éxito de la cirugía a corto plazo.
Al cabo de un año el efecto beneficioso de la silicona se reduce siendo
finalmente la diferencia en porcentajes de un 2% a 3% (32). Esto lógicamente
abre campo amplio a posteriores debates e investigaciones. También es
interesante comentar que se están llevando a cabo estudios para averiguar si es
útil el empleo de antimetabolitos como la Mitomicina C para favorecer que no
aparezcan sinequias entre estructuras tras la cirugía (30).
Hay autores que prefieren usar para toda la cirugía unidades de
radiofrecuencia y un punch, como describen Javate, Campomanes y cols. En su
trabajo usaron mitomicina con todos los pacientes y consiguen un índice de
éxitos de un 90% (34).
Como vemos durante toda esta década se ha estado investigando asiduamente la
mejoría de la cirugía relacionada con la vía lagrimal. En principio los
resultados se referían a pacientes adultos, si bien ya se han obtenido algunos
datos en relación a la población pediátrica (24, 35). En los niños el ostium
puede cerrarse con gran facilidad puesto que tienen una reacción fibroblástica
muy marcada y fácilmente aparecen granulomas. Por ello se ha objetivado, en los
pocos casos en que se ha aplicado esta técnica, que es preciso que se lleven a
cabo futuros estudios con el fin de poder intervenir pacientes pediátricos con
OCVL.
LACERACIONES DEL SISTEMA CANALICULAR
Cuando un traumatismo afecta a la vía lagrimal lo más frecuente es que se
lesione el sistema canalicular. Según se localice la obstrucción se han plan
teado diferentes posibilidades quirúrgicas (figura 12).
Clásicamente si se encuentra a nivel de puntos y canalículos superior o
inferior se suele tratar mediante el implante de un tubo de Lester Jones o
injertos de vena safena o mucosa oral con microcirugía (36).
Si se localiza más medialmente, cerca o en canalículo común, se realiza
una canaliculodacriocistorrinostomía, resecando la zona obstruída o dañada y
estableciendo una conexión directa con el saco a nivel del punto común interno
para proceder a una intubación posterior (37).
Una posibilidad planteada para el abordaje quirúrgico en lesiones que
impidan una buena identificación de estructuras o que afecten a la zona de
unión entre ambos canalículos es el acceso a través de una DCR EXT propuesta
por Wearn y cols en 1999, pero ya mencionada en la literatura por Lester Jones
en 1962. Una vez que se ha realizado la DCR de forma convencional, lo cual va a
beneficiar en cualquier caso puesto que se elimina la natural oposición del
ducto al paso de la lágrima, se accede al sistema canalicular mediante una
sonda a través del punto común interno retrógradamente. En el caso de no
encontrar el sistema se crea una falsa vía. Posteriormente se coloca un tubo de
silicona fácilmente. En su estudio Wearne y cols. tratan lesiones producidas no
sólo por traumatismos sino también por otras etiologías como herpes, agenesia
congénita del punto, idiopáticas etc. (38). Con este método se pretende
evitar la colocación del tubo de Jones y parece interesante tenerlo en cuenta a
la hora de aproximarnos a un niño con laceración extensa del sistema
canalicular pues ya se mencionaron anteriormente las dificultades de su implante
en los adultos y mucho más en los niños (figura 13).

Figura 13. Sondaje y tutorización de los canalículos en una rotura
palpebral bajo control microscópico.
En ocasiones se ve afecto solamente un canalículo que se secciona por
completo. La mayoría de los autores apuestan por una microcirugía de
reanastomosis de ambos cabos con posterior intubación con tubo de silicona. Sin
embargo se pueden conseguir resultados satisfactorios con otras técnicas como
puede ser la aproximación sencilla de los cabos, identificados con microscopio,
con intubación bicanalicular de la vía de forma convencional y la sutura de
los tejidos periféricos a la lesión. El primer punto, y el más importante
para la consolidación de la reanastomosis, habría que darlo a nivel anterior a
la laceración canalicular como describen Kersten y cols. en su estudio (37).
Esta técnica es bastante sencilla y se podría aplicar en niños puesto que en
el trabajo referido se trató a un recién nacido y tuvieron buenos resultados
en general, con permeabilidad de la vía en el 100% comprobado mediante sondaje
(figura 14).

Figura 14. Sutura con aproximación de los bordes palpebrales en la
rotura canalicular inferior.
En un trabajo publicado en julio del 99 por Smit y cols. se plantea la
posibilidad de no reparar las lesiones monocanaliculares. En su opinión la
presencia o ausencia de epífora es el más importante indicador del éxito en
el tratamiento de las mismas. Tanto el canalículo inferior como el superior
tienen la capacidad suficiente para evitar el lagrimeo en ausencia de
funcionalidad del compañero por lo que concluyen con que únicamente se deben
reparar los tejidos vecinos. Es importante comentar que en ningún caso se
utilizó la cola de cerdo como instrumental quirúrgico. Parece bien reconocido
el daño que se puede ocasionar cuando se usa (39). Sin embargo, hay cirugías
en que es difícil de localizar la entrada canalicular. Si sondamos el
canalículo opuesto con la sonda de Worst podemos localizar fácilmente la zona
para la intubación con silicona (figura 13).
Las últimas tendencias en cuanto a este tema se apoyan en instrumental de
alta tecnología como es el empleo de fibras de láser. Se ha conseguido
vehicular la energía del Erbium, Holmium y Neodinio a través de fibras de 350
nm, al mismo tiempo que se consiguen endoscopios de 0,5 mm de diámetro. Ello
permite diseñar una sonda de Bowman hueca y de 1,1 mm en cuyo interior se puede
introducir la sonda del láser, el endoscopio y la fuente de luz (figura 15).
Con este instrumental se accede fácilmente al sistema canalicular y se realizan
reparaciones de obstrucciones de pequeña longitud. En los trabajos hasta ahora
publicados se objetiva que el factor pronóstico más importante es la longitud
de la estenosis y no la localización. Tras la repermeabilización se impone,
como siempre, la necesidad de una intubación durante los meses posteriores
(36).
Figura 15. Sonda de Bowman hueca con 3 terminales: endoscopio,
láser y luz.
BIBLIOGRAFÍA
- Albert DM. Part V. Opthalmic Surgery. Principles and Techniques 1999.
- Nelson LB. Disorders of the lacrimal apparatus in infancy and childhood.
Harley’s Pediatric Ophthalmology. 4th Edition. 1998; 345-352.
- Tucker NA, Tucker SM, Linberg JV. The Anatomy of the Common Canaliculus.
Arch Ophthalmol. 1996; 114: 1.231-1.234.
- Basic and Clinical Science Course. American Academy of Ophthalmogy.
1999-2000; 13: 224-230.
- Pe MRL, Langford JD, Linberg JV, et al. Ritleng Intubation System for
Treatment of Congenital Nasolacrimal Duct Obstruction. Arch Ophthalmol. 1998;
116: 387-391.
- Wong JF, Woog JJ, Cunningham MJ, et al. A Multidisciplinary Approach to
Atypical Lacrimal Obstruction in Childhood. Ophthalmic Plastic and
Reconstructive Surgery. 1999; 15, 4: 293-298.
- Klapper SR, Jordan DR. Jones Tube Insertion in Children with Canalicular
Agenesis. Ophthalmic Surg Lasers. 1999; 30: 495-498.
- Dorrell ED: Lacrimal System. Surgery of the Eye. 1978; 8: 142-151.
- Ugurbas SH, Zilelioglu G. Congenital Lacrimal Fistula. Eur J Ophthalmol.
2000; 10: 22-26.
- Mannor GE, Rose GE, Frimpong-Ansah K, et al. Factors Affecting the
Success of Nasolacrimal Duct Probing for Congenital Nasolacrimal Duct
Obstruction. Am J Ophthalmol. 1999; 127: 616-617.
- Kassoff J, Meyer DR. Early Office-Based vs Late Hospital-Based
Nasolacrimal Duct Probing. A clinical decision analysis. Arch ophthalmol. 1995;
113: 1168-1171.
- MacEwen CJ, Young JDH. Epiphora during the first year of life. Eye. 1991;
5: 596-600.
- Robb RM. Success Rates of Nasolacrimal Duct Probing at Time Intervals
after 1 Year of Age. Ophthalmology. 1998; 105: 1.307-1.310.
- Meyer DR, Lindberg JV, Morgantown Wva, et al. Modification of Lacrimal
Probe Facilitates Silicone Intubation. Arch ophthalmol. 1989; 107: 1115-1116.
- Kaufman LM, Guay-Bhatia LA. Monocanalicular Intubation with Monoka Tubes
for the treatment of Congenital Nasolacrimal Duct Obstruction. Ophthalmology
1998; 105: 336-341.
- Jordan DR, Anderson RL, et al. Prevention of Prolapsed Silicone Stents in
Dacryocystorhinostomy Surgery. Arch ophthalmol 1987; 105: 455-456.
- Becker BB. Retained Silicone Tube in Congenital Nasolacrimal Duct
Obstruction. Am J Ophthalmol 1994; 118, 5: 671-672.
- Ratliff CD, Meyer DR. Silicone Intubation Without Intranasal Fixation for
Treatment of Congenital Nasolacrimal Duct Obstruction. Am J Ophthalmol. 1994;
118: 781-785.
- Merbs SL, Harris LL, Iwamoto MA, et al. Prevention of Prolapsed Silicone
Stents in Lacrimal Intubation Using an Intrasac Suture. Arch Ophthalmol. 1999;
117: 1.092-1.095.
- Brookes JL, Olver JM. Endoscopic Endonasal Management of Prolapsed
Silicone Tubes after Dacryocystorhinostomy. Ophthalmology 1999; 106:
2.101-2.105.
- Velodius A, Harvey JT, Philippon M. Long-Term placement of Silastic
nasolacrimal tubes. Ophthalmic Surg 1991; 22: 225-227.
- Massaro BM, Gonnering RS, Harris GH, et al. Endonasal Laser
Dacryocystorhinostomy. A New Approach to Nasolacrimal Duct Obstruction. Arch
Ophthalmol 1990; 108: 1.172-1.176.
- Hartikainen J, Grenman R, Puukka P, et al. Prospective Randomized
Comparison of External Dacryocystorhinostomy and Endonasal Laser
Dacryocystorhinostomy. Ophthalmology 1998; 105: 1.106-1.113.
- Doyle A, Russell J, O’Keefe M. Paediatric Laser DCR. Acta Ophthalmol
Scand 2000; 78: 204-205.
- Tarbet KJ, Custer PL. External Dacryocystorhinostomy. Surgical Success,
Patient Satisfaction, and Economic Cost. Ophthalmology 1995; 102: 1.065-1.070.
- Boush G, Lemke N, Dortzbach RK. Results of Endonasal Laser-assisted
Dacryocystorhinostomy. Ophthalmology 1994; 101: 955-959.
- Eloy Ph, Bertrand B, Martínez M, et al. Endonasal dacryocystorhinostomy:
Indications, technique and results. Rhinology 1995; 33: 229-233.
- Gonnering RS, Lyon DB, Fisher JC. Endoscopic Laser-Assisted Lacrimal
Surgery. Am J Ophthalmology 1991; 111: 152-157.
- Woog JJ, Metson R, Puliafito C. Holmium: YAG Endonasal Laser
Dacryocystorhinostomy. Am J Ophthalmology 1993; 116: 1-10.
- Kong YT, Kim TI, Kong BW. A Report or 131 Cases of Endoscopic Laser
Lacrimal Surgery. Ophthalmology. 1994; 101: 1793-1800.
- Nuss RC, Fabian RL, Puliafito CA. Infrared laser bone ablation. Lasers
Surg. Med 1988; 8: 381.
- Sadiq SA, Ohrlich S, Jones NS, et al. Endonasal laser
dacryocystorhinostomy- medium term results. Br J Ophthalmol 1997; 81:
1.089-1.092.
- Zilelioglu G, Ugurbas SH, Anadolu Y, et al. Adjunctive use of mitomycin C
on endoscopic lacrimal surgery. Br J Ophthalmol 1998; 82(1): 63-66.
- Javate RM, Campomanes BSA, Co ND, et al. The Endoscope and the
Radiofrecuency Unit in DCR Surgery. Ophthalmic Plastic and Reconstructive
Surgery. 1995; 11: 54-58.
- Szubin L, Papageorge A, Sacks E. Endonasal Laser-Assisted
Dacryocystorhinostomy. American Journal of Rhinology 1999; 13: 371-374.
- Kuchar A, Novak P, Pieh S, et al. Endoscopic laser recanalisation of
presaccal canalicular obstruction. Br J Ophthalmology 1999; 83: 443-447.
- Kersten RC, Kulwin DR. «One-stitch» Canalicular Repair. A Simplified
Approach for Repair of Canalicular Laceration. Ophthalmology 1996; 103: 785-789.
- Wearne MJ, Beigi B, Davis G, et al. Retrograde Intubation
Dacryocystorhinostomy for Proximal and Midcanalicular Obstruction.Ophthalmology
1999; 106: 2.325-2.329.
- Smit TJ, Mourits MPh. Monocanalicular Lesions. To Reconstruct or Not.
Ophthalmology 1999; 106: 1.310-1.312.
|