|
INTRODUCCIÓN
Sabemos que la forma y dimensiones del hueso orbitario están influenciados
por la presencia del globo ocular y, el anoftalmos se asocia con una
disminución del volumen de la órbita. Como factor sobreañadido, en pacientes
pediátricos enucleados por retinoblastoma se suma la hipoplasia orbitaria
producida por el tratamiento con radioterapia externa, en muchos de los casos.
Tradicionalmente no se utilizaban implantes orbitarios en niños,
especialmente en aquellos enucleados por retinoblastoma, ya que se pensaba que
el implante podía interferir con la detección de una posible recurrencia del
tumor, sin embargo desde la aparición de la tomografía computerizada (TAC) y,
sobre todo de la resonancia nuclear magnética (RNM), ésto ha dejado de ser un
problema.
Desde que se comenzaron a usar implantes orbitarios en niños y, a medida que
éstos han ido mejorando, los problemas estéticos y funcionales derivados de
los mismos han ido disminuyendo y con ello, los problemas psicológicos
asociados no ya a la pérdida de un ojo, sino también a la importante
alteración estética que seguía.
Durante los pasados 100 años los métodos y materiales para rehabilitar la
cavidad anoftálmica han sido continuamente modificados.
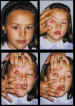
Figura 1. Aspecto estético y motilidad de una prótesis con
vástago.
Mules (1) en 1885 fue el primero en introducir una bola de cristal hueco en
el saco escleral tras evisceración. Más tarde, en 1887, Frost (2) y Lang (3)
lo hicieron tras enucleación.
Durante los años 20 se sucedieron una gran variedad de materiales tanto
orgánicos (cartílago, grasa, hueso..) como inorgánicos (oro, plata …), pero
fueron paulatinamente abandonados debido a la rápida reabsorción de los
primeros y a la descomposición química de los segundos.
Es en los años 40 cuando, después de la Segunda Guerra Mundial aparece por
primera vez el concepto de implante integrado o semienterrado, en
respuesta a una necesidad de mejorar la motilidad de los implantes en los
numerosos pacientes anoftálmicos tras heridas de guerra. Estos implantes a
diferencia de sus predecesores llamados no integrados, y que estaban totalmente
cubiertos por la cápsula de Tenon y por la conjuntiva, dejaban una porción
expuesta con el fin de acoplar la prótesis externa y conseguir así una mayor
motilidad.
Sin embargo, aunque con los implantes integrados se conseguía una buena
motilidad de la exoprótesis, el riego de infección y, el índice de
extrusiones era muy elevado (4) (cercano al 30%).
En un intento de solucionar estos problemas, Allen en 1950 diseña el
implante semiintegrado (5). Se trata de un implante totalmente enterrado,
pero con unas prominencias en su parte anterior destinadas a acoplarse a las
correspondientes oquedades talladas en la cara posterior de la prótesis
externa. Este implante conseguía efectivamente una buena motilidad pero las
zonas más prominentes ejercían una presión excesiva sobre los tejidos
suprayacentes ocasionando su necrosis y finalmente, la expulsión del implante.
En 1969, el implante original de Allen es modificado por el propio Allen,
Spivey y Burns, que hacen las prominencias más suaves en un intento de
disminuir la presión ejercida sobre la cápsula de Tenon y la conjuntiva. Este
implante se denominó implante de Iowa y según los autores consiguió reducir
el índice de extrusiones a un 5% (6). Todavía el implante de Iowa sufriría
algunas modificaciones que llevaron al desarrollo del implante Universal (7).
En 1985, el Doctor Arthur Perry (8) introduce un nuevo implante de
hidroxiapatita (HA) totalmente integrado, válido tanto para evisceraciones como
para enucleaciones. Este implante es presentado en 1989 en el Congreso de la
Sociedad Americana de Oftalmología, celebrado en Nueva Orleans. Su peculiar
arquitectura con multitud de poros permite el crecimiento de vasos y de tejido
conectivo, pasando a formar parte del huésped. Esta integración es todavía
mejorada por el uso de un vástago que se coloca cuando el implante se ha
vascularizado. El vástago se encargará de transferir toda la motilidad del
implante a la prótesis externa.
La HA sienta las bases para el desarrollo de los implantes integrados de
manera verdaderamente biológica, entre los que también cabe destacar el
polietileno poroso de alta densidad (medpor) propuesto por Karesh y Dresner (9)
en 1994.
CARACTERÍSTICAS DE LOS IMPLANTES POROSOS
Son implantes totalmente integrados que combinan biocompatibilidad (a través
de la integración de tejido orbitario fibrovascular) y, excelente motilidad por
fijación de los músculos extraoculares y más tarde, por acoplamiento de la
prótesis externa mediante un vástago que se coloca en un orificio que se
taladra, cuando el implante se ha vascularizado.
La presencia de tejido fibrovascular aumenta la resistencia a la infección
y, si ésta se produce, puede ser manejada de forma conservadora, mediante
antibióticos, sin necesidad de tener que recurrir directamente a la
explantación.
Por otro lado contribuye a fijar el implante a los tejidos orbitarios, con lo
que el riesgo de extrusión prácticamente desaparece.
Hidroxiapatita
La hidroxiapatita es un material derivado de la estructura esquelética de un
coral marino compuesto primariamente por fosfato cálcico. Posee un sistema
regular de poros interconectados de 250-500 micras de diámetro que remeda el
sistema haversiano del hueso trabecular. Esta estructura porosa proporciona una
malla para el crecimiento de tejido fibrovascular. Este material ya había sido
utilizado previamente en cirugía ortopédica y maxilofacial (10,11). Ha
demostrado ser bicompatible, no tóxica y no alergénica en humanos.
Debido a su superficie rugosa, cuando se coloca en la cavidad anoftálmica,
se requiere un recubrimiento, para no erosionar la conjuntiva. Actualmente
existen ya implantes de diferentes formas y tamaños que vienen preparados con
una malla de Vicryl o con una cubierta de PTFEe (politetrafluoroetileno
expandido de grandes poros).
Estudios histopatológicos han evidenciado la presencia de tejido
fibrovascular en un implante orbitario de hidroxiapatita 4 semanas después de
su implantación (12).
La reacción inflamatoria que produce es leve en la mayoría de los casos.
Existe una versión sintética producida en Francia por FCI.
Medpor
El medpor es un material sintético creado por polimerización de partículas
de etileno bajo alta presión y temperatura.
El polietileno de alta densidad que nosotros conocemos como medpor recibió
la aprobación de la FDA para su utilización en cirugía reconstructiva en
1985. Sin embargo se ha utilizado en cirugía reconstructiva facial desde 1947.
En el proceso de manufactura podemos controlar el diámetro del poro,
mientras que en el caso de la hidroxiapatita el diámetro del poro depende de la
especie del coral del que derive. Los implantes esféricos que se emplean para
rehabilitar la cavidad anoftálmica tienen un diámetro de poro de entre 100 y
500 micras de diámetro (habitualmente 200). Aproximadamente el 85% de los poros
son mayores de 150 micras. La estructura del poro es multidireccional debido a
la naturaleza del proceso de síntesis.
Una ventaja teórica sobre la hidroxiapatita es que debido a su textura más
lisa y suave, no necesita una cubierta para no erosionar la conjuntiva
suprayacente. Además, los músculos extraoculares pueden ser suturados
directamente al implante, lo que simplifica y acorta la intervención.
El acoplamiento de la prótesis externa puede hacerse mediante un vástago de
titanio.
La vascularización del medpor comienza algo más tardíamente que la de la
hidroxiapatita: entre la quinta y la duodécima semanas.
Alúmina
Es un nuevo implante de un material poroso sintético (Al2O3) con un 99% de
pureza. El diámetro medio de sus poros es de 500 micras. Puede utilizarse sin
cubierta, aunque en los casos de enucleación, es recomendable recubrirlo de un
material autógeno (esclera, fascia lata, aponeurosis del temporal) o de un
material sintético como el PTFEe o el Vicryl.
Parece ser que la vascularización completa del implante ocurre más o menos
a los 6 meses de su colocación.
TÉCNICA QUIRÚRGICA
Enucleación/evisceración
La enucleación se realiza siguiendo la técnica convencional. Nosotros
utilizamos el asa de alambre . En el caso de la evisceración es conveniente
llevar a cabo algunas modificaciones:
— Con una tijera de Wescott o con una hoja de bisturí del 15 se realizan
unas esclerotomías radiales posteriores en cada cuadrante, de unos 10-12 ´
3 mm aproximadamente. Estas incisiones empiezan en el ecuador y se extienden
posteriormente, hacia el nervio óptico. Su propósito es permitir la
colocación de un implante adecuado y facilitar la vascularización a través de
la superficie posterior del implante.
— Hay que realizar también incisiones relajantes desde los bordes de la
queratectomía para crear una mayor apertura para la introducción del implante
(normalmente una nasal y otra temporal).
— En ocasiones, cuando la cavidad es muy pequeña, hacemos una
esclerectomía posterior de 360° y el implante se coloca entre la grasa
orbitaria por detrás y la esclera posterior por delante, cerrandose ésta sobre
el implante.
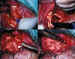
Figura 2. Evisceración con apertura del casquete escleral posterior
y colocación por detrás de una prótesis de H.A. recubierta de Vicryl.
Preparación del implante
— Pretratamiento del implante y de la cubierta en una solución salina con
Vancomicina 1 gramo o Bacitracina 500 U/ml. En el caso de la esclera sumergir
también en povidona yodada al 10%.
— Si se utiliza cubierta el implante es envuelto en la misma y se cierra
con una sutura continua de Vicryl de 5/0 dejando una pequeña apertura posterior
para favorecer el crecimiento fibrovascular.
— Realización de 4 ventanas rectangulares en la cubierta (esclera o PTFEe)
(aproximadamente de 3 ´
6 mm), unos 4 mm anteriores al ecuador, en los meridianos de las 12:00, 3:00,
6:00 y 9:00 horas.
— En las evisceraciones es conveniente realizar varios agujeros en el
implante con una aguja de 20g como fue descrito por Ferrone & Dutton (13),
para mejorar la vascularización.
Colocación del implante
— El implante es introducido en la cavidad orbitaria, con la porción
abierta orientada posteriormente. Ocasionalmente es necesario abrir la Tenon
posterior para permitir una adecuada colocación.
— Los músculos rectos son suturados al labio anterior de la
correspondiente ventana con la sutura de Vicryl doble armada. De esta manera,
son aproximados a la porción descubierta del implante, lo que también favorece
el crecimiento fibrovascular. Los músculos oblicuos, se suturan en su lugar
anatómico. En los implantes con malla de Vicryl y en los de medpor sin
cubierta, se suturan directamente un poco más anteriores a su posición
anatómica.
— La Tenon anterior se cierra sobre el implante con puntos sueltos de
Vicryl de 5-0 y la conjuntiva se aproxima con una sutura contínua o con puntos
sueltos de Seda de 6-0. Por último, se aplica pomada con corticoide y
antibiótico, se coloca un conformador y un vendaje compresivo, que se dejará
durante dos días.
— En el caso de los implantes secundarios, la técnica quirúrgica
es más compleja que la colocación de un implante primario por la disrupción
de la anatomía orbitaria, la pérdida de grasa, la contracción de la cavidad
y, la fibrosis de los músculos extraoculares y de los tejidos orbitarios.
En primer lugar se divide la órbita en 4 secciones hasta el ápex y, se
intentan aislar los músculos rectos. Si no es posible, se obtienen 4 pedículos
de Tenon que se suturan en el lugar aproximado de inserción de los rectos.

Figura 3. Enucleación con asa de alambre.

Figura 4. Suturas musculares en prótesis de hidroxiapatita
recubierta de Vicryl.
Seguimiento postoperatorio
— Los antibióticos sistémicos se mantienen una semana y el tratamiento
tópico un mes
— Los puntos de la conjuntiva se retiran a las 4-6 semanas y el paciente es
enviado a que le hagan una cascarilla externa provisional.
— A los 3-6 meses se realiza una resonancia nuclear magnética con
inyección de gadolinio para comprobar el grado de crecimiento fibrovascular en
el implante. Si éste es adecuado, podremos colocar el vástago. En los niños
la vascularización se produce de forma más precoz que en adultos, pudiendo ser
completa ya al tercer mes de su colocación.
Colocación del vástago
Para los implantes de HA, los primeros vástagos que se diseñaron fueron los
de metacrilato, después aparecieron los de policarbonato, primero simples y
luego atornillados y por último se han desarrollado los de hidroxiapatita y
titanio que se componen de un tornillo que por fuera es de HA y por dentro de
titanio y, el vástago propiamente dicho, que es de titanio. Para el medpor
disponemos de un vástago de titanio simple.

Figura 5. Colocación del vástago de titanio en una prótesis de
medpor con perfecta motilidad del implante.

Figura 6. Suturas musculares sobre un implante de alúmina.
La técnica es sencilla:
— Se marca el centro de la conjuntiva y se realiza una incisión horizontal
en la misma para exponer la parte anterior y central del implante.
— Perpendicularmente a la superficie del implante, hacemos un orificio con
un taladro mecánico (en los implantes de HA) o manual (en los de medpor o HA
sintética). El orificio debe tener una profundidad de 10-12 mm en los implantes
de HA y de 6 mm en los de medpor. El diámetro del orificio es de 3-3,5 mm en el
primer caso y de 2,5 mm en el segundo.
— Irrigamos el orificio con suero salino para limpiar los restos y a
continuación colocamos el vástago de titanio en los implantes de medpor o, un
tornillo de HA en el que se introduce el vástago de titanio, en los implantes
de HA. No hablaremos de los vástagos de policarbonato porque prácticamente han
caido en desuso.
— El orificio será colonizado por las células epiteliales de la
conjuntiva más o menos en 6 semanas. En este momento se enviará al paciente al
ocularista para que le hagan la cascarilla externa definitiva.

Figura 7. Introducción de HA con malla de vicryl en la cavidad
orbitaria y sutura muscular.
ESTUDIO DESCRIPTIVO
Hemos colocado implantes porosos en 79 pacientes sometidos a enucleación o
evisceración por diferentes patologías. Tres de los pacientes tenían un
implante bilateral y, en dos hubo que realizar un recambio de implante por
problemas en el postoperatorio. Por tanto se estudiaron un total de 84
implantes.
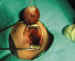
Figura 8. Colocación de la prótesis de medpor como implante
secundario en una cavidad anoftálmica.

Figura 9. Prótesis y vástagos existentes en la actualidad.
El rango de edad de estos pacientes osciló entre los dos meses y los 14
años (edad media: 3,2 años, desviación estándar: 19,38).
Se realizó enucleación en 69 casos (84,4%) y evisceración en 12 (15,6%).
De los implantes colocados, 67 eran primarios y 17 secundarios.
Con respecto al material del implante, se utilizó hidroxiapatita en 54
casos, medpor en 28 y, alúmina en 2.
Todos los implantes de HA llevaban cubierta. En la mayoría se utilizó
esclera (43), pero también se pusieron implantes de HA cubiertos de PTFEe (4) y
de una malla de Vicryl (7).
En el caso de los implantes de medpor, un 22,7% se pusieron sin cubierta, un
31,3% con cubierta de PTFEe y, un 45,4% con cubierta de esclera.
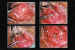
Figura 10. Colocación y atornillamiento del implante de titanio en
la prótesis vascularizada de medpor.
En lo que se refiere a la patología subyacente, en nuestra serie, en la
mayoría de los casos de enucleación, la causa más frecuente fue el
retinoblastoma (51 casos), seguido a la larga distancia por los traumatismos y,
después, por otras patologías como el síndrome de Stickler, vítreo primario
hiperplásico, quiste orbitario colobomatoso y endoftalmitis.
La evisceración se realizó por traumatismos fundamentalmente. Otras causas
fueron: retinopatía del prematuro, disgenesias del segmento anterior etc. En
todos estos casos había fracasado previamente el tratamiento médico y
quirúrgico.
Se realizó resonancia nuclear magnética en el 75% de los pacientes.
Se colocó vástago en 29 pacientes (39% del total). Siete de estos vástagos
eran de policarbonato simple, 12 de policarbonato atornillado, 6 de titanio y 4
de titanio e hidroxiapatita.
VASCULARIZACIÓN
El crecimiento fibrovascular en los implantes de hidroxiapatita y medpor es
una característica fundamental, que proporciona una serie de ventajas, ya
mencionadas. Es necesario asegurarnos de que el implante se ha vascularizado y
de que se producirá la epitelización del orificio que se taladra para colocar
el vástago antes de hacerlo. El epitelio conjuntival en las paredes del
orificio separa el implante del exterior, previniendo complicaciones como la
infección.

Figura 11. Injerto de mucosa bucal suturado a los bordes de la conjuntiva
vascular en casos refractarios.
Se han utilizado diversos métodos de imagen para evaluar la vascularización
de estos implantes (14), pero sin duda la resonancia nuclear magnética con
antena de superficie e inyección de gadolinio-DPTA, es la mejor técnica por su
alta definición e inocuidad.
El patrón de realce en el implante es igual al patrón histológico de
crecimiento fibrovascular, progresando desde la periferia al centro (15).
En nuestros pacientes, se pudo evidenciar una buena vascularización en el
63,3% de los implantes, con un realce superior al 70%. Un 24,5% te nían una
vascularización moderada (realce entre el 30-70%) y sólo un 12% escasa, con un
realce inferior al 30%. Ni el tipo de implante (primario o secundario) ni el
material del mismo (HA o medpor) influyen en la vascularización. La mayoría de
los implantes con pobre crecimiento fibrovascular se habían colocado tras
evisceración.
COMPLICACIONES
Complicaciones del implante
Exposición
La exposición fue la complicación más frecuente en nuestros pacientes con
una incidencia global de un 28%.
De la misma manera, también ha sido la complicación más frecuente
reportada en la literatura aunque con una incidencia muy variable según los
autores. Los datos en la literatura son contradictorios. Así, mientras Kostick
y Limberg (16) tienen una incidencia de exposición tras evisceración de sólo
un 6%, otros autores como Buettner reportan una incidencia de un 66% (17). La
incidencia de exposición tras enucleación también es variable, oscilando
entre un 3-22%. Así, Shields (18) reporta una incidencia de un 2%, mientras
Buettner (17) ofrece unos resultados de un 11% y Nunery (19) de un 22%. En los
niños la exposición es más frecuente (20).

Figura 12. Injerto de placenta en exposiciones del implante con
conjuntiva insuficiente.
Los factores implicados son diferentes según la exposición sea precoz o
tardía.
Así, en los casos en los que la exposición es precoz, es decir en el primer
o segundo mes, el factor más importante sería una excesiva tensión en la
herida ocasionada por un cierre inadecuado de la conjuntiva y de la cápsula de
Tenon y/o por un implante demasiado grande para la cavidad. Es importante por
tanto, intentar ampliar en la medida de lo posible la cavidad anoftálmica como
fue propuesto por Kostick, elegir un implante de tamaño adecuado que pueda ser
colocado fácilmente y, realizar un cierre meticuloso de la Tenon y de la
conjuntiva sin dejar tensión en la herida. Nosotros colocamos implantes de 16
mm en niños menores de un año, de 18 mm en niños mayores de esa edad y, de 20
mm en adultos, aunque individualizando según los casos.
Por otro lado, cuando la exposición se produce tardiamente el factor más
implicado es una vascularización insuficiente. Cuando ésto es así, el manejo
es difícil ya que son frecuentes las reexposiciones a pesar del tratamiento.
Pueden estar implicados otros factores como por ejemplo una reacción de
cuerpo extraño, que en casos de vascularización pobre o moderada puede
acelerar la reabsorción de la cubierta y favorecer la exposición.
El material del implante (HA o medpor) no influye en la exposición, ni
tampoco el tipo de cubierta aunque en los implantes de medpor el riesgo es mayor
si no se pone cubierta.
Los pacientes que han recibido radioterapia previa son más susceptibles a
esta complicación, ya que suelen tener una conjuntiva friable y necrótica.
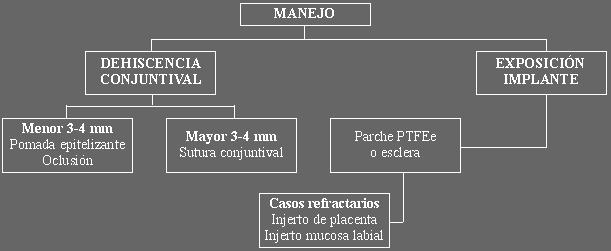
Manejo
Hemos de decir en primer lugar, que en nuestra experiencia y según los datos
de la literatura, una vez que la exposición ocurre, no simpre es fácil cubrir
el defecto con éxito (21,22). La pauta que seguimos es básicamente la
representada en el esquema 1.
Además evitamos en lo posible manipular excesivamente la prótesis externa
en los casos en los que ya se ha colocado. Si pensamos que esta prótesis está
haciendo una presión excesiva sobre la conjuntiva retrasando también la
vascularización, la retiramos durante una temporada para eliminar este factor
mecánico o le mandamos al ocularista para que la modifique De hecho,
Oestreicher (23) y Kim (22) proponen como medida para evitar la exposición
limar la superficie anterior del implante, aplanándola, de manera que quede un
espacio más grande a los ocularistas para adaptar la prótesis externa. Afirman
que es necesario al menos un espacio de 6 mm para que pueda hacerse sin
dificultad y, para que dicha prótesis sea lo suficientemente gruesa como para
que pueda ser modificada las veces necesarias para adaptarla al vástago.
Esquema 1.
Actualmente también realizamos unas incisiones de descarga en fórnix
inferior y superior independientemente del tipo de tratamiento quirúrgico
empleado con el fin de relajar la conjuntiva. No hemos obtenido buenos
resultados con la sutura conjuntival aislada.
Kim (22) propone un parche de tejido autógeno suturado a los bordes de la
conjuntiva vascular. Para defectos pequeños prefiere mucosa de paladar y para
defectos grandes injerto dermograso.
En el Hospital Infantil La Paz hemos utilizado la mucosa labial y el injerto
de placenta en los casos refractarios.
Otras complicaciones de los tejidos blandos
Son poco frecuentes y, en su mayoría, poco importantes: conjuntivitis,
quiste de inclusión conjuntival, granuloma piogénico etc.
No se ha descrito ningún caso de extrusión, una de las
complicaciones más frecuentes y temidas con otros implantes. El tejido
fibrovascular contribuye a fijar el implante al resto de los tejidos orbitarios
aboliendo prácticamente el riesgo de esta complicación.
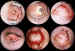
Figura 13. Utilización de PTFEe, mucosa bucal y palatina en la
exposición de prótesis de medpor e hidroxiapatita.
Una mención especial, por la gravedad que reviste, merece la infección
del implante. Su incidencia es afortunadamente pequeña, oscilando en
torno al 1-2% (24,25).
La puerta de entrada de los gérmenes puede estar en el mismo momento de
colocación del implante o postoperatoriamente a través de una zona de
dehiscencia conjuntival. Los gérmenes dentro del implante se multiplican y
migran a la superficie donde propician la inflamación y dehiscencia de la
conjuntiva. La conjuntiva dehiscente puede actuar a su vez como puerta de
entrada perpetuandose el problema.
Una ventaja de los implantes porosos es que, a través de los vasos que se
forman en su interior, las defensas del propio sistema inmune del huésped
tienen acceso al implante dificultando que se produzca una infección y si ésta
ocurre, pueden ayudar a erradicarla. Además, la infección podría ser manejada
con antibóticos sistémicos en lugar de recurrir directamente a la
explantación.
Pero, en la práctica, ésto no siempre es eficaz: Kaltreider y Newman (21)
en una serie de 154 pacientes con implante de hidroxiapatita, tuvieron 3 casos
de infección, sin respuesta al tratamiento con antibióticos tópicos ni
sistémicos. Jordan (26), en los dos casos que reportó de abscesos en implantes
de hidroxiapatita también hubo de recurrir a la explantación. Nosotros tuvimos
un caso de infección del implante y, tampoco tuvimos éxito con el manejo
conservador.
La explicación está en que si la infección ocurre antes de que la
vascularización se desarrolle totalmente (lo que puede llevar varios meses) los
gérmenes quedan acantonados en el implante en sitios de difícil acceso para
los antibióticos y las células defensivas del huésped.
Los gérmenes aislados en los casos reportados de abscesos de implantes
porosos han sido: Staphylococcus aureus, Streptococcus pneumoniae y Haemophilus
influenza.
En cualquier caso, dada la dificultad de su manejo y la gravedad de esta
complicación, lo fundamental es intentar prevenirla. Para ello podemos tomar
una serie de medidas: en primer lugar, pretratar el implante y su cubierta (si
la tiene) con antibióticos, en segundo lugar, intentar favorecer la
vascularización y por último, ante cualquier dehiscencia conjuntival o
cualquier inflamación persistente sin causa justificada, tratar al paciente con
antibióticos tópicos y observarle cuidadosamente.
Complicaciones de los párpados
La ptosis es una de las complicaciones más frecuentes de los párpados. La
incidencia en la literatura oscila entre un 16%y un 23,5% (27).
Puede ser secundaria a la dehiscencia o desinserción de la aponeurosis del
elevador por la manipulación del complejo elevador-recto superior o, estar
ocasionada por peso excesivo debido a edema del párpado superior después de la
cirugía.
No siempre requiere un tratamiento quirúrgico y si es leve, como ocurre en
la mayoría de los casos, puede ser manejada modificando la prótesis externa.
La laxitud del párpado inferior también es una complicación
frecuente (10%-17,6%). Lleva consigo la incapacidad para retener el conformador.
Muchas veces está producida por edema en el postoperatorio. Para prevenirlo
Oestreicher (23) recomienda colocar suturas desde al fórnix al periostio y a la
piel.

Figura 14. Injerto dermograso como última posibilidad en la
exposición recidivante de las prótesis vascularizables.
Otra complicación descrita es la insuficiencia del fórnix inferior
que por falta de espacio, no deja colocar un conformador o permite colocar uno
pero de menor tamaño al que correspondería. Este problema puede intentar
evitarse realizando descargas en la conjuntiva del fórnix inferior para dejar
un mayor fondo de saco.
Complicaciones del vástago
El vástago puede colocarse a cualquier edad pero muchos autores como Shields
(28), De Potter (29) y Ashworth (30) no son partidarios de ponerlo en niños, al
menos en menores de siete años. Las razones que dan son: por un lado, la
necesidad de una anestesia general y por otro, las dificultades para adaptar la
prótesis externa.
Nosostros hemos colocado vástagos en niños tan pequeños como de dos años
de edad y no hemos tenido más número de complicaciones que en niños mayores.
Con respecto a la anestesia, no es necesario dormir totalmente al niño y
simplemente haciéndole inhalar gases con mascarilla podemos conseguir un nivel
de profundización suficiente que nos permita llevar a cabo el procedimiento,
especialmente ahora con lo nuevos vástagos de titanio que se colocan con un
taladro manual.
En lo referente a la adaptación de la prótesis externa, efectivamente puede
resultar más tediosa que en un adulto porque los niños no colaboran de la
misma manera. En cualquier caso, con un poco de paciencia se pueden llegar a
conseguir excelentes resultados. No olvidemos, que la mayoría son niños que
han sido sometidos a múltiples exploraciones y tratamientos.
Las principales complicaciones que pueden aparecer en relación con el
vástago son: extrusión, dolor o disconfort, edema, conjuntivitis, click
audible, sobrecrecimiento de tejido conjuntival sobre el vástago, etc. Se ha
comunicado también algún caso de disminución de la motilidad .
Pero sin duda, la complicación más frecuente en todas las series ha sido la
extrusión. La incidencia de extrusión ha oscilado entre un 7,3%, según
Ashworth (30), un 11% en la serie de Oestreicher (23) y, un 26% en el estudio
realizado por Edelstein (31).
La evolución desde los primeros vástagos de metacrilato de una sóla pieza
hasta los actuales vástagos de titanio junto con la evolución de los sistemas
para colocarlos se ha ido acompañando de una progresiva disminución de las
complicaciones. Así, en un estudio realizado por Edelstein sobre las
complicaciones del vástago de policarbonato, vemos que entre los de una pieza,
hubo un 32% de extrusiones frente a un 0% entre los atornillados. El principal
problema de los vástagos no atornillados es la formación de un tejido de
granulación en la base del orificio que favorece la extrusión. En el caso de
los vástagos atornillados, el tornillo representa una barrera estructural que
evita la formación de tejido de granulación en la base del mismo.
En nuestros pacientes con vástago se produjo extrusión en un 24%. La
mayoría de estas extrusiones ocurrieron con vástagos de policarbonato simple.
No tuvimos ninguna extrusión de vástagos de titanio ni de titanio e
hidroxiapatita.
Los problemas del vástago debidos a un orificio inadecuado pueden ser un
factor limitante a la hora de adaptar la prótesis externa al implante en
algunos casos. Para solucionar esta complicación, en algunos casos es necesario
profundizar con la fresa, interponer un microfilm de 3/0 o poner una gota de
cianocrilato.
En cualquier caso, creemos que estos implantes fueron diseñados para ser
totalmente integrados y que siempre que la motilidad pueda mejorarse, lo ideal
es colocar un vástago. Además, el vástago mejora la estabilidad de la
prótesis externa aboliendo la rotación inadvertida de la misma y soporta en
parte el peso de la prótesis reduciendo la sobrecarga del fórnix inferior y
del párpado inferior.
MOTILIDAD
En la revisión de la literatura, todos los autores coinciden en que la
motilidad conseguida con estos implantes es buena (32). Así, Shields (27) en su
serie de 200 casos con implante de hidroxiapatita nos dice que sin vástago la
motilidad conseguida fue buena en un 92% y excelente (motilidad conversacional
de alto rango) en el 22%. Con vástago la motilidad fue buena en el 100% de los
casos y, excelente en el 43%. Karesh y Dresner (9) en un trabajo sobre implantes
de medpor también encuentran que la motilidad fue buena en todos los casos
excepto en un implante secundario.
En nuestros pacientes la motilidad fue buena en un 20,3% de los casos y
excelente en un 56,3%.
No encontramos diferencia según se hubiera realizado enucleación o
evisceración. Lo que quiere decir que, con una técnica adecuada (poco
traumática y aislando todos los músculos) y un implante adecuado, la motilidad
no tiene porqué ser peor en los pacientes enucleados que en los eviscerados.
Sí encontramos diferencias estadísticamente significativas entre los
implantes primarios y los secundarios. De hecho, el 6% de pacientes en los que
la motilidad fue escasa correspondía a implantes secundarios. En estos casos,
en ocasiones es difícil aislar los músculos porque sólo quedan remanentes de
algunas fibras, que están atróficas y retraidas en el ápex orbitario. Incluso
a veces hay que recurrir a suturar cuatro pedículos de Tenon en el lugar de
inserción de los músculos extraoculares para conseguir algo de motilidad.
Indudablemente el vástago mejora la motilidad y si se quieren conseguir los
movimientos finos conversacionales hay que ponerlo.
La adaptación adecuada de la prótesis externa también es fundamental a la
hora de conseguir una motilidad adecuada. Nosotros hemos encontrado
discrepancias entre la motilidad del implante y la de la prótesis externa que,
en todos los casos se debían a una mala adaptación de la misma, porque no
fuera de la forma o del tamaño adecuados o porque no se acoplara exactamente al
vástago. En este sentido es importante la colaboración del ocularista para
realizar todas las modificaciones de la prótesis que sean necesarias hasta
conseguir los mejores resultados posibles.
BIBLIOGRAFÍA
- Mules H. Evisceration of the globe with artificial vitreous. Trans
Ophthalmol Soc UK 1885; 5: 200-206.
- Frost WA. What is the best method of dealing with a lost eye? Br Med J
1887; 1: 1.153-1.154.
- Lang W. On the insertion of artificial globes into Tenon's capsule after
excising the eye. Trans Ophthalmol Soc UK 1887; 7: 286.
- Jahrling RC. Stadistical study of extruded implants. Today's ocularist
1979; 9: 25-27.
- Allen JH, Allen L. A buried muscle cone implant I. Development of a
tunneled hemiespherical type. Arch Ophthalmol 1950; 43: 879-890.
- Spivey BE, Allen L, Burns CA. The Iowa enucleation implant. A 10 year
evaluation of technique and results. Am J Ophthalmol 1969; 67: 171-188.
- Jordan DR, Anderson RL, Allen L. A preliminary report of the Universal
implant. Arch Ophthalmol 1987; 105: 1.726-1.731.
- Perry AC. Advances in enucleation. Ophthal Plast Reconstr Surg 1991; 4:
173-177.
- Karesh WJ, Dresner CS. High-density porous polyethylene (medpor) as
succesful anophthalmic socket implant. Ophthalmology 1994; 101: 1.688-1.696.
- Kenney EB, Lekovic VS, Ferreira JC, Han T, Dimitrijevic B, Carranza FA.
Bone formation within porous hydroxyapatite implants in human periodontal
defects. J Periodontal 1986; 57: 76-83.
- Rosen HM. Surgical correction of the vertically deficient chin. Plast
Reconstr Surg 1988; 82: 247-255.
- Shields CL, Shields JA, Eagle RC, De Potter P. Histopathologic evidence
of fibrovascular in growth four weeks after placement of the hydroxyapatite
orbital implant. Am J Ophthalmol 1991; 111: 363-366.
- Dutton JJ. Coralline hydroxyapatite as an ocular implant. Ophthalmology
1991; 98: 370-377.
- De Potter P, Shields LC, Shields AJ, Flanders AE. Role of magnetic
resonance imaging in the evaluation of hydroxyapatite implant. Ophthalmology
1992; 99(5): 824-830.
- Hamilton HE, Christianson MD, Williams JP, Thomas RA. Evaluation of
vascularization of coralline hydroxyapatite ocular implants by magnetic
resonance imaging. Clinical imaging 1992: 16: 243-246.
- Kostick AD, Linberg VJ. Evisceration with hydroxyapatite implant.
Ophthalmology 1995; 102: 1.542-1.549.
- Buettner H, Bartley GB. Tissue breakdown and exposure associated with
orbital hydroxyapatite implants. Am J Ophthalmol 1992; 113: 669-673.
- Shields CL, Shields JA, De Potter P. Hydroxyapatite orbital implant after
enucleation. Experience with initial 100 consecutive cases. Arch Ophthalmol
1992; 110: 333-338.
- Nunery NR, Heinz GN, Bonnin JM et al. Exposure rate of hydroxyapatite
spheres in the anophthalmic socket: histopathologic correlation and comparison
with silicone sphere implants. Ophthalmic Plast Reconstr Surg 1993; 9: 96-104.
- Karcioglu AZ, Al-Mesfer SA, Mullaney BP. Porous polyethylene orbital
implant in patients with retinoblastoma. Ophthalmology 1998; 105(7): 1.311-1.36.
- Kaltreider SA, Newman SA. Prevention and managament of complications
associated with the hydroxyapatite implant. Ophthalmic Plast Reconstr Surg 1996;
12: 18-31.
- Kim Y, Goldberg RA et al. Managament of exposed hydroxyapatite orbital
implants. Ophthalmology 1994; 101 (10): 1.709-1.715.
- Oestreicher JH, Liuu E, Berkowitz M. Complications of hydroxyapatite
orbital implants. A review of 100 consecutive cases and comparison of Dexon mesh
(Polyglycilic acid) with scleral wrapping. Ophthalmology 1997; 104 (2): 324-329.
- Shields CL, Shields JA, De Potter P, Singh AD. Lack of complications of
the hydroxyapatite orbital implant in 250 consecutive cases. Trans Am Ophthalmol
Soc 1993; 91: 177-195.
- Ainbinder DJ, Haik BG, Tellado M. Hydroxyapatite orbital implant abscess:
histophathologic correlation of an infected implant following evisceration.
Ophthalmic Plast Reconstr Surg 1994; 10: 267-270.
- Jordan DR, Brownstein S, Jolly SS. Abscessed hydroxyapatite orbital
implants. A report of two cases. Ophthalmology 1996; 103(11): 1.784-1.787
- Masry GG, Holds JB. Coralline hydroxyapatite spheres as secondary orbital
implants in anophthalmos. Ophthalmology 1995; 102: 161-166.
- Shields JA, Shields LC, De Potter P. Hydroxyapatited orbital implant
after enucleation. Experience with 200 cases. Mayo Clin Proc 1993; 68:
1.191-1.195.
- De Potter P, Shields LC, Shields AJ, Singh DA. Use of the hydroxyapatite
orbital inplant in the pediatric population. Arch Ophthalmol 1994; 112: 208-211.
- Ashworth J, Brammar R, Inkster C, Leatherbarrow B. A study of the
hydroxyapatite orbital implant drilling procedure 1998. Eye; 12: 37-42.
- Edelstein C, Shields LC, De Potter P, Shields AJ. Complications of
motility peg placement for the hydroxyapatite implant. Ophthalmology 1997; 104:
1.618-1.620.
- Custer LP, Trinkaus MK, Dphil fj. Comparative motility of hydroxyapatite
and alloplastic enucleation implants. Ophthalmology 1999; 106(3): 513-516.
|