|
1. INTRODUCCIÓN AL ESTUDIO DE TRAUMATISMOS OCULARES EN LA INFANCIA El manejo y resolución de traumatismos oculares en la infancia, conlleva una exploración sistemática que nos permita aclarar, sin lugar a dudas, cual es la extensión del traumatismo, y si este ha quedado confinado al globo ocular, o afecta a otras estructuras vecinas, como la órbita y anejos, los senos para-nasales o cualquier otra estructura cráneo-facial, puesto que la extensión del traumatismo (1), puede abarcar desde simples erosiones superficiales, a lesiones orbitarias o cerebrales devastadoras. En la infancia, en muchos casos la colaboración del paciente no nos permite una exploración dialogada, por lo que se ha de ser muy escrupuloso en los distintos pasos a seguir para evitar descuidos. Una minuciosa exploración nos delimitará la extensión, el grado de afectación y nos centrará en nuestro trabajo: el traumatismo ocular (2). Otro punto a considerar, es el de la viabilidad del ojo, tan importante en pacientes jóvenes con una gran expectativa de vida. Hemos de plantearnos si el órgano es salvable y que pronóstico visual le damos. La enucleación precoz en estos pacientes, conlleva una serie de problemas añadidos, por lo cual hemos de evitarla reservándola solo para ojos definitivamente destruidos. La enucleación en un segundo tiempo, después de los 10 días del trauma, nos permitirá aclarar cual es la situación real del ojo una vez reparado, y sí la realización de nuevas intervenciones puede mejorar su pronóstico anatómico y funcional. También los padres tendrán tiempo de contrastar una segunda opinión y de ser plenamente conscientes de la necesidad de extraer el globo ocular. La existencia de una simple laceración palpebral, no nos exime de constatar la integridad del órgano ocular, o la no existencia de cuerpos extraños intraoculares, sobre todo en estos pacientes, que en muchos casos no nos ayudan. No debemos olvidar de consultar el calendario vacunal del niño y si es necesario poner una dosis de recuerdo (0,5 ml) de toxina antitetánica.
A. Epidemiología Hay diversos estudios estadísticos sobre el origen de los traumatismos en los niños, tanto en Europa (3) como en Asia (4-6), pero uno de los más completos es el realizado en el Wilmer Institute de Baltimore, en el que, en pacientes menores de 16 años que requirieron ingreso, encontraron que por cada 100.000 miembros de la población pediátrica, sufrieron un traumatismo ocular 15,2 niños. Los varones padecieron más traumatismos que las chicas en una proporción de 4: 1 y fueron más del doble de este porcentaje en pacientes de 11 a 15 años. La causa más frecuente de traumatismos fueron los golpes o caídas en el 37%, deportes o juegos en el 27%, quemaduras en el 9%, accidentes de coche en el 11%, y armas de fuego en el 4%. Sobre todo se destaca en el estudio que la mayoría de los traumatismos eran predecibles y evitables (7,8,9). En nuestro país, El Grupo Español Multicéntrico para el Estudio de Traumatismos Oculares, (G.E.M.T.O.), encontró que en la población general la principal causa de traumatismos oculares en nuestro medio son los accidentes laborales (23%), seguidos de los domésticos (22,5%), ocio (16%), accidentes de tráfico (14%), accidentes deportivos (12%), agresiones (10%) y otros (2%). De ellos las 2/3 partes ocurren en hombres. Existe un ligero predominio del ojo izquierdo sobre el derecho y la afectación bilateral se dio en el 5-10%. En el 50% de los casos los traumatismos ocurren en menores de 30 años. Burgeño y colaboradores (10) publicaron un estudio realizado en el Principado de Asturias. En este estudio el 80% (4:1) de los pacientes fueron chicos y la mayoría, 85,6%, no requirió ingreso. El incidente ocurrió en el hogar o en la escuela en el 33% de los casos, durante el tiempo de juego en el 32% de los casos, se asoció a la práctica de deportes en el 12% de los casos, a agresiones en el 10%, a accidentes de tráfico en el 3% y por causas desconocidas en el 10% de los casos. Indudablemente el medio, la tecnología y las modas influyen mucho en el modo y la forma de los traumatismos, así tendremos que determinados juegos o juguetes en uso originarán determinadas lesiones oculares (7,9,11-16). En los últimos años se ha apreciado en los niños, un nuevo tipo de traumatismo asociado a la utilización del airbag en los automóviles. Un punto en el que coinciden la mayoría de los autores, es en que generalmente, los traumatismos son evitables al ocurrir en ambiente doméstico, durante el tiempo de juego o practicando deportes (17-21,26,27).
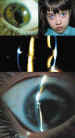
B. Exploración ocular Primero debemos encuadrar el caso con un pequeño interrogatorio a los padres: ¿Cómo ocurrió el traumatismo? ¿Qué estaba haciendo el niño? ¿Estaban jugando con algo metálico o estaban trabajando cerca de él golpeando metal? ¿Se estaban usando ácidos o bases? En caso que sospechemos que pudiera ser debido a agentes químicos, debemos realizar lo primero un lavado ocular para después continuar con el interrogatorio (22). Si la edad del paciente nos lo permite, debemos documentar la agudeza visual como primera exploración oftalmológica, y luego examinar los reflejos pupilares y la motilidad ocular extrínseca, lo cual nos permitirá detectar y encuadrar afectaciones que en algunos casos pasarían desapercibidas. A continuación, debemos pasar a un cuidadoso examen en lámpara de hendidura del polo anterior, prestando atención a posibles laceraciones del globo, a la transparencia o no de la córnea, la cámara anterior o el cristalino. Podemos encontrarnos con cuerpos extraños alojados en la cavidad vítrea, con una exploración del polo anterior casi normal, o con mínimas lesiones autoselladas en córnea, que pueden ser la puerta de entrada, o bien lesiones ocultas en limbo. En estos casos casi siempre existe un fino Tyndall vítreo (figura 1).
Hay que explorar siempre el fondo de ojo de estos pacientes, mediante midriasis farmacológica e indentación periférica. Si el paciente no colabora y tenemos sospecha moderada de la existencia por ejemplo de un cuerpo extraño intraocular, podríamos realizar una radiografía simple de la órbita para el despistaje (23). Si la sospecha es importante debemos realizar una tomografía computerizada para salir de dudas o usar el TAC helicoidal (24). Si el paciente colabora pero los medios no son transparentes, debemos también plantearnos la realización de una tomografía. Si el paciente no colabora y sospechamos una afectación ocular, debemos plantearnos la exploración bajo anestesia general, pudiendo si es necesario llegar a practicar una peritomía exploratoria, si sospechamos una ruptura del globo ocular. Un hiposfagma conjuntival importante o una hipotonía ocular, deben hacernos pensar en una herida oculta (25). Una vez realizada la exploración, plantearemos un plan de acción y si debemos intervenir por un ojo abierto, activaremos todos los mecanismos necesarios en el centro en el que nos encontramos para su realización en la mayor brevedad posible. La reconstrucción de problemas palpebrales o de vías lagrimales puede esperar algo más.
2. EL OJO ABIERTO EN LA EDAD PEDIÁTRICA A. Introducción Debemos considerar el ojo abierto como una urgencia oftalmológica, en la gran mayoría de casos (28-30). El pronóstico visual de un ojo abierto, viene marcado por el tamaño, la localización y la morfología de la herida que produce la ruptura ocular (31,32). Podemos decir que cuando la herida se sitúa por delante de los rectos, es de 10 mm o menor y es incisa el pronóstico visual es bueno. Si la visión previa a la reparación es de 20/200 podemos esperar recuperaciones visuales del orden de 20/60, como nos comenta Esmaeli y col. (33). Cuando la ruptura ocular ocurre por detrás de los músculos rectos, con heridas mayores de 10mm, producidas por traumatismos contusos, y existen visiones previas a la cirugía de percepción de luz, los resultados visuales finales suelen ser muy pobres (34,35) (figura 2).
Tendremos presente también la posibilidad de roturas oculares derivadas del parto, por traumatismo directo o en las maniobras del parto. Esto es algo que deberían tener en cuenta los obstetras ante todo alumbramiento complicado (36,37). Un tema importante es la antibioterapia previa a la intervención. Diversos estudios han demostrado que el tratamiento profiláctico con antibióticos intravenosos, disminuye la concentración de colonias bacterianas en el humor acuoso en el momento de la cirugía. Por ello, reduce el riesgo de endoftalmitis en el postoperatorio inmediato, al disminuir la incidencia de contaminación microbiana intraocular, que según diversos estudios está por encima del 30%. Por ello creemos que debe instaurarse tratamiento con Vancomicina y Ceftacidima a dosis pediátrica, en el momento del ingreso (38-42). Otro concepto discutido es cuando realizar la reparación ocular. Pensamos, que debe realizarse lo antes posible y en el momento en que se den las circunstancias, en las cuales tanto el cirujano como el paciente estén preparados; este último, debe de poder resistir una anestesia general sin riesgo a padecer aspiraciones, por tener restos alimenticios en el estómago. No se encuentran diferencias significativas en intervenciones que se realizan dentro de las primeras 24 horas del accidente. Sin embargo se incrementa de forma muy importante el riesgo de endoftalmitis (39) cuando se demora la cirugía más allá de las primeras 24 horas. Hemos de recordar al anestesista que se trata de un ojo abierto, para que mantenga bien relajado al enfermo, con la idea de evitar contracciones musculares que en estos casos pueden ser fatales.
B. Técnica quirúrgica En función del tipo de lesión actuaremos de una forma o de otra, así para pequeñas laceraciones en el espesor de la córnea o perforaciones autoselladas, podemos solucionarlas de una forma conservadora, con una oclusión, con una lente de contacto o usando bioadhesivos como el cianocrylato (43). Esto puede evitarnos anestesias generales y posibles irregularidades corneáles, que pueden llevarnos a situaciones ambliopigénicas si la edad del paciente lo permite. En cualquier caso lo ideal es el ingreso hospitalario y la estrecha vigilancia bajo antibioterapia. Con lesiones mayores, bajo anestesia general, comenzaremos tapando el otro ojo y aplicando una solución de Betadine al 10% periocular (38). Si el ojo está muy hipotónico, en lugar de separador metálico podemos mantener la apertura ocular, mediante tracción de los párpados con una sutura, seda de 4 ceros es suficiente. Esto evita una presión excesiva sobre el globo. Empezaremos por hacer en la conjuntiva, una apertura perilimbar de 360° con cuatro incisiones de descarga. Estos 4 cuadrantes de conjuntiva pueden sujetarse con un Vicryl de 7-0 y una presilla, para suturarlos al final. Retiraremos con cuidado la Tenon, lo que en los niños dada su morfología, nos llevará algún tiempo, y luego se procederá a inspeccionar el globo, siempre bajo microscopio. Buscaremos zonas de prolapso uveal, delimitando toda la zona a reparar. La úvea que prolapse por la laceración escleral, podemos introducirla con suavidad, usando una solución viscoelástica aplicada con una cánula. Una vez realizado ésto, suturaremos de forma continua toda la herida con un Vicryl de 7-0. Cuanto más atrás esté la herida, más complicada resulta la sutura. Utilizaremos para ello, si fuera necesario un Desmarres o cualquier otro separador orbitario, que nos facilite la exposición de la zona a suturar, pues resulta esencial hacer una buena exposición de la zona más posterior de la laceración. En los traumatismos contusos han de sospecharse roturas posteriores, y si no son visibles, debemos realizar desinserciones exploratorias de los rectos, para tratar de localizarlas. En los traumatismos contusos, las roturas suelen localizarse en áreas posteriores y detrás de los músculos (44), ya que es la zona donde la esclera es más fina. Rutinariamente hemos de buscar debajo de cada músculo (45). Una vez se ha suturado, el músculo es posicionado nuevamente en su inserción original. Todos los cuadrantes deben ser cuidadosamente explorados pasando una hemosteta que seque y nos muestre heridas ocultas por coágulos de sangre. Una vez terminada la exploración y sutura, coseremos la conjuntiva con Vicryl de 7-0.
C. Laceraciones córneo esclerales Las heridas que interesan a la esclera hasta el limbo las reparamos con Vicryl de 7-0, la córnea la coseremos con Nylon de 10-0. La úvea debe ser repuesta con una espátula de ciclodiálisis o con viscoelástico. La cámara anterior debe mantenerse con viscoelástico; actualmente usamos soluciones viscoadaptativas de última generación, por su capacidad de mantenerse y adherirse a las distintas estructuras. Las suturas debemos realizarlas con un nudo doble inicial seguidas de dos nudos simples, de esta forma dado el grosor del nudo, podremos enterrarlo en el espesor del estroma y no rozará durante el postoperatorio, teniendo en cuenta que éste será largo. Una vez finalizada la sutura, debemos comprobar la estanqueidad de la misma, con la instilación de fluoresceína bajo luz azul cobalto. Al finalizar realizaremos una paracentesis de ayuda, que podemos usar entre otras cosas para separar los restos del iris del endotelio corneal, mediante espátula o viscoelástico. El cirujano debe valorar que porción de iris se retira o cual se repone, y hay que hacer un cultivo de lo que extraigamos. La parte del iris necrótico, o incarcerado más de 24 horas, debe eliminarse. La sutura en tejido corneal, debe interesar las 3/4 partes de su espesor (figura 3), aproximando bien los bordes, sin que resulte demasiado apretada. El nudo lo enterraremos y evitaremos las adherencias o sinequias, dejándo la cámara anterior conformada. Ante grandes heridas corneales en estrella, con pérdida del estroma en el centro, debemos dar puntos que aproximen los bordes hasta la zona central de la misma y ahí, dar un punto circunferencial a través del estroma, tratando de cerrar la pérdida de sustancia. Si fuera necesario usaremos cianocrylato para tapar posibles poros residuales o colocaremos una lente de contacto, con un parche compresivo al final. Terminamos la intervención con una inyección subtenoniana de esteroides, para intentar disminuir la intensa reacción inflamatoria que suelen padecer los niños, en los días sucesivos a la cirugía.
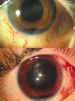
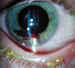
En la literatura no queda muy claro que hacer, cuando existen lesiones asociadas a la rotura corneal (46), y así los diferentes autores no se ponen de acuerdo, en que hacer con un cristalino lesionado, si extraerlo o dejarlo para un segundo tiempo. Indudablemente la actitud la tomará el cirujano siguiendo su propio criterio, valorando la situación en todo su conjunto, y recordando que en la edad pediátrica una nueva intervención supone una nueva anestesia general. Valoraremos el estado de las distintas estructuras para tomar una decisión; por ejemplo, un cristalino opacificado pero íntegro, con una córnea muy alterada, puede dejarse para un segundo tiempo, posiblemente cuando se realice la queratoplástia penetrante (47). Si la córnea no está muy alterada podremos hacerlo todo en el mismo tiempo (figuras 4, 5, 6 y 7).
D. Rotura ocular en un traumatismo contuso Cuando tenemos un ojo abierto secundario a un traumatismo contuso, el pronóstico es mucho peor que si se debe a un objeto punzante o cortante (48). El porcentaje de roturas oculares asociadas a traumas contusos es bajo, 1,1-3,5% según diversos autores (49-51). Este tipo de roturas suele afectar a la coroides y al cuerpo ciliar, lo cual ensombrece el pronóstico al ser estructuras muy vascularizadas, complicándose la situación con una hemorragia o una reacción inflamatoria, que en los niños suele ser más importante que en los adultos. Hay una serie de signos y síntomas que deben hacernos pensar en una apertura ocular ante un trauma contuso: agudeza visual de percepción de luz o menor, presión intraocular de 5 mmHg o menor, opacidad de medios en cámara anterior o vítrea con un oftalmoscopio indirecto, o defectos pupilares; en estos casos debe realizarse una peritomía exploratoria.
3. TRAUMATISMOS OCULARES CONTUSOS EN LA EDAD PEDIÁTRICA La mayoría de los traumatismos contusos se producen en la población menor de 18 años, y son más frecuentes en los chicos que en las chicas, en una proporción de 4:1. En su gran mayoría se producen mientras se practican deportes, ocupando un segundo lugar los juegos, las agresiones o los accidentes de tráfico (52). Entre los objetos que con más asiduidad golpean el ojo tenemos: puños, pelotas de golf y tenis, piedras y palos. Las causas que con mayor frecuencia terminan en enucleación son las agresiones (53) y los accidentes de coche. Algo en lo que están de acuerdo la mayoría de los autores es en la necesidad de proteger el ojo, con unas gafas adecuadas, cuando se practican determinados deportes (52,54,55).
A. Traumatismos contusos del segmento anterior ¿Qué ocurre cuando el ojo es golpeado por un objeto contuso? El mecanismo de daño se origina por golpe y contragolpe. El golpe se produce por incidencia directa del objeto sobre el ojo, y el contragolpe por las ondas de choque sobre la estructura opuesta al punto del golpe. Cuando el objeto que incide sobre la órbita es mayor que ésta, como una pelota de tenis, la mayoría de la energía se disipa en el reborde orbitario, y la expansión del ojo y del contenido de la órbita puede causar una fractura de la pared medial e inferior de la misma. Cuando el objeto que incide sobre la órbita es más pequeño que ésta, como una pelota de golf, la fuerza se aplica directamente sobre el ojo, comprimiendo el contenido ocular y expandiendo el globo circunferencialmente. Las zonas por donde normalmente se suele romper el globo ocular son las más débiles, la unión corneo-escleral, las inserciones musculares y la salida del nervio óptico (56-59).
La córnea suele sufrir una abrasión, pero raramente se abre, salvo que haya sido operada previamente de queratotomía radial, lo que es muy raro en edades pediátricas; las líneas de corte son mucho más débiles que la córnea normal, por lo que pueden abrirse. También puede romperse si hay alteraciones del grosor estromal, por distrofias u otra patología, o cirugías previas como cataratas con incisiones corneales o transplantes de córnea, aunque se hayan realizado años antes. Lo que sí suele ocurrir en la córnea es una gran pérdida de células endoteliales y ruptura de las uniones intercelulares, normalmente producidas por las ondas de choque del trauma corneal inicial (60), aunque también pueden originarse por contacto endotelial con el iris y el cristalino. Es excepcional tener que recurrir al transplante de córnea en estos pacientes, aunque el daño endotelial sea permanente (61). Cuando se asocia un hiphema traumático a las lesiones endoteliales, la hemoglobina puede pasar al estroma corneal, produciendo una impregnación de la misma. Normalmente suele aclarar aunque muy lentamente, esto en los adultos no es un inconveniente pero en los niños puede crear una ambliopía, por ello tenemos que ser menos conservadores y realizar un lavado de cámara anterior para su limpieza. Los traumatismos sobre la córnea también pueden ocasionar desgarros en la membrana de Descement, como los que se ven en traumatismos por fórceps durante el parto (62). Durante un traumatismo contuso fuerte, el iris golpea contra el cristalino, en un intento de evitar un escape de humor acuoso a la cámara posterior. Si la energía es suficientemente fuerte, el acuoso atrapado diseca el cuerpo ciliar, produciendo lo que se llama recesión angular. Este desgarro del cuerpo ciliar es responsable del 90% de los hiphemas por traumatismo contuso.
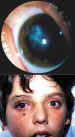
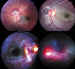
El hiphema (figura 8) es la patología que encontramos con mayor frecuencia en los traumatismos oculares contusos, ocurriendo en un 69% de los casos (63,64). En los niños suele inducir somnolencia y hay que tener presente la tendencia a la ambliopización. Los podemos clasificar en 4 grados según su gravedad:
Como decíamos antes en un traumatismo contuso fuerte, se produce un desplazamiento del plano iris-cristalino hacia atrás, originando un desgarro de las estructuras próximas al ángulo camerular, lo que en la mayoría de los casos, induce la formación de una hemorragia en la cámara anterior, normalmente por lesión de los vasos que existen en la superficie del cuerpo ciliar. También puede existir hemorragia por rotura directa de los vasos del iris, iridodiálisis o ciclodiálisis. En este momento, ocurre una disminución brusca del flujo de salida del humor acuoso, por lo que sube bruscamente la presión intra-ocular, ayudando al cese de la hemorragia. Al aumento de presión, se le suman la vasoconstricción refleja del vaso, y la formación de un coágulo de plaquetas y fibrina, que ayudan a parar el sangrado. Al mismo tiempo se liberan a cámara anterior una serie de activadores tisulares que transforman el plasminógeno en plasmina, iniciando la fibrinolisis y disolución del coágulo. El punto de salida de todos estos productos metabólicos y de detritus, es en su mayor parte el trabéculum. En cuanto al tratamiento del hiphema, hay que resaltar que en niños suele ser un motivo de ingreso hospitalario, salvo que sea leve. Se prescribe un reposo en cama, con el paciente elevado de la horizontal unos 30° o más. No se ha demostrado el aumento de eficacia con la oclusión ocular bilateral. En cuanto al tratamiento médico, utilizaremos un ciclopléjico cada 8 horas ya que tiene un efecto positivo, al aumentar el confort del paciente en la iritis traumática y facilitar la exploración del fondo de ojo. Debemos evitar los mióticos por su efecto inflamatorio en la fase aguda. Asímismo evitaremos el uso de aspirina y derivados al aumentar la tendencia al sangrado. Usaremos esteroides tópicos para frenar la inflamación y disminuir el dolor; no está unánimemente aceptado por otro lado el uso de esteroides orales, ya que estabilizan el coágulo y aumentan la tendencia al resangrado. Algunos autores apuntaron las ventajas del uso de Ácido Aminocapróico, para intentar disminuir el riesgo de resangrado (65). El mecanismo de acción pasa por la inhibición competitiva de la activación del plasminógeno en plasmina, de esta forma se evita la degradación del coágulo de fibrina sobre el vaso sangrante. Sin embargo el coste y efectos secundarios desaconsejan su uso, salvo en casos muy severos. La supresión brusca del Ácido Aminocapróico, produce una disolución rápida del coágulo, ésto cuando tenemos hiphemas mayores del 30%, puede producir un glaucoma agudo por enclavamiento del trabéculum. En niños debemos pasar a un lavado quirúrgico del coágulo, cuando tengamos un aumento incontrolado de la PIO, cuando exista el menor indicio de tinción corneal, o cuando no se limpie un coágulo denso después de 5 días (64,66,67). Lo ideal es proceder a un lavado de cámara anterior simple, aunque a veces es preciso dada la densidad del coágulo, realizar una vitrectomía anterior con infusión por una segunda vía, esto si es preciso lo realizaremos con sumo cuidado para no dañar estructuras. En el 3,5-38% de los casos según autores, ocurre un resangrado en los 2-5 días siguientes al trauma, pudiendo complicar una hemorragia que en principio parecía en resolución (68). Especialmente preocupante es en los niños menores de 6 años donde la tendencia al resangrado es mayor, llegando al 7,6% de los casos en la población blanca. Del 1 al 5% de los casos de hiphema total, desarrollan una tinción hemática de la córnea. La ambliopía no es rara. También se aprecia una alteración del campo visual, que en algunos casos puede llegar a ser severa (69-72).
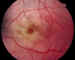
La tinción corneal hemática se presenta hasta en un 5% de los casos. Se ve en hiphemas muy grandes, resangrados o coágulos muy persistentes. Dos factores se suman aumentando el riesgo, el aumento de la PIO y sobre todo una disfunción endotelial con rotura de las uniones celulares. Histopatológicamente se aprecian productos procedentes de la fractura de los eritrocitos y depósitos de hemosiderina en los queratocitos. Aparecen cambios granulares amarillentos en la parte posterior del estroma corneal, y disminución en la definición de la estructura fibrilar del mismo. Suele resolverse en varios meses espontáneamente, empezando el aclaramiento en la periferia, y posteriormente se limpia el centro. En los niños puede ser necesario hacer una queratoplastia penetrante para evitar la ambliopía. También se pueden producir en el ojo traumatizado roturas pupilares (figura 9), con pupilas atónicas o irregulares, desgarros del esfínter del iris, diálisis de la raíz del mismo, áreas de atrofia, etc. Puede originarse una ciclodiálisis cuando la rotura del cuerpo ciliar crea una comunicación con el espacio supracoroideo. En estos casos suele producirse un aumento tensional mientras se mantiene el hiphema, para pasar a una hipotonía cuando éste se resuelve.
Existen distintas causas por las cuales se puede producir un glaucoma en un traumatismo contuso. La recesión angular, la trabeculitis o un hiphema disminuyen el volumen de humor acuoso que puede evacuar el trabéculum; por el contrario, agresiones al cuerpo ciliar suelen disminuir el flujo de producción del mismo. Se ha observado que en muchos pacientes que han sufrido un traumatismo contuso, con el tiempo desarrollan un glaucoma. Existen varios factores etiológicos: proliferación de células endoteliales y membrana de Descemet, proliferación de fibroblastos o formación de una sinequia periférica anterior como reacción inflamatoria a la permanencia en el ángulo de sangre por más de 7 días. Por ello en los niños se recomienda hacer un lavado de cámara anterior si no existe un aclaramiento rápido de la sangre. El 9% de los pacientes evolucionan a un glaucoma con recesión angular, precisando una trabeculectomía y el uso de antimetabolitos, muchos autores lo recomiendan ante las características inflamatorias de estos glaucomas. Hemos de tener presente la pérdida de agudeza y campo visual que todo ello puede conllevar (69,70). El mecanismo de acción para el daño cristaliniano en un traumatismo contuso, también se explica mediante la teoría del golpe contragolpe (73,74). Se atribuye la formación de una catarata por contusión, al contragolpe que sigue a un golpe en la región orbitaria. La teoría de la expansión ecuatorial del ojo (75,76), sugiere que las ondas de choque atraviesan el ojo produciendo un acortamiento antero posterior, con alargamiento ecuatorial concomitante, pudiendo originar la ruptura de la cápsula anterior o posterior y la opacificación del cristalino. La disrupción zonular durante un aumento del meridiano ecuatorial origina una dislocación o subluxación cristaliniana. Por otro lado la inflamación y la alteración normal del medio cristaliniano, que conlleva un trauma, originan una metaplasia fibrosa de las células que forman la superficie epitelial del lecho cristaliniano (derivadas del ectodermo), formándose una placa fibrosa en la zona del traumatismo, aunque se mantenga intacta la cápsula. Pequeñas perforaciones capsulares, pueden ocasionar también esta fibrosis, para ello algunos autores proponen un tratamiento con láser Nd Yag pulsátil (77). Cuando existe una exposición larga de las células epiteliales del cristalino al ambiente hostil de una inflamación del humor acuoso, el epitelio aumenta su tamaño por edematización, y después se produce la muerte celular y la opacificación, formándose una catarata. Las células individualmente o en pequeños grupos, se pueden proteger envolviéndose en fragmentos residuales sobre la cápsula, que si se recubren y proliferan formarán las llamadas perlas de Elsching's. El traumatismo a veces produce desgarros del anillo zonular que pueden observarse con la lámpara de hendidura cuando hay una iridodonesis. Si dilatamos la pupila podremos ver el cristalino subluxado. Cuanto mayor sea la zona de disrupción zonular, más clara será la subluxación. El cristalino puede desplazarse al vítreo o a la cámara anterior. La luxación del cristalino a la cámara anterior producirá una elevación de la presión intraocular y una descompensación corneal. Si la luxación posterior es completa, puede no suponer un problema inmediato para el ojo, y permanecer años flotando en vítreo produciendo un constante traumatismo sobre la retina, que se traducirá en una alteración pigmentaria de la hemirretina inferior. Si la cápsula del cristalino está intacta, la catarata puede tardar meses o incluso años en desarrollarse, pero si la cápsula está rota se produce la hidratación del material cortical, y la catarata puede aparecer rápidamente. En este caso existe siempre un grado importante de inflamación, y es frecuente el glaucoma secundario a daño angular, o al bloqueo pupilar relativo que se produce (figura 10).
El tratamiento médico de una catarata traumática está dirigido hacia opacidades focales, fuera del eje visual, o frente a la inflamación. Las opacidades pequeñas fuera del eje visual, pueden disminuir la AV por deslumbramiento o diplopia, y en estos casos los mióticos pueden ayudar a mantener un eje visual claro, atenuando los efectos aberrantes de las opacidades periféricas. La inflamación intraocular secundaria al traumatismo romo por sí mismo, o por una uveítis inducida por el cristalino, puede provocar la obstrucción de la malla trabecular, sinequias anteriores con cierre angular, y sinequias posteriores con bloqueo pupilar. El tratamiento intenso con corticoides tópicos está indicado para controlar la inflamación y si es necesario corticoides perioculares o sistémicos. Pueden ser necesarios los betabloqueantes tópicos, midriáticos e inhibidores de la anhidrasa carbónica para controlar el aumento de PIO. En cuanto al tratamiento quirúrgico en los niños, debemos plantearnos la cirugía siempre que consideremos como posible la inducción de una ambliopía en el ojo del traumatismo, aunque hemos de considerar que en niños muy pequeños, la recuperación funcional de un ojo intervenido puede ser un trabajo poco fructífero. En el caso de una catarata con cápsula íntegra, aplicaremos las técnicas de pequeña incisión que podemos consultar en el capítulo de cataratas en la infancia, que al ser el cristalino blando cambian respecto a las del adulto; la reacción inflamatoria postquirúrgica también es diferente a la del adulto. Los cristalinos luxados a cámara anterior o mínimamente luxados, dada su consistencia, podemos aspirarlos con facilidad previa realización de una capsulorrexis. Si encontramos una subluxación importante, podemos tras la capsulorrexis colocar un anillo capsular y estabilizar de esta forma el saco. Si fuera una gran subluxación, además de la colocación de un anillo capsular, procederemos a colocar unos ganchos de iris sujetando la capsulorrexis para asegurarnos que el cristalino no se precipite a la cavidad vítrea, durante la aspiración. Debemos de usar el vitrectomo ante la evidencia de vítreo en cámara anterior. Ante la existencia de un cristalino totalmente luxado a vítreo, creemos que lo mejor es proceder a la extracción mediante vitrectomía posterior y facoaspiración con el propio vitrectomo. Recordemos que hasta los 7 años no se puede considerar un ojo maduro en cuanto a sus medidas adultas, por ello, debemos explorar la pars plana previamente a la vitrectomía, para no realizar una rotura retiniana a la hora de realizar las esclerotomías. Las medidas habituales de 3,5-4 mm válidas para el adulto, aquí no son correctas. Respecto a la sutura de una lente en caso de ausencia de saco capsular, creemos que se debe de posponer hasta que se haya estabilizado el crecimiento ocular, por motivos de refracción y para evitar posibles sangrados periódicos en las zonas de sutura que pueden ocurrir según va creciendo la pars plicata. Pienso que las lentes de cámara anterior en estas edades están proscritas, que la mejor solución es una lente de contacto y rehabilitación visual hasta la maduración ocular.
B. Traumatismos contusos del segmento posterior Los mecanismos que producen los traumatismos contusos del segmento posterior, son los mismos que originan las lesiones en el anterior, por efecto golpe, contragolpe y compresión ocular directa (78,79). El golpe produce daño en el sitio del impacto, como se ve en la retinopatía esclopetaria. En el contragolpe, las lesiones ocurren en los tejidos opuestos al punto de impacto, como pasa en la conmoción y contusión retiniana, en las roturas coroideas posteriores o en los agujeros maculares traumáticos. La compresión antero-posterior produce estiramiento ecuatorial, originando tracción sobre la base del vítreo y diálisis retiniana.
Contusión y Conmoción Retiniana son las alteraciones que se originan en la retina por el efecto de contragolpe, es decir, por las ondas de choque, que atraviesan y lesionan el ojo en la zona opuesta al impacto. En 1873, Berlin describió un blanqueamiento retiniano que seguía al traumatismo contuso del globo, en el polo posterior. A este efecto se le comenzó a llamar Edema de Berlin y hoy conocido como Commotio Retinae. Se aprecia una opacificación blanco grisácea de la retina que aparece a las horas del impacto y que contrariamente a lo que se supuso en un principio, no supone un verdadero edema ni intra ni extracelular. Anatomo-patológicamente se aprecia en el momento agudo, una rotura de los segmentos externos de los fotorreceptores, que son fagocitados por las células del Epitelio Pigmentario de la retina, desde las 24 horas siguientes al trauma. Se aprecia así mismo una atrofia y migración de las células del epitelio pigmentario hasta la capa plexiforme interna y ganglionar. Se observa además una alteración de la arquitectura y posición de las células de Müller. No se detecta rotura de la barrera hemato-retiniana ni mediante angiografía, ni mediante fluorofotometría. En sí es de buen pronóstico, suele ceder en 3 ó 4 semanas respetándose la agudeza visual, a no ser que se acompañe de otras lesiones como hemorragias subfoveolares, roturas, obstrucciones vasculares, etc. (figura 11), en cuyo caso no hablaremos de conmoción sino de contusión, lo mismo que si tras su desaparición queda una epiteliopatía pigmentaria macular o periférica (Pseudorretinitis pigmentaria). Si el edema de Berlin es intenso y afecta a la mácula esta tomará aspecto rojo cereza (80).
La rotura coroidea se aprecia con oftalmoscopía indirecta como unas líneas nacaradas tenues que corren por debajo de la retina, normalmente concéntricas al nervio óptico. Se localizan en el lado opuesto al traumatismo (efecto contragolpe) siendo en realidad desgarros de coroides, membrana de Bruch y epitelio pigmentario. Inicialmente puede presentarse una hemorragia subretiniana, por rotura de la coriocapilar, siendo invisible la línea de rotura curvilínea hasta que no se reabsorba la hemorragia (81). La angiografía puede ayudarnos al diagnóstico. La agudeza visual suele afectarse si la rotura interesa la fóvea o si se afecta por una hemorragia. La complicación tardía más importante es la neovascularización coroidea de los márgenes, que puede aparecer en cualquier momento, meses o incluso años después, causando una pérdida de agudeza visual significativa si afecta a la mácula. La fotocoagulación con láser puede ser beneficiosa en estos pacientes (81,82).
La contusión del epitelio pigmentario, produce un edema de las células del mismo, y rotura de la membrana plasmática interna, con posterior atrofia, lo que permite el paso de fluido desde la coroides, y la formación de un desprendimiento seroso neurosensorial suprayacente. Angiográficamente se aprecia una hiperfluorescencia parcheada, que al cabo de los meses da lugar a defectos de transmisión localizados. Puede presentarse también en un trauma contuso una hemorragia vítrea, por sangrado de vasos retinianos, del cuerpo ciliar, o de la coroides, asociada o no a rotura retiniana o escleral. En caso de impedirnos la exploración de polo posterior, debemos realizar una ecografía ocular para descartar un desprendimiento de retina asociado. Indicaremos reposo en posición semisentada del paciente.
La coriorretinitis esclopetaria ocurre cuando un proyectil a gran velocidad, golpea o incide tangencialmente sobre el globo. Produce una rotura de la coroides, de la membrana de Bruch, del epitelio pigmentario, y de la retina. Estos tejidos se retraen como una unidad, y dejan visible oftalmoscópicamente la esclera subyacente. En el momento del trauma agudo, puede existir una hemorragia intrarretiniana o subretiniana. El riesgo de desprendimiento agudo de retina es bajo por la fibrosis que ocurre entre retina y coroides, pero requiere un prolongado período de seguimiento al ser una complicación retiniana tardía relativamente frecuente en zonas distantes, por la tracción (83). Un traumatismo contuso violento puede romper la esclera y por tanto el globo ocular. Los ojos no operados previamente de cataratas, queratotomía radial, o queratoplastia penetrante, rompen por las zonas más débiles de la esclera: el limbo, la inserción de los rectos y la salida del nervio óptico. Debemos sospechar una rotura escleral, ante una severa disminución de agudeza visual con defecto pupilar aferente, cámara anterior profunda, limitación de los movimientos oculares, quémosis, hiphema, hipotonía o hemorragia vítrea. El pronóstico visual es malo. En el 6% de los traumatismos contusos aparece un agujero macular (84) (figura 12). El vítreo está firmemente adherido a la retina en la fóvea, y una separación repentina de la hialoides posterior puede originar en ella, una dehiscencia del tejido retiniano. Por otro lado, puede aparecer un agujero macular lentamente, como resultado del edema macular cistoideo, inducido por el trauma, el quiste puede coalescer y romperse en sus dos capas interna y externa, originando un agujero. Como síntomas el paciente refiere un escotoma central con pérdida de agudeza visual. Se diferencian de los agujeros maculares idiopáticos en el tamaño, los espontáneos son normalmente de 300-500 micras de diámetro 1/5 a 1/3 de diámetro papilar, normalmente los traumáticos son más grandes y con una copa perifoveolar de fluido sub-retiniano. En la angiografía aparece un efecto ventana que corresponde al agujero macular. Normalmente no desemboca en un desprendimiento de retina. El tratamiento es una vitrectomía con intercambio liquido-gas usando C3F8.
Desprendimiento de retina traumático y lesiones asociadas. La mayoría de los desprendimientos en niños son por traumatismos. Los traumatismos son responsables de hasta un 35% de los desprendimientos de retina y son los de tipo contuso en un 74% a 86%. Mayoritariamente afectan a jóvenes, siendo en 3/4 partes varones, al verse estos involucrados con mayor frecuencia en peleas y deportes de contacto. Como mecanismo patogénico tenemos que señalar la formación de una rotura retiniana debida a contusión directa o como tracción vitreorretiniana por expansión lateral ecuatorial al producirse un mecanismo de compresión antero-posterior del globo. También puede ocurrir una sinéresis vítrea, inmediata o en los meses siguientes. Normalmente suele romperse con mayor frecuencia en áreas de adhesión vítreorretiniana firme, como en la fóvea, en degeneraciones en reja, en zonas cicatriciales y en la base del vítreo. Un hecho diferencial de los jóvenes es que los desprendimientos progresan lentamente al tener un vítreo muy espeso, originando líneas de demarcación, atrofias del epitelio pigmentario, quistes etc... Existen unas lesiones asociadas al desprendimiento retiniano traumático (85):
La avulsión de la base del vítreo, a nivel de la pars plana y retina periférica, es patognomónica de un traumatismo contuso ocular. Puede encontrarse de una forma aislada o asociado a un desgarro gigante o a una diálisis retiniana. Se describe en más de un 26% de los pacientes con desprendimiento de retina traumático. Oftalmoscópicamente se aprecia una banda elevada sobre la retina periférica. Cuando se afectan los cuadrantes superiores, la banda puede verse sobre la retina medio periférica. Fragmentos del epitelio de la pars plana, se pueden ver en ocasiones sobre la base del vítreo. El tratamiento consiste en vigilancia y tratamiento de posibles roturas de la retina o lesiones predisponentes (85,86).
Diálisis retiniana. Este término hace referencia a la desinserción de la retina en la ora serrata; puede darse con o sin desprendimiento de retina asociado, éste suele ser bastante estable, poco elevado, progresa de forma lenta al impedir la base del vítreo la incorporación de líquido detrás de la retina, y suelen existir signos de desprendimiento crónico, como líneas de demarcación. El tratamiento es la cirugía escleral, apoyando con un implante toda la diálisis (85).
Desgarro retiniano. Como consecuencia de un traumatismo fuerte, el vítreo tira violentamente de la retina, produciendo en las zonas de mayor adherencia, como las degeneraciones en reja, desgarros en herradura, o redondos con el opérculo flotando encima.. El vítreo tira del opérculo o de los bordes del desgarro, favoreciendo la entrada de líquido por la rotura, y produciendo un desprendimiento limitado. Los pacientes jóvenes al ser tan denso el vítreo, hacen desprendimientos loco regionales. El tratamiento pasa por la fotocoagulación de los desgarros y si es necesario la cirugía escleral apoyando y criocoagulando las roturas (85).
Desgarro retiniano gigante. Son roturas retinianas circunferenciales que se extienden más allá de 3 ó 4 horas de reloj. Ocurren en el borde posterior de la base del vítreo y suelen acompañarse de grandes desprendimientos de retina al disecarlo con facilidad el líquido subretiniano (figura 13). Cursan con una gran tendencia del borde libre a enrollarse, y conducen rápidamente a la vítreo-retinopatía proliferativa, por lo que se recomienda como mejor tratamiento, la vitrectomía vía pars plana con intercambio líquido gas, o el uso de perfluorfenantreno, mantenido en la cavidad vítrea hasta que pigmente el láser (85).
Como consecuencia de los traumatismos contusos, también podemos encontrar lesiones en el nervio óptico. Este se puede afectar por compresión, debido a hemorragia o edema dentro de su propia vaina, daño directo por onda de choque, contragolpe, o sufrir una avulsión total o parcial (87). La lesión más grave es la avulsión o arrancamiento del nervio, que se puede producir por rotación externa y desplazamiento anterior del globo, o por un aumento súbito de la presión intraocular, que cause la ruptura de la lámina cribosa; puede acompañarse con una hemorragia intraocular, que a veces es masiva. En ocasiones, la atrofia del nervio óptico sobreviene como consecuencia de una rotura coroidea traumática, sin estar muy claro el mecanismo que lo produce (88). Según el grado de daño nervioso, será la pérdida de agudeza visual, pudiendo llegar a la ausencia de percepción luminosa. Como tratamiento, los corticoides a altas dosis, pueden disminuir la inflamación y por tanto el edema, que comprime fibras nerviosas, aunque esto no siempre es efectivo.
4. TRAUMATISMOS SISTÉMICOS CON REPERCUSIÓN OCULAR Existe una variedad de traumatismos sistémicos que pueden indirectamente afectar al ojo. Entre estos síndromes incluimos un cuadro que es típico de la infancia, aunque en esta edad puede darse también cualquiera de los que ocurren en los adultos, aunque algunos de ellos sean muy raros.
A. Síndrome del niño zarandeado El Síndrome del Niño Zarandeado es el resultado de una forma de maltrato infantil, y se refiere al conjunto de daños no accidentales que aparecen en los niños como consecuencia de haber sufrido sacudidas violentas. La víctima típica es un varón con menos de 6 meses de edad o 1 año (según los autores) que se encuentra sólo con el agresor cuando se produce el maltrato. La incidencia en Estados Unidos es de 50.000 casos al año, siendo el porcentaje de mortalidad del 25%. Las lesiones características son: hemorragias intracraneales, hemorragias intraoculares y fracturas de costillas o huesos largos (89,90). La cabeza del niño representa un 10% de su volumen y peso total. Los músculos que sujetan la cabeza son débiles y el control nervioso es pobre. Durante las sacudidas la cabeza experimenta aceleraciones y deceleraciones bruscas que producen cizallamiento y contusiones en un cerebro todavía poco mielinizado. Investigaciones recientes sugieren que para que se desarrollen aceleraciones angulares lo suficientemente grandes como para producir lesiones es necesario que haya, además de sacudidas, impactos directos sobre la cabeza (91-94). Estos niños desarrollan pequeños desgarros contusionales en los lóbulos occipital y frontal, así como hemorragias subdurales y daño axonal difuso. Es frecuente que queden secuelas en forma de atrofia cerebral, con retraso mental y del desarrollo. Clínicamente se suele presentar con hipotermia, letargia, bradicardia, vómitos, convulsiones, alteraciones respiratorias y coma. Es muy característico el desarrollo de hemorragias intraoculares que pueden ser el resultado, bien de una compresión del tórax como en la retinopatía de Purtschner, o bien de una hipertensión intracraneal por las hemorragias y el edema (91,95,96) (figura 14).
El cuadro oftalmológico es variable, siendo lo más habitual las hemorragias intrarretinianas, que pueden afectar a todas las capas de la retina y al vítreo; pueden ser uni o bilaterales y aparecen en el 50-80% de los niños. Estas hemorragias suelen tardar meses en resolverse, a diferencia de las que se producen durante el parto, que se reabsorben rápidamente (92,97). Asimismo se han descrito hemorragias retinianas de centro blanco, similares a las manchas de Roth, que se cree son debidas a una isquemia retiniana con infarto de la capa de fibras nerviosas (98). También pueden aparecer quistes retinianos rellenos de sangre, existiendo la posibilidad de que se desarrolle una retinosquisis cuando la sangre se reabsorba. Son característicos, pero no patognomónicos, pliegues retinianos concéntricos, que se forman por fuera de las arcadas vasculares maculares debido a la tracción vítrea (92,99). Es menos frecuente la aparición de hemorragias en la vaina del nervio óptico. El diagnóstico del síndrome es difícil debido, por un lado, a la escasez de signos externos, y por otro, a que los padres o el cuidador raras veces admiten haber maltratado al niño. Por ello, ante la sospecha de maltrato infantil, es fundamental realizar un examen de la retina y un TAC y/o RMN cerebral (91,92,100). Cabe destacar que el examen oftalmológico puede predecir el daño neurológico, ya que se ha encontrado correlación entre la severidad de la hemorragia retiniana (afectación retiniana difusa, hemorragia vítrea o extensas hemorragias subhialoideas) y el pronóstico de las lesiones cerebrales (100-105). La ceguera, el retraso mental y la muerte, son secuelas comunes en este síndrome. La muerte suele ocurrir en muchos casos asociada a aumento incontrolado de la presión intracraneal. Las causas más frecuentes de pérdida de visión son los pliegues maculares y las lesiones corticales (106,107). El diagnóstico diferencial incluye: traumatismos durante el parto, alteraciones hematológicas como anemia severa, trombocitopenia, leucemia aguda y coagulopatías y hemorragias tras la resucitación cardiopulmonar (98). Es fundamental, ante la sospecha de este síndrome, dar parte a las autoridades competentes para que se hagan cargo del niño. El tratamiento general incluye la estabilización del niño y el tratamiento médico y/o quirúrgico de posibles fracturas y lesiones cerebrales (92). Hasta hace poco el tratamiento oftalmológico se limitaba a la observación o a la realización de una vitrectomía, pero se ha comprobado que muchos de los ojos que únicamente se observan desarrollan ambliopía. Por tanto, recientemente se ha propuesto, como método alternativo en el caso de hemorragias prerretinianas subhialoideas maculares, la inyección de rtPA intravítreo (una inyección a la semana durante tres semanas de 12,5-25mg de rtPA), seguido de la inyección de un gas expansivo (0,25 cc de SF6), obteniéndose como resultado, la resolución completa de la hemorragia en la semana siguiente a la administración de la última inyección de rtPA, sin que se hayan observado otras complicaciones oftalmológicas (97).
B. Retinopatía de Purtscher Purtscher describió lesiones retinianas asociadas a traumatismos craneales severos, como los que ocurren en un accidente, que incluían, parches blancos superficiales retinianos, hemorragias intrarretinianas y papilitis. Se producen en traumatismos severos cráneo-encefálicos en ausencia de daño ocular directo. Esta misma exploración de fondo de ojo, aparece en otro grupo de enfermedades sistémicas, lesiones que en muchos casos no se diferencian de las traumáticas, por ejemplo, en la pancreatitis o la fractura de huesos largos. Suele ser bilateral aunque también se describen casos unilaterales. Los hallazgos oftalmológicos pueden aparecer inmediatamente o a lo largo de las primeras 48 horas después del traumatismo. La agudeza visual es variable, de contar dedos a la unidad, según el caso. La evolución es impredecible, pueden desaparecer sin más las lesiones, quedar simples cambios pigmentarios en la mácula, o producir una atrofia óptica. No existe tratamiento para esta patología. La patogenia se atribuye a múltiples embolismos. Por ello, en patologías que producen embolismos (grasos) como en la pancreatitis, o en la fractura de huesos largos, se ven lesiones similares (108-112).
C. Síndrome de Terson En los niños este síndrome se asocia a traumatismos craneales con hemorragias subdurales, no como en los adultos que también y mayoritariamente se asocian a hemorragias subaracnoi deas asociadas a rotura de aneurismas. Los hallazgos de fondo de ojo incluyen, hemorragia vítrea en la mayoría de los casos, también pueden encontrarse hemorragias peripapilares, prerretinianas, intrarretinianas, o subretinianas. Puede ser uni o bilateral. El rango de agudeza visual oscila de percepción de luz, con hemorragia ma siva, a la unidad. Del mismo modo el tratamiento incluye, desde la simple observación a la vitrectomía. En los niños muchos autores se inclinan por la vitrectomía, ya que una pérdida prolongada de agudeza visual en un ojo, puede conducir a una ambliopía en el futuro. En cuanto a la patogenia, la teoría más aceptada, es que la hemorragia intracraneal produce un cambio agudo de presiones, que se transmite por el nervio óptico al sistema de drenaje venoso ocular, produciendo la distensión y ruptura de capilares finos peripapilares y retinianos, originando una gran hemorragia (109-111).
D. Retinopatía de Valsalva En los niños lo veremos asociado a esfuerzos del vómito o durante el acto de toser, aunque es muy raro. En adultos se ve en levantamiento de grandes pesos, en el acto sexual, etc... Se produce por un aumento brusco de la presión intratorácica e intrabdominal con la glotis cerrada. Si esta presión se transmite al sistema venoso ocular, por ser incompetentes las valvas en el sistema venoso, se puede producir una ruptura de capilares retinianos superficiales, produciendo una hemorragia retiniana. La sangre suele acumularse en la región foveolar o parafoveolar, o como hemorragias prerretinianas grandes u ovales en la mácula. La sangre normalmente se acumula en la limitante interna, aunque puede pasar al espacio subhialoideo o a la cavidad vítrea. El tratamiento consiste en la observación, normalmente las hemorragias se reabsorben y se recupera la visión (109,115).
E. Retinopatía en latigazo Más frecuente en los niños que en los adultos, se produce por una flexo-extensión forzada de la cabeza y el cuello debida generalmente a un accidente de circulación. En los niños la cabeza supone un 10% del peso corporal y ante una deceleración brusca, se produce, dado a que los músculos del cuello del niño son poco poderosos, un movimiento brusco de la cabeza en latigazo. Por ello se recomienda llevar a los niños pequeños sentados en los coches, en contra a la dirección de la marcha. En el fondo de ojo vemos una inflamación grisácea, transitoria de la fóvea, con una diminuta foseta foveolar persistente (50-100 micras) de límites bien definidos, idéntica a la que aparece en la retinopatía por quemadura solar. La agudeza visual no suele disminuir de forma importante y suele ser reversible. Parece que su patogenia se centra en una destrucción selectiva de fotorreceptores centrales (109).
5. CUERPOS EXTRAÑOS INTRAOCULARES EN LA INFANCIA A. Etiología En la mayoría de los estudios los CEIO suelen ser partículas metálicas. En los niños, las agudezas visuales después del traumatismo iguales o inferiores a 5/100, alcanzan un 70% de los casos, frente al 20% en los adultos (116,117), y ello es debido a una mayor incidencia de desprendimiento de retina, hiphema y prolapso uveal, en los pequeños. Williams y col, publicaron una serie de artículos, en los que ponen de manifiesto que en Estados Unidos, la causa más frecuente de cuerpos extraños intraoculares en pacientes menores de 18 años, son los proyectiles por arma de fuego o explosiones (60%), y en los adultos por martilleo sobre estructuras metálicas (84%). A su vez Williams determinó dos parámetros predictivos positivos de una buena recuperación visual: por un lado, que no sea necesaria realizar más de una o dos intervenciones, y por otro lado una agudeza visual inicial mejor de 20/40. Así mismo los factores predictivos negativos de una buena recuperación visual son, CEIO de 4 mm o mayores, localización desconocida, y agudezas visuales inferiores a 5/200. Si comparamos la incidencia de enucleaciones de esta publicación de Williams, con otras anteriores a la llegada de la microcirugía ocular, observamos que han disminuido, aunque el número de pacientes con visiones finales de 20/40 suele ser el mismo. El pronóstico de lesiones perforantes ocasionadas por pistolas de aire es el más pobre en estas series. En un artículo reciente Jost nos habla en unos términos parecidos a los de Williams (138,139). De Souza, nos cuenta su experiencia de 14 años trabajando en cuerpos extraños intraoculares; encontró desprendimiento de retina en un 41% de los casos y endoftalmitis en un 17% de los casos. La incidencia pediátrica de su serie fue escasa (118). Finkelstein entre otras cosas nos relata, como la mayoría de sus pacientes fueron varones, con edades comprendidas entre los 11 y 30 años (119). Mackay y Duke-Elder, nos describen la localización de los cuerpos extraños intraoculares, la cual va a determinar las manifestaciones clínicas. El 32% de los CEIO se localizan en el segmento anterior, 15% de los CEIO magnéticos se localizan en la cámara anterior y un 8% en el cristalino. Un 70% se localizan en el segmento posterior, y un 7% en la órbita como resultado de doble perforación ocular y alojamiento orbitario. Las últimas estadísticas que hablan de agudezas visuales finales, las señalan en un 20/40 o mejores en el 60%, y en 5/200 o mejores en un 86% de los ojos. Antes de la llegada de la cirugía vitreorretiniana, los CEIO magnéticos tenían mejor pronóstico que los no magnéticos. Con la llegada de las pinzas de cuerpos extraños, es posible una extracción controlada de todo tipo de CEIO. Otros autores como Pavlovic, inciden sobre este mismo tema: el tamaño de la lesión y del cuerpo extraño, son los factores pronósticos más importantes a la hora de predecir la función visual final (120), Tomic Z y Karel, nos presentan en sus artículos estadísticas a nivel europeo (121,122).
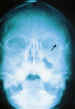
B. Historia clínica y exploración La historia clínica, en muchas ocasiones puede revelarnos la composición probable del CEIO y el riesgo relativo de infecciones post traumáticas. La obtención de muestras del material sospechoso, nos servirán para determinar su toxicidad y sus propiedades magnéticas. En ojos con medios transparentes, la composición, el tamaño y la localización pueden conocerse mediante oftalmoscopía indirecta. En ojos con medios opacos, son necesarias otras pruebas para determinar sus características. En los niños si no colaboran, es necesario dormir al paciente para poder realizar las pruebas necesarias que a continuación se detallan: La utilización de Rayos X (figura 15) con proyecciones Caldwell, Waters, o las antero-posteriores pueden demostrarnos la presencia, pero no la localización, de un CEIO radiopaco y no detectará CEIO radiotransparentes, como la madera o el cristal. La ecografía nos ofrece una mejor localización del CEIO y es esencial para obtener información acerca de otros cambios estructurales como desprendimientos de retina o coroides. Al realizar esta exploración, han de tomarse precauciones para no comprimir el globo, sobretodo en los que presentan grandes heridas, y no producir prolapsos adicionales de su contenido. La ecografía con un estudio sistemático, con abordaje transversal y longitudinal puede determinar la localización del CEIO. La ultrasonografía biomicroscópica nos aporta algo más a la hora de diagnosticar cuerpos extraños ocultos o de polo anterior (123-125). La tomografía computerizada (TC) es el método diagnóstico de elección porque localiza y detecta CEIO radiopacos y radiotransparentes en 3 dimensiones. La TC tiene ciertas limitaciones y los CEIO metálicos crean artefactos significativos, que pueden dificultar la localización exacta. Esto puede ser un inconveniente a la hora de determinar si la localización de un CEIO es intrarretiniana o intraescleral. Asímismo la TC puede presentar problemas a la hora de identificar algunos CEIO de baja densidad, como la madera. Chacko, nos presenta en su artículo una interesante comparación entre la Tomografía Computerizada clásica (figura 16) y el TAC helicoidal (figura 17), demostrándose esta última más eficaz para la localización espacial de cuerpos extraños intraoculares o intraorbitarios (126).
La resonancia magnética es una técnica diagnóstica, que se ha usado con éxito para el diagnóstico y localización de tumores y lesiones diversas, pero debido a que se utilizan campos magnéticos fuertes para estimular al de los átomos, los CEIO se pueden desplazar incontroladamente, como demostró Lagouros, con partículas ferromagnéticas en la cavidad vítrea del conejo; la RM está pues contraindicada (127,128). Después de determinar, si la edad del niño nos lo permite, la agudeza visual, es importante realizar un examen externo del ojo. Para realizar la exploración a veces es necesario utilizar, con extremo cuidado, un separador de párpados, para poder visualizar el globo. En casos en los que tengamos una alta sospecha de existencia de un CEIO, con pacientes poco colaboradores, niños o adolescentes intoxicados, puede ser necesario un examen bajo anestesia, pudiendo realizarse una exploración reparadora en el mismo acto. Ocasionalmente una ruptura escleral puede quedar oculta, bajo la conjuntiva, cápsula de Tenon o los músculos rectos. Quémosis o una hemorragia subconjuntival pueden ser sugestivos de la existencia de una ruptura oculta. Una PIO baja nos hará sospechar una ruptura escleral, pero una PIO normal o elevada, no lo descarta. La exploración del vítreo anterior con lámpara de hendidura, puede mostrarnos bandas vítreas hacia un posible punto de ruptura. También es importante determinar la presencia de infecciones intraoculares en el momento de la evaluación inicial. La endoftalmitis es una complicación devastadora de los CEIO y su pronóstico está en función de varios factores, incluyendo lo precozmente que sea detectada. Todos los pacientes con cuerpos extraños, deben ser tratados inmediatamente con antibióticos de amplio espectro. El cuerpo extraño debe ser cultivado después de extraído y deben administrarse antibióticos I.V. al menos hasta 2 días después de extraídos, recomendamos 5 días (utilizamos salvo contraindicación, Vancomicina y Ceftacidima a dosis pediátrica). Así mismo, si no podemos realizar la cirugía en poco tiempo, podemos intentar evitar la infección, con inyecciones intravítreas de Vancomicina y Ceftacidima. Durante la cirugía en el líquido de la infusión, diluimos Vancomicina y Gentamicina (129,130,131). El deterioro producido en el ojo por el CEIO, depende sobre todo, de factores inflamatorios, mecánicos y tóxicos. El factor mecánico viene determinado por el tamaño y velocidad del CEIO (cuanto más grande más destruye, cuanto más veloz más penetra), y por los tejidos intraoculares lesionados (cuanto más noble peor pronóstico). Algunos CEIO son considerados inertes, como cristal, plástico, oro, plata, platino y aluminio. Producen un daño pequeño continuado. El zinc produce una inflamación media no granulomatosa. En cualquier caso, los CEIO inertes son capaces de producir una reacción inflamatoria local en el ojo. Los CEIO en el vítreo, tienden a producir licuefacción localizada del mismo, en contacto con el cuerpo ciliar, originan una iridociclitis reactiva, y localizados en el ángulo de la cámara anterior, pueden causar edema corneal localizado o progresivo, y glaucoma. El CEIO más frecuente es el metálico, y su material con mayor frecuencia es el hierro, siguiéndole en frecuencia el cobre. Los dos producen reacciones tóxicas graves dentro del ojo, que pueden terminar en la ceguera, si no se extraen con prontitud. El hierro produce siderosis y el cobre calcosis. Siderosis: su grado y extensión dependerá por una parte del contenido férrico del cuerpo extraño, del tiempo de permanencia dentro del ojo, de su tamaño y de su forma. Los CEIO irregulares, tienden a corroerse más rápidamente que los regulares, y los pequeños se oxidan completamente antes que los grandes; por ello los irregulares y grandes son los más peligrosos. El hierro tiene una gran afinidad por el epitelio pigmentario de la retina, siendo la parte de ella que primero se afecta. Las células del epitelio pigmentario, incorporan hierro y sufren una migración perivascular, produciendo una imagen que recuerda a la retinosis pigmentaria y que es responsable de la retracción concéntrica del campo visual que se afecta primeramente. Posteriormente, se van afectando el resto de las capas de la retina hasta que, en estadíos avanzados, su arquitectura normal sustituida por células gliales. La mácula puede presentar depósitos de hierro y a veces degeneración quística. En el iris, la afectación epitelial y muscular produce, por una parte, una coloración marronácea del mismo que puede terminar en heterocromía, y por otra una midriasis y un reflejo fotomotor lento. En estadíos avanzados el iris se vuelve atrófico. El hierro se deposita en el cristalino, primero en la cápsula y después en las células epiteliales subcapsulares. Clínicamente, esto se manifiesta como unos puntos marrones en la cápsula anterior del cristalino. Posteriormente ocurre una completa opacificación del cristalino. El hierro reacciona con el ácido hialurónico produciendo licuefacción del vítreo. En estadíos finales la siderosis cursa con glaucoma absoluto y panuveítis. Los ojos con CEIO retenidos de hierro o acero, necesitan un campo visual, test de adaptación a la oscuridad y ERG cada 3-4 meses (132). Calcosis: el cobre es el metal más frecuente encontrado en CEIO no magnéticos, y él mismo o los metales que lo contienen como el bronce, pueden causar calcosis. El cobre tiene una especial afinidad por las membranas basales de ciertas estructuras oculares. Así la afectación de la membrana de Descement produce el anillo de Kayser-Fleischer en la córnea, que aparece clínicamente como un anillo verde azulado periférico. Los depósitos en la cápsula del cristalino producen una catarata en girasol marrón verdosa. También se han encontrado depósitos cúpricos en la membrana limitante interna de la retina y en su tejido glial intrarretiniano. La mayor localización extracelular del cobre, puede explicar porque los cambios oculares en la calcosis son más reversibles después de extraer tardíamente los CEIO, que los cambios en la siderosis, en la cual el hierro se deposita intracelularmente. A diferencia de los CEIO que contienen hierro, se han encontrado CEIO, que contienen cobre, que han permanecido durante años dentro del ojo sin producir calcosis, bien por la formación de una cápsula fibrosa alrededor de él, que limitaría la evolución hacia la calcosis o bien por la reabsorción espontánea del CEIO. Además de los cambios que ocurren en la calcosis, CEIO con alto contenido de cobre, producen una reacción inflamatoria severa, con hipopion y un absceso estéril. A diferencia de la calcosis la reacción inflamatoria ocurre inmediatamente después de la agresión y precisa la extracción inmediata del CEIO. La toxicidad del CEIO de contenido cúprico, viene determinada por la concentración de este elemento. Metales con menos de un 70% de cobre son relativamente inertes; entre 70-90% producen calcosis, y entre 90-100% una reacción inflamatoria aguda (figura 18).
Cambios en el ERG En ambas, calcosis y siderosis, existen cambios en el ERG, antes de que se puedan apreciar daños oculares. El ERG es muy importante a la hora de documentar la severidad y reversibilidad de cambios retinianos causados por CEIO reactivos, así como para el seguimiento de pacientes con CEIO retenidos. Las alteraciones ERG en la metalosis consisten en cambios en la amplitud de las ondas, los tiempos de respuesta no cambian. Se describen 4 patrones de ERG en la metalosis: normal, negativo-plus, negativo-minor y no recuperable. Los cambios ERG son reversibles si los CEIO se extraen en el segundo estadío. Los cambios son irreversibles en los últimos 2 esta díos, e indican un daño permanente en la retina. En el estadío negativo-plus tiene una onda B-normal y una onda A anormalmente aumentada. Por el contrario, en el estadio negativo minor encontramos una onda A normal o aumentada, y una onda B anormalmente reducida. Los periodos de latencia más cortos para que ocurran los cambios en el ERG descritos, son de 12 días para el cobre y 1 mes para el hierro (132). La espectrometría de RX es un test no invasivo prometedor, que es capaz de detectar la disolución del cobre antes de que ocurran los cambios en el ERG. Este con frecuencia permanece inalterable una vez extraído el CEIO, lo que indica un daño permanente en el ojo. La espectrometría de rayos X es capaz de detectar cambios, antes de ocurrir modificaciones estructurales y es más sensible que el ERG.
C. Tratamiento Si el CEIO se recibe en un centro médico con medios adecuados, se realizará directamente la cirugía para su extracción. Si esto no es posible, efectuaremos un primer cierre de las roturas oculares y protección antibiótica, remitiendo después al paciente con carácter de urgencia, a un centro preparado para la realización de una cirugía ocular pediátrica. Los cuerpos extraños del segmento anterior son, con frecuencia, fáciles de extraer. Los que se encuentren en el estroma de la córnea, deben ser extraídos, actuando directamente sobre él con una aguja, hasta que se exponga. Muchos cuerpos extraños magnéticos corneales, pueden ser eliminados mediante un imán o con unas pinzas. Cuando el cuerpo extraño se sitúa en el estroma profundo o protruyendo a través de la membrana de Descement, pueden ser extraídos a través de la cámara anterior por una incisión limbar. Los cuerpos extraños magnéticos que se sitúen en la cámara anterior o en el iris pueden ser eliminados a través de una incisión limbar, con un electroimán o con una pinza, a ser posible con la pupila en miosis (133). El manejo de pequeños CEIO magnéticos situados intralenticularmente, sin que existan cambios en el cristalino que afecten a la visión, es controvertido. Se ha demostrado la existencia de pequeños CEIO magnéticos que estuvieron dentro del cristalino por un largo período de tiempo sin asociarse a daño ocular, aunque lo normal es que con el tiempo desarrollen una catarata. Los CEIO magnéticos menores de 2 mm, pueden ser eliminados directamente con un imán. No todos los cuerpos extraños intra cristalininanos deben ser eliminados. Si es un cuerpo extraño inerte como el cristal, y no se asocia con cambios cataratosos, se podría dejar, ya que removerlos puede ser peor. El manejo de CEIO no magnéticos en el segmento posterior, también es objeto de controversia. Muchos cirujanos defienden la extracción de todos los cuerpos no magnéticos, ya que el no hacerlo, puede significar un grave perjuicio para el ojo. Si el material es inerte, podríamos dejarlo, siempre y cuando no existan daños estructurales que nos obliguen a realizar una vitrectomía. Si tenemos que hacer una vitrectomía, lo normal sería sacar el cuerpo extraño, sea cual sea la composición del mismo. Si el cuerpo extraño no es inerte, deberíamos proceder a su extracción, aunque los daños estructurales no requieran intervención quirúrgica. A la hora de plantearnos una vitrectomía en la edad pediátrica, debemos de recordar las peculiaridades de esta cirugía, que se describe en el capítulo correspondiente. Hemos de marcar donde esta la ora serrata, si la visibilidad nos lo permite, para realizar después las esclerotomías por delante de ella, ya que no nos sirve la misma norma de medida, que para los adultos. En cuanto al instrumental específico de este tipo de vitrectomía, en primer lugar tenemos las pinzas para la extracción de cuerpos extraños, con una capacidad prensil mayor que las normales y también los electroimanes para uso intraocular. También contamos con electroimanes externos clásicos. Los electroimanes clásicos pueden inducir al CEIO una gran velocidad, y si está mal alineado, puede producir graves daños en lo tejidos oculares. El electroimán tiene como inconveniente que es grande y pesado, por lo tanto engorroso de manejar cuando son CEIO de difícil acceso (133). Cuando los medios no son del todo transparentes a veces es preciso usar la oftalmoscopía indirecta para la extracción y si esto no es posible, encontramos una de las escasas aplicaciones en las cuales estaría indicado usar un endoscopio ocular. El endoscopio ocular requiere gran habilidad y no está al alcance de todos, aunque es ideal cuando existen medios opacos (figura 19).
Personalmente prefiero realizar una vitrectomía 3 vías con lentes de campo amplio, usando siempre el sistema de control de presión intraocular que nos brindan los vitrectomos modernos, para poder controlar mejor posibles hemorragias en el transcurso de la cirugía. La vitrectomía me gusta hacerla lo más completa posible y extraer el cuerpo extraño usando las pinzas. Procuro cogerlo longitudinalmente, evitando que golpee contra la retina y por ello no elimino todo el vítreo subyacente, para mantener un colchón vítreo entre la retina y el CEIO que impida el contacto. Después se extrae por pars plana, previa apertura suficiente de la esclerotomía (figura 20) para evitar que el cuerpo extraño se suelte de la pinza, y quede en la base del vítreo o caiga a polo posterior impactando contra la retina. La ampliación de la incisión la haremos paralela al limbo siempre en pars plana y una vez extraído el CEIO, procederemos a su sutura con Vycril de 7-0. Cuando el CEIO lleva tiempo y se encuentra encapsulado y adherido, la cápsula fibrosa debe ser cortada con unas tijeras de vitrectomía, evitando cualquier tracción sobre la retina. Las roturas retinianas que puedan encontrarse deben tratarse mediante endofoto coagulación y posterior intercambio líquido aire, SF6 o C3F8 gas al 20% y 12,5% respectivamente (134-137).
Si el CEIO se encuentra alojado intraescleralmente, pienso que lo mejor sería sacarlo por vía externa a la esclera, si es necesario ayudándonos con el electroimán, siempre y cuando sea accesible por vía orbitaria. Si fuera necesario por daños estructurales completaríamos la cirugía con una vitrectomía para reparar estructuras internas. Si está situado intrarretinianamente, en los casos en que la rotura retiniana sea suficientemente grande y se sitúe cerca de ella, puede ser menos traumático la extracción mediante electroimán. Si no está cerca de ella o pensamos que la rotura retiniana es insuficiente, podemos realizar una retinotomía para la extracción y usar pinzas. Al finalizar se cierran las esclerotomías y se mantienen los antibióticos parenterales al menos 2 días. En los niños terminamos la cirugía con inyecciones subtenonianas de esteroides, para contrarrestar la mayor tendencia a la inflamación que desarrollan (135,136) (figura 21).
6. QUEMADURAS Y CAUSTICACIONES EN LA EDAD PEDIÁTRICA Los niños son especialmente propensos a los accidentes domésticos, al desconocer el contenido de los recipientes que pueden estar a su alcance, así como las consecuencias de su mal uso (140). Las lesiones por productos químicos y las quemaduras pueden variar mucho en su gravedad, desde una simple desepitelización corneal hasta una lisis de todos los tejidos por una quemadura grave por álcalis (figura 22). Lo que todos los autores se ponen de acuerdo en comentar, es que la prevención puede aplicarse en la mayoría de los accidentes y que una correcta manipulación del paciente, nada más ocurrido el accidente, mejora el pronóstico visual final.
No existe un buen tratamiento para quemaduras severas por álcalis. Los álcalis y algunos ácidos muy fuertes, penetran en el tejido rápidamente, saponifican las membranas celulares, desnaturalizan el tejido, producen una trombosis vascular y destruyen las estructuras oculares dañando irreparablemente la visión. Por el contrario, los ácidos simples, no penetran en los tejidos, sino que producen una precipitación de las proteínas que protegen las capas posteriores del estroma y de la cámara anterior (140). Las quemaduras oculares leves y medias, actúan de una forma parecida, se produce una precipitación de las proteínas de las células epiteliales, induciendo un aspecto de vidrio deslustrado, pero manteniendo trasparente el estroma corneal. Todos los autores señalan lo importante de eliminar el contacto del ácido o álcali sobre los tejidos oculares. La severidad de la lesión ocular está en función de la concentración, del volumen y de la duración del contacto con el tejido. Por ello hemos de proceder al lavado externo del ojo lo más rápidamente posible, no esperando una solución estéril ideal, sino utilizando lo que tengamos más a mano, que en la mayoría de los casos será el agua corriente de un lavabo o fregadero. Debe de realizarse un primer lavado exhaustivo, exponiendo bien los fondos de saco, realizando una eversión palpebral inferior y una doble eversión del superior. El lavado debe ser largo hasta tal punto, que diversos autores indican que deber mantenerse de 30 a 60 minutos para casos graves, hasta neutralizar el pH en los fornix conjuntivales (140,141). Cuando un álcali incide sobre el tejido ocular, se produce un dolor fuerte por estimulación directa de los receptores de la percepción dolorosa, cor neales, conjuntivales, y palpebrales, al que se suma el originado por un aumento súbito de la presión intraocular (consecuencia de una desnaturalización del colágeno), y el que sigue a la descarga de prostaglandinas (142). El estroma cor neal se opacifica y la conjuntiva se blanquea, pasando rápidamente el álcali a través de estas estructuras. Una vez que penetra en la cámara anterior, sube el pH, se lisan las paredes celulares, y se rompe la barrera hemato-acuosa, produciéndose un exudado fibrinoso. Un pH elevado no es compatible con una buena función celular y por ello, el iris, el cuerpo ciliar, la malla trabecular y el cristalino se alteran, produciéndose una combinación de glaucoma, hipotonía, midriasis y catarata (143,144). En función de lo prolongado del contacto, se puede llegar a producir una hipotonía mantenida, que conduce el ojo a la Ptisis Bulbi. Si se lesiona la malla trabecular, pero no el cuerpo ciliar, se producirá un glaucoma. Estos cambios suelen asociarse con una falta de recuperación de la función visual (145). Se está estudiando el uso de ascorbato, para intentar compensar esta serie de mecanismos destructores de las bases (146). Un tema muy importante es la mayor propensión de los tejidos afectos a ser colonizados e infectados por microorganismos; Pramhus, publicó un estudio, en el cual demostraba una mayor tendencia a la infección por Staphylococcus epidermidis, Corynebacterium, S. aureus y sobre todo una gran incidencia de infecciones por Pseudomona aeruginosa 34% (147). Cuando se produce una simple afectación epitelial, suele curarse como cualquier otra abrasión, por migración de células epiteliales desde la conjuntiva adyacente. Si existe una alteración significativa de la conjuntiva, la migración puede retrasarse durante semanas, pudiendo producirse ulceraciones tórpidas e incluso perforaciones oculares. Por ello se recomienda desbridar la conjuntiva afecta y eliminarla, realizando un injerto de conjuntiva. Últimamente algunos autores han propuesto, la realización de un autotransplante por rotación, de la cápsula de Tenon ecuatorial, con lo que se busca el mantenimiento de la vascularización de los tejidos necrótizados por la agresión química, como la conjuntiva o la esclera anterior, y conseguir así, una mayor rapidez en la regeneración tisular. Se ha intentado también el implante de células de Stem conjuntivales para reepitelizar la superficie corneal (146). Además se ha ensayado el transplante de membrana amniótica (149). El tratamiento médico en todos los casos, será la administración de altas dosis de corticoides tópicos o incluso generales, así como colirios o pomadas de atropina y antibióticos. Para marcar el pronóstico de la quemadura por álcalis, se ha propuesto una clasificación en función de las estructuras afectas:
En los grados 3 y 4 el pronóstico visual es muy pobre (150). En los casos más severos es necesario hacer transplantes corneales de urgencia, para intentar mantener la integridad ocular, bien con injertos, o bien con queratoprótesis (151). Indudablemente el tratamiento más efectivo para este tipo de agresiones es la prevención, teniendo muy presente el riesgo que representan los productos de limpieza en el hogar para los niños, tenerlos fuera de su alcance, y mantenerlos siempre cerrados y bajo llave. En algunas series los accidentes domésticos llegan al 37% (152). Otro punto clave es la educación de los niños en las escuelas sobre el riesgo que suponen los distintos productos que existen en un hogar (152-154).
7. PATOLOGÍA NEURO-OFTALMOLÓGICA TRAUMÁTICA EN LA INFANCIA Los traumatismos cráneo-orbitarios pueden originar alteraciones neuro-oftalmológicas desde muy evidentes a sutiles, y en ocasiones determinan secuelas visuales infradiagnosticadas. Dada la relación anatómica entre la órbita y los senos paranasales, quiasma óptico, seno cavernoso y lóbulos cerebrales, cualquier traumatismo orbitario puede dañar estas estructuras complicando su manejo. Por ello es preciso descartar en primer lugar la afectación de estructuras adyacentes con repercusión vital. Por otro lado, un traumatismo que afecte a los senos paranasales introduce un grado de contaminación que puede llevar a una infección ocular y orbitaria. Un traumatismo cráneo-cervical puede causar una pérdida visual o campimétrica secundaria a una lesión en el nervio óptico (NO), quiasma o córtex occipital; pudiendo haber además una disfunción óculo-motora. En este capítulo vamos a tratar únicamente la Neuropatía Óptica Traumática (NOT).
Neuropatía óptica traumática La NOT es una causa poco frecuente, pero a menudo grave de pérdida visual permanente después de un traumatismo craneal. Se considera compleja cuando está asociada a otras lesiones cráneo-orbitarias, y pura cuando resulta de un trauma indirecto al NO.
Mecanismo del trauma Se considera un daño directo al NO el que ocasionan proyectiles u objetos cortantes. La NOT es indirecta cuando se produce como resultado de traumatismos contusos en la cabeza, particularmente en la frente, y constituye con mucho la forma más frecuente (figura 23).
Cada uno de los cuatro segmentos en que se considera dividido el NO está predispuesto a sufrir diferente tipo de daño, directo o indirecto:
Diagnóstico Un paciente con una NOT puede presentarse con una súbita pérdida visual total, o con un leve descenso en la agudeza visual (AV) y un defecto en el campo visual. AV: si su estado de conciencia lo permite, la exploración debe comenzar valorando la mejor visión posible bajo las circunstancias en que el paciente es examinado. Si la falta de visión es desproporcionada al daño aparente, debemos sospechar una posible NOT. Reflejos pupilares: debemos buscar un posible Defecto Pupilar Aferente Relativo (DPAR), pues se considera el «sine qua non» de una disfunción del NO. Para ello se hace mirar al paciente a un punto distante, poniendo una luz frente al ojo no traumatizado. Ambas pupilas deben contraerse enérgicamente por la reacción pupilar directa y consensual. La luz se pasa entonces al ojo lesionado y si las pupilas se dilatan es que existe un DPAR y debemos sospechar un daño en el NO. El estado de excitación del niño hace con frecuencia que las pupilas estén más dilatadas y respondan menos a la luz, lo que ha de tenerse presente en la exploración. Del mismo modo hay que considerar que las pupilas de los preescolares son más pequeñas y las de los prematuros hiporreactivas. Es importante dirigir la luz con el mismo ángulo dentro de las pupilas y descartar cualquier opacidad aguda en los medios como causa del DPAR. Incluso con una pérdida visual total unilateral por una disfunción del NO, bajo igual iluminación las pupilas aparecerán con igual tamaño. Pero a veces el propio traumatismo hace que la pupila afectada esté dilatada por una disfunción pupilar eferente simultánea. Entonces debemos buscar un defecto pupilar aferente relativo inverso, en el cual cuando la luz es dirigida al ojo traumatizado (con midriasis), la pupila en el otro ojo se dilata, pero cuando iluminamos el ojo normal, su pupila se contrae enérgicamente permaneciendo dilatada la del ojo lesionado (por el daño eferente). La exploración pupilar permite diferenciar entre daño en el NO o quiasma y daño en el córtex occipital. Si hay daño en el NO o quiasma habrá anomalías pupilares. Si no encontramos un claro DPAR debemos buscar una disfunción pupilar bilateral (una disociación de las pupilas luz-cerca) que orienta hacia una posible lesión bilateral del NO o en el quiasma. Test de visión del color: para valorar la función del NO en la exploración de urgencias puede ser útil medir la desaturación del rojo. Oftalmoscopía: dependerá del nivel al que esté lesionado el NO. En caso de avulsión del NO el diagnóstico se hace por funduscopia. Si la avulsión es total, veremos un agujero o cavidad donde el disco óptico se ha retraído dentro de su vaina dural. Si la avulsión es parcial, aparecerá la papila parcialmente conservada con hemorragia y edema retiniano alrededor. Con frecuencia el hifema y hemovítreo existentes impiden ver el fondo de ojo. Algunos autores defienden la utilidad diagnóstica en caso de avulsión del NO de la tomografía computarizada (TC) (158,159) y de la ecografía B (160). Otros autores opinan que las técnicas de neuroimagen, la ecografía B y la ultrasonografía doppler no son útiles para establecer el diagnóstico de avulsión del NO (156,171). Cuando la lesión al NO es más posterior, éste y la retina son inicialmente normales y no aparece atrofia óptica hasta tres o cuatro semanas después. Se ha descrito edema del disco óptico de larga evolución secundario a traumatismos contusos (161).
Pruebas complementarias: Puede ser útil realizar una campimetría, si el estado del paciente lo permite. En este sentido, antes de los 7-8 años de edad no resulta posible realizar una adecuada campimetría instrumental por lo que debe intentarse mediante técnicas de confrontación y atracción. Si el paciente está bajo los efectos mióticos de algún analgésico opiáceo, no pudiendo explorar los reflejos pupilares, resulta útil valorar los potenciales evocados visuales (PEV) con un aparato portátil. Existe una buena correlación entre PEV en pacientes comatosos traumatizados y su tardía función visual (162). La radiografía simple no debe considerarse de elección a menos que no se disponga de TC (figura 24).
En caso de lesión intraorbitaria del NO, que puede sospecharse por proptosis secundaria a la hemorragia y edema orbitario, la TC axial y coronal es la mejor técnica de imagen, mostrando a veces el signo típico en tienda de campaña. También permite ver hemorragias dentro de la vaina del NO y ofrece una excelente visualización del hueso, tejidos blandos y cuerpos extraños intraorbitarios. Se han descrito hemorragias en la vaina del NO en niños maltratados en los que por lo general la hemorragia es mayor en el espacio subdural (163). La lesión intracanalicular del NO puede ocurrir por fracturas del canal óptico o de huesos orbitarios próximos al NO demostrables por TC (164). Sin embargo no es necesario ver estas fracturas para hacer el diagnóstico de lesión intracanalicular del NO. La TC espiral puede tener ventajas respecto a la convencional en niños y traumatismos orbitarios, donde el paciente no puede hiperextender el cuello para obtener imágenes coronales (165). La resonancia magnética (RM) es particularmente útil en distinguir hemorragia intravaina y extradural del NO. Además ofrece imágenes muy útiles del ápex orbitario y seno cavernoso, donde la TC está artefactada por el hueso. Sin embargo, la RM nunca debe ser la técnica de imagen inicial tras un traumatismo, por la posibilidad de un cuerpo extraño metálico (164).
Pronóstico Aunque no podemos predecir qué pacientes mejorarán con tratamiento, se han descrito en la literatura factores que influyen en el pronóstico visual: Cuando hay falta de percepción de luz inmediata al traumatismo, sin un intervalo lúcido o corto período de visión antes del deterioro, el pronóstico visual es pobre (165,166). Sin embargo, la falta de percepción de luz no excluye la posibilidad de tratamiento ni de recuperación visual en una NOT indirecta (167,168). Se asocia a pobre pronóstico visual el desplazamiento de grandes fragmentos óseos contra el NO (165,169) (figura 25).
La recuperación visual en pacientes con NOT indirecta tratados mediante descompresión quirúrgica del canal óptico, es mayor en menores de 40 años de edad (170). En pacientes tratados con megadosis de corticoides, el pronóstico visual es mejor cuando se inicia el tratamiento dentro de las 8 horas primeras después del traumatismo (172).
Manejo Una vez diagnosticada la NOT el siguiente paso es buscar una causa que sea potencialmente tratable, como una hemorragia en diferentes localizaciones orbitarias que puede comprimir el NO y elevar la presión intraocular, pudiendo incluso ocluir la arteria central de la retina.
Muchos casos de NOT, generalmente por trauma indirecto, no tienen una etiología obvia tratable existiendo un gran desacuerdo en la literatura acerca de su manejo. Las tres opciones más defendidas son la observación, el tratamiento con megadosis de corticoides y la descompresión quirúrgica del canal óptico que puede hacerse por diferentes vías según las recomendaciones de cada autor: intracraneal, extracraneal transetmoidal (170,176), por endoscopia intranasal (177), sublabial, etc. La gran controversia existente radica en que no ha sido posible realizar ningún estudio prospectivo, randomizado y toda la información proviene de pequeñas series retrospectivas y casos aislados. Cook y col. tras hacer un meta-análisis de estos estudios llegan a la conclusión de que es mejor tratar a estos pacientes con corticosteroides, descompresión extracraneal, o ambos, que no tratarlos (178). Una estrategia recomendada es administrar inmediatamente 30 mg/kg de metilprednisolona intravenosa, seguido por 5,4 mg/kg/hora durante 48 horas, si no existe contraindicación. Si la visión es muy baja o mejora con esteroides, pero se deteriora al disminuirlos, entonces debería hacerse una descompresión quirúrgica. En caso de un fragmento óseo desplazado en el canal óptico, debería hacerse una descompresión quirúrgica administrando corticosteroides intravenosos (179,180). Otra pauta sería administrar inmediatamente un bolo intravenoso de metilprednisolona 30 mg/kg en 30 minutos, seguido 2 horas después por otro bolo de 15 mg/kg. A continuación 15 mg/kg./6 horas durante 48 horas. Si la AV mejora significativamente se pasa a 80 mg de prednisona oral durante 3 días y después disminuyendo 20 mg cada 3 días hasta suspenderla. A quienes no mejoran con esteroides intravenosos y aquellos cuya AV mejora inicialmente pero se deteriora al descender la dosis, se les realiza descompresión extracraneal del canal óptico (172). En pacientes seleccionados, que no responden a altas dosis de esteroides intravenosos durante 24-48 horas, y presentan signos radiológicos de patología quirúrgicamente tratable, como un aumento en la vaina del NO, o un estrechamiento del canal óptico, o ápex orbitario por espículas óseas, puede estar indicada la descompresión de la vaina del NO sola o combinada con descompresión del canal óptico (165). En la actualidad no hay acuerdo sobre el manejo de la NOT indirecta. Según las conclusiones del International Optic Nerve Trauma Study (181) no existen diferencias en la AV final en pacientes con NOT indirecta no tratados y en aquellos tratados con corticosteroides y/o descompresión del canal óptico, siendo razonable tomar la decisión de tratar o no tratar según cada caso individual. En caso de NOT por traumatismo directo, que suele cursar con transección de las fibras del NO, no existe un tratamiento efectivo en la actualidad (182).
Bibliografía
|