Traumatismos oculares
J. García-Arumí, F. Escalada
EPIDEMIOLOGÍA
Los traumatismos oculares representan la principal causa de perdida de agudeza visual en individuos jóvenes. También representa un gran reto su resolución para los cirujanos de vitreo-retina. La variedad de lesiones y la afectación de ambos segmentos del globo ocular requiere estrategias de tratamiento individualizados para cada caso. En las últimas 2 décadas se han desarrrollado nuevas técnicas e instrumentación para patología vitreoretiniana, pero los resultados anatómicos y visuales en casos severos de desprendimiento de retina traumático todavía son modestos. Sabemos que aproximadamente el 90% de los desgarros gigantes y otros desprendimientos complejos no traumáticos se solucionan, reaplicando la retina con excelentes resultados visuales. Estos resultados contrastan con los publicados en series recientes de desprendimiento de retina por traumatismos penetrantes, sobre 113 pacientes, solamente 33,6% conseguían una A.V. igual o superior a 1/200.
En un estudio prospectivo multicéntrico realizado en España entre 1989 y 1991 por el Grupo Español Multicéntrico de Traumatismos Oculares (GEMTO) sobre 1378 ojos (1314 pacientes) afectos de trauma ocular (3), los accidentes laborales ocupaban el primer lugar (21,9%), seguidos por los accidentes domésticos (21%) y los accidentes en tiempo de ocio (17%). Los accidentes de tráfico solamente afectaban el 15% del total de traumatismos oculares, pero eran generalmente traumas penetrantes, revistiendo mayor gravedad. Los accidentes deportivos ocupaban el 12% del total de traumas oculares, y los traumas oculares secundarios a agresión o asalto eran solamente el 10% del total, lo que contrasta con el 22% que ocupan los traumas por asalto en el estudio del National Epidemiologic Trauma Study Report (NETSR) en Estados Unidos. El 83% de los ojos traumatizados en el estudio español del GEMTO correspondía a hombres, la mayoría de ellos comprendidos entre 20 y 40 años. Se calcula que en España 72.000 habitantes/año sufren traumatismos oculares con secuelas que condicionan una disminución de agudeza visual. Estas cifras provocan una carga fisica, psicologica y socioeconómica muy importante al paciente y a la sociedad en general. El paciente, generalmente joven, puede quedar con un defecto visual de por vida, con una pérdida de productividad y tiempo en el trabajo. Los costes de quirófano y hospitalización de estos pacientes son elevados. Aunque el objetivo principal sea la prevención, sobre todo en el trabajo, en muchas ocasiones no se cumplen estas medidas preventivas. Debido a ello, el tratamiento efectivo de los traumatismos oculares es de gran importancia.
FISIOPATOLOGÍA DEL TRAUMA OCULAR
Se ha realizado múltiples modelos experimentales en un intento de entender mejor la fisiopatología de las complicaciones vitreorretinianas después de un traumatismo ocular severo. El resultado de estos estudios, ha permitido el desarrollo de las técnicas quirúrgicas vitreorretinianas actuales. El traumatismo ocular contuso, puede tener un efecto devastador sobre el globo ocular: las fuerzas contusas provocan una contracción antero-posterior del globo ocular con una expansión lateral secundaria a nivel del ecuador y tracción sobre la base del vítreo. Estas alteraciones fueron demostradas por Wiedenthal y Schepens en un modelo experimental de ojo de cerdo. La contusión de la cornea por un objeto a alta velocidad, provocaba un acortamiento ocular antero-posterior severo con patología de la retina periférica subsecuente como la aparición de diálisis retiniana, alteraciones del epitelio pigmentado de la retina y roturas a nivel del epitelio de la pars plana (7). Basados en el mismo modelo experimental, Delori y cols utilizaron cinematografía y fotografía de alta velocidad observando una reducción del 60% de la dimensión antero-posterior del globo ocular seguida por una expansión al 112% de su longitud original. Cox estudió los efectos de un traumatismo contuso severo en ojos de conejo y de monos, observando necrosis y desgarros en la retina, así como hemorragias subretinianas
Topping y colaboradores desarrollaron un modelo de doble penetración, es decir perforación transfixiante del globo ocular del conejo. La contracción vítrea con la formación de una tracto fibroso, se observó inmediatamente después de la perforación ocular en todos los ojos estudiados. La herida a nivel de la puerta de salida, se cerraba por una proliferación fibroblastica a partir del cuarto día después del trauma, iniciandose también a partir del cuarto día la proliferación vitreorretiniana. La condensación vítrea observada inicialmente sirvió en tiempos sucesivos como soporte anatómico de la proliferación celular a nivel del vítreo. Estos autores enfatizaron el hecho de que el vítreo servía de una matriz estructural para la proliferación intraocular. No se observó un desprendimiento de retina en ningún caso de este modelo de experimentación. En una segunda revisión realizada por estos mismos autores, observaron que la vitrectomía inmediata después del traumatismo evitaba la proliferación transvítrea en todos los animales de este grupo, mientras que la vitrectomía secundaria realizada a las dos semanas del trauma, era efectiva en cuanto a la extracción de la proliferación transvítrea y para evitar la recurrencia. Con este modelo demostraron que la vitrectomía era capaz de evitar la proliferación fibroblástica. Posteriormente Clearly y Ryan desarrollaron un modelo animal de experimentación del traumatismo penetrante posterior en el mono que completó el estudio de los autores precedentes. Se practicaba una herida de 8 mm. a nivel de la pars plana del ojo del Macacus Rhesus y se inyectaba 0,5 ml. de suero autólogo en la cavidad vítrea, utilizando una solución salina tamponada en el ojo control. En el grupo en el que se inyectaba la sangre autóloga, se desarrollaba desprendimiento de retina traccional, lo que no ocurría en el ojo control. Este estudio demuestra la importancia de la hemorragia vítrea en la producción de la proliferación fibrocelular y el desprendimiento de retina traccional. Estos autores sugerían que existían dos mecanismos que provocaban el desprendimiento de retina: en primer lugar el hecho de que la incarceración vítrea en la herida con el consiguiente crecimiento de la proliferación fibrocelular provoca tracción a nivel de la base del vítreo y en la retina periférica, y en segundo lugar la tracción tangencial sobre las membranas epirretinianas en la retina anterior.
Gregor y Ryan completaron posteriormente estos estudios con un modelo de traumatismo penetrante en el mono Rhesus en el cual dividían dos grupos: uno al que se le practicaba una vitrectomía completa, y en el segundo grupo se practicaba una vitrectomía central, se observaba una proliferación fibrocelular marcada desde la herida en aquellos ojos en los que solamente se practicaba vitrectomía central y no se observaba proliferación notable en los ojos en los cuales se les practicaba vitrectomía completa. Este estudio nos ayudó a comprobar la importancia de la separación y extirpación de la hialoides posterior en los ojos traumatizados. Finalmente los modelos experimentales han demostrado una significativa rotura de la barrera hematorretiniana con la consiguiente entrada de factores de crecimiento y citoquinas, tales como el factor derivado de las plaquetas y las fibronectina. Estas substancias son potentes estimuladores de la migración de células gliales, fibroblastos y células del epitelio pigmentario en la cavidad vítrea que posteriormente desarrollarán la formación de colágeno, y la contracción de este colágeno por las células provocará la tracción vitreorretiniana.
HISTORIA Y EXAMEN OFTALMOLÓGICO
La evaluación clínica de un paciente con traumatismo ocular debe iniciarse con una historia sistemática y completa. Es importante conocer las circunstancias y el exacto mecanismo del trauma. Esto implica un interrogatorio sobre la naturaleza del trauma (penetrante versus contuso) y las circunstancias que lo rodeaban, como si estaba golpeando metal contra metal, posible participación de material orgánico, la asociación con explosivos, la participación de armas de fuego entre otros. Todos los pacientes con una historia de martilleo de un clavo deben ser evaluados sobre la presencia de un cuerpo extraño intraocular. Si se sospecha la presencia de un traumatismo penetrante, es necesario conocer la naturaleza del material envuelto en el trauma, si es metálico o no, si es de naturaleza orgánica o no, ya que esto puede afectar la decisión de intervención quirúrgica y la posibilidad de utilización o no de antibióticos intravítreos. Cuando se recoge la historia de un posible cuerpo extraño, es fundamental conocer la composición del objeto (hierro, cobre, plomo, cristal, plástico, madera...) y preguntar si una pieza residual del objeto se puede recuperar para analizarla. Los antecedentes de patología ocular previa son importantes para establecer una pobre agudeza visual de base, ya que la estrategia quirúrgica puede alterarse por cirugías oculares previas (trabeculectomías, queratoplastia penetrante...). Se deberá realizar una historia sobre medicaciones previas y alergias, ya que el pacientre iniciará un tratamiento con antibióticos intravenosos. Si el paciente no se ha vacunado recientemente contra el tétanos se le administrará toxoide tetánico.
El examen ocular debe incluir el ojo dañado y el ojo contralateral. Se determinará inicialmente la agudeza visual con correción. La evaluación de si el paciente puede percibir o no luz, y si la localiza, es de gran importancia diagnóstica, en el pronóstico final, y tiene valor medico-legal. Se determinará también la respuesta de la pupila y la presencia o no de un reflejo pupilar aferente.
CLASIFICACIÓN DEL TRAUMA OCULAR
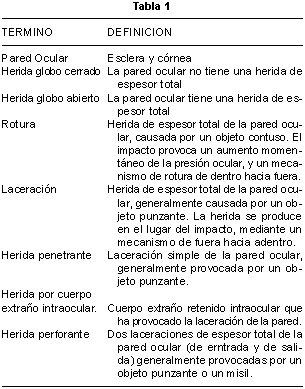
Es fundamental el empleo de un vocabulario estandarizado en la descripción del ojo traumatizado. Kuhn y cols publicaron en 1996 una clasificación del trauma ocular, describiendo los términos utilizados, la Birminghan Eye Trauma Terminology (BETT), que es la que se utiliza actualmente para unificar criterios. Los términos y definiciones de la BETT están incluidos en la tabla 1.

Aunque la pared del globo ocular tiene tres y no una sola capa posterior al limbo, para propósitos clínicos se ha preferido restringir el término "pared ocular" a las estructuras rígidas de la esclera y córnea. Dentro del concepto de herida a globo cerrado se incluyen las contusiones, en las cuales no existe ninguna herida de la pared ocular, y las heridas de espesor parcial, llamadas laceraciones lamelares. Las roturas del globo ocular se producen por el aumento brusco de la presión ocular al ser golpeado por un objeto romo, que provoca una rotura si la energía supera la fuerza de cohesión de la pared ocular, abriendose el globo en donde la pared es más débil, muchas veces a distancia del lugar del impacto, provocando frecuentemente herniación de tejido.
La clasificación BETT incorpora todos los tipos de heridas mayores (fig. 1) y procura una definición clara de cada término, que se empleará en este capítulo.
El estudio del trauma ocular incluirá las estructuras perioculares, y la motilidad ocular extrínseca. Se deberá evitar cualquier presión sobre el globo ocular por el riesgo de expulsión de contenido intraocular. Examinaremos bajo anestesia tópica la superficie ocular, empezando por:
1. Conjuntiva-esclera para detectar heridas, grado de quémosis, hemorragia subconjuntival, ya que pueden ser signos de ruptura de la pared ocular (fig. 2).
2. Cornea. Evaluaremos con la lámpara de hendidura también la córnea para detectar erosiones, heridas más profundas, y clasificaremos en lo posible la severidad de la lesión. Esta clasificación incluirá desde laceraciones lamelares, laceraciones pequeñas que no precisan puntos y se cierran espontaneamente hasta laceraciones severas largas, con o sin cuerpo extraño intraocular, herida escleral concomitante y posibilidad de rotura escleral posterior. Se deberá realizar un test de Seidel en todos los casos de sospecha para evaluar la posibilidad de herida penetrante de espesor total.
3. Cámara anterior. En la cámara anterior se evaluará su profundidad, presencia de células, proteínas o fibrina, presencia de hipopion o hipema, y posible cuerpo extraño.
Existen algunos signos que nos orientarán sobre la posibilidad de que el globo ocular esté perforado:
4. Iris. Deberemos examinar el iris para detectar la presencia de desgarros, iridodiálisis, desviación pupilar por incarceración en herida corneal, pequeñas perforaciones sugiriendo la presencia de cuerpo extraño intraocular.
5. Cristalino. El cristalino se examinará buscando opacificaciones focales por penetración, cuerpos extraños, facodonesis, subluxación o luxación. Buscaremos la impronta de pigmento en anillo en la regíón pupilar, signo de contusión.
6. Humor vítreo En el humor vítreo deberemos detectar la presencia o no de pigmento en polvo de tabaco (signo de rotura retiniana o cronicidad del proceso), hemorragia, vitreitis y cuerpos extraños. La tracción vítrea hacia una zona localizada (incarceración vítrea) nos ayudará a encontrar las posibles roturas esclerales anteriores o posteriores. La avulsión de la base del vítreo es practicamente patognomómica de diálisis retiniana.
7. Fondo de ojo. El examen del fondo del ojo se deberá realizar sin indentar el globo ocular, si existe sospecha de globo abierto. La identación se reservará para cuando se haya suturado adecuadamente la pared ocular.
Es importante valorar si existe desprendimiento hemorrágico de coroides asociado, ya que esto nos condicionará la actitud quirúrgica y el emplazamiento de la infusión intraocular.
EXPLORACIONES COMPLEMENTARIAS
Las exploraciones complementarias constituyen una ayuda inestimable para el correcto diagnóstico y tratamiento del trauma ocular. Son de utilidad la radiografía orbitaria, ecografía, tomografía computerizada (TAC), resonancia nuclear magnética (RNM), potenciales evocados visuales (PEV).
La radiografía de cráneo y las tomografías, si bien se ha visto superada por otras exploraciones más modernas, es una exploración fácil de realizar, y puede ser de ayuda sobre todo en la detección de cuerpos extraños intraoculares.
La ecografía ocular sobre todo en su modo B nos ayudará a conocer la presencia o no de desprendimiento de la hialoides posterior, la presencia de desprendimiento de retina o hemorragia vítrea en casos de mala visualización por lesión corneal o de cristalino, la presencia de desprendimiento de coroides, la presencia de cuerpo extraño intraocular. Los cuerpos metálicos de metal, cristal o plástico se detectan fácilmente mediante ecografía (fig. 3). Nos determinará el grado de licuefacción del desprendimiento de coroides hemorragico, indicandonos el momento de la lisis del coágulo y por tanto el momento de la intervención quirúrgica. Rubsamen y cols realizaron recientemente un estudio comparativo sobre los hallazgos preoperatorios mediante ecografía B y los hallazgos intraoperatorios en 46 pacientes con traumatismo penetrante con opacificación de medios que requirieron intervención quirúrgica. Los ultrasonidos en modo B mostraron un 100% de especificidad y sensibilidad en desprendimientos de retina, cuerpos extraños intraoculares (incluyendo una pestaña) y heridas perforantes posteriores. Observaron un 75% de sensibilidad y 100% de especificidad en el diagnóstico de la extensión posterior de laceraciones anteriores, y un 100% de sensibilidad y 98% de especificidad en las hemorragias coroideas. Mc Nicholas y cols evaluaron prospectivamente 61 traumatismos mediante ecografía. Los hallazgos pre y postoperatorios coincidieron en el 90% de los casos, observandose diagnóstico incorrecto solamente en el 7% de los casos.
El uso de la ecografía tridimensional nos ayuda notablemente en la localización topográfica y medición de tamaño y volumen de hemorragia coroidea, desprendimiento de retina y cuerpos extraños intraoculares. La sonda del ecógrafo va provista de un rotor que durante 7,5 segundos registra los ecos en todos los ejes y registra cientos de planos bidimensionales. La imagen del globo ocular completa reconstruida digitalmente puede ser rotada en cualquier dirección u orientación, y posteriormente seccionada en los planos deseados para estudio de su patología. Cada sección posterior está marcada en los diferentes ejes espaciales. La principal ventaja es que estos estudios los podremos realizar sin la presencia del paciente, ya que la información digital quedara recogida en el ordenador, después de los 10 segundos que tarda el rotor en practicar los cortes (fig. 4).
La ultrasonografía de alta frecuencia (50 MHz) nos permite realizar una ecografía de alta calidad del segmento anterior del globo ocular, y del espacio retroiridiano. Alleman y cols han descrito el uso de esta técnica para distinguir el hipema organizado versus el hipema liquido, encontrando este hallazgo de utilidad en su tratamiento. También ayuda en el diagnóstico de cristalinos subluxados, iridodiálisis.
La tomografía axial computorizada es otra exploración no invasiva que juega un papel importante en la evaluación del ojo y la órbita traumatizados. Es muy útil en el diagnóstico de laceraciones posteriores. Se deberán realizar secciones axiales y coronales de 1,5 mm. El hallazgo de una burbuja de aire intraocular nos confirmará la presencia de una perforación. La indicación princeps de la TAC es la evaluación y diagnóstico de los cuerpos extraños intraoculares (fig. 5). Pueden llegarse a detectar cuerpos extraños intraoculares de menos de 1 mm de diámetro. La principal limitación es el efecto de dispersión que producen los cuerpos extraños metálicos que puede dificultar la localización de los mismos. También ayudará en el diagnóstico de la perforación posterior. Los signos de ruptura escleral incluyen el aplanamiento de la superificie posterior de la esclerótica, la presencia de engrosamiento escleral, y la falta de continuidad de la pared escleral.
La resonancia nuclear magnética puede ser de utilidad en la evaluación del globo ocular y órbita, ya que su definición es superior a la del TAC. La mayor resolución puede ser muy útil en la evaluación de roturas esclerales ocultas, desprendimientos de coroides hemorrágicos, y hemorragias vítreas densas. También es superior a la TAC en la detección de cuerpos extraños intraoculares de madera, plástico o cristal. Sin embargo, su utilidad se ve fuertemente comprometida por el hecho de que la gran mayoría de los cuerpos extraños son metálicos de naturaleza, y el uso de la RNM está contraindicada en estos casos, por el hecho de que el campo magnético puede provocar migración intraocular del cuerpo extraño con lesión ocular secundaria. Debido a ello, ante el desconocimiento de la naturaleza del cuerpo extraño intraocular, nunca se utilizará la RNM.
La practica de potenciales evocados visuales en el ojo traumatizado es una técnica excelente para tener información sobre la función visual central. El resultado de los PEV será de gran aguda en el pronostico visual final de estos pacientes.
PRINCIPIOS GENERALES DE TRATAMIENTO
PROFILAXIS ANTIBIÓTICA
El ojo afecto de trauma ocular tiene un riesgo elevado de endoftalmitis. Este riesgo aumenta si está en contacto con materia contaminada, y si el trauma se asocia a cuerpo extraño intraocular. La incidencia de endoftalmitis posttraumática oscila entre el 2% y el 7%. Esta endoftalmitis además puede enmascararse por la inflamación intraocular que provoca el trauma abierto, por lo que el diagnostico se demorará. Aunque no hay estudios estadísticos en animal de experimentación ni estudios clínicos que avalen claramente el uso de antibióticos profilácticos, su uso está extendido tanto en el preoperatorio como en el postoperatorio de pacientes afectos de traumatismo penetrante del globo ocular. El papel de los antibióticos intravítreos no está claramente definido, sobre todo después de los estudios sobre toxicidad retiniana, especialmente de los aminoglucósidos. Sin embargo, cuando existen signos de endoftalmitis en el momento de la exploración, o la naturaleza de la penetración (cuerpo extraño intraocular, ambiente rural) sugiere un alto riesgo de desarrollo de endoftalmitis, es aconsejable utilizar antibioticoterapia intravítrea como la vancomicina (1,0 mg) y la amikacina (200 a 400 microgramos) o ceftacidima (2.25 mg). Debido al riesgo de retinotoxicidad de la amikacina preferimos la asociación de vancomicina y ceftacidima. Se administrará en estos pacientes de alto riesgo tratamiento tópico con Vancomicina (50 mg/ml) y ceftacidima (50 mg/ml). Como alternativa se puede utilizar ciprofloxacina tópica. No se administrará tratamiento subconjuntival por el riesgo de penetración intraocular a través de la herida, y porque no ha demostrado una mayor efectividad que la administración tópica contínua.
Debido a que los resultados del Endophthalmitis Vitrectomy study se basan en infección postoperatoria, en la mayoría de los casos secundaria a cirugía de cataratas, es difícil extrapolarlos cuando se trata de un traumatismo penetrante, ya que la penetración intraocular de los antibióticos se verá influenciada por la rotura de la barrera hematoocular secundaria al trauma. Se recomienda que los pacientes afectos de traumatismo penetrante con cuerpo extraño intraocular reciban antibióticos profilácticos sistémicos durante 1 semana. Utilizamos la combinación de vancomicina (1 gr/12 h) y una cefalosporina de tercera generación como la ceftacidima (1-2 gr/8 h) administradas por vía intravenosa. Las quinolonas han demostrado tener una buena penetración intravítrea administradas por vía oral, y su espectro antibacteriano es amplio, por lo que es una buena opción en sustitución de la antibioterapia intravenosa, lo que permitirá evitar el ingreso hospitalario del paciente. Utilizaremos dosis entre 500 mg y 750 mg cada 12 horas. Sin embargo, pocos antibióticos atraviesan la barrera hematoretiniana lo suficiente como para obtener niveles bactericidas en el vítreo, y aunque en los ojos afectos de endoftalmitis existe un aumento de permeabilidad de la barrera hematorretiniana, el tratamiento sistémico profiláctico se basa más en un tratamiento estandarizado pero sin confirmación de eficacia.
TÉCNICA QUIRÚRGICA
CIERRE DE LA HERIDA
El cierre quirúrgico de la penetración ocular deberá restaurar en lo posible la anatomia y la arquitectura funcional, evitar complicaciones posibles, y preparar el globo ocular para futuras intervenciones. Existen unos principios generales que deberán seguirse:
Las laceraciones corneales son muy frecuentes en el traumatismo corneal penetrante. En una serie del GEMTO sobre 84 pacientes con penetración ocular por cuerpo extraño intraocular, en 67,8% de los casos existía rotura corneal o corneoescleral que tuvo que ser reparada. Estas heridas deberán ser suturadas teniendo en cuenta la proximidad del eje visual y la necesidad de visualización en una futura cirugía vitreoretiniana. Rowsey y cols han descrito una técnica que aplica principios queratorefractivos en la reparación de las laceraciones corneales; el principio es maximizar la esfericidad corneal central, disminuyendo la distorsión corneal y el astigmatismo postoperatorio. Se utilizarán para ello puntos largos múltiples de nylon 9/0 a nivel del limbo corneal (si ello fuera preciso) para producir un aplanamiento de la córnea periférica, y puntos espaciados cortos de nylon 10/0 en la córnea central para reducir el aplanamiento producido por las suturas.
Mientras se cierra la herida corneal o limbal, la cámara anterior se deberá reformar y cualquier tejido incarcerado (generalmente iris o humor vítreo ) se deberá liberar de la herida con la ayuda de hialuronato sódico y una espátula o la misma cánula del viscoelástico. Si después de reformar la cámara anterior se observa que alguna sutura ha quedado demasiado apretada o floja, se seccionará y volverá a suturar con la tensión adecuada. El humor vítreo expuesto en la herida deberá ser liberado, y se practicará una vitrectomía anterior con un vitrectomo mecánico y una infusión accesoria. Los defectos corneales residuales se podrán reparar con adhesivos biológicos (cianoacrilato) o con transplantes tectónicos, dependiendo del tamaño de la solución de continuidad.
La heridas esclerales se suturarán de primera intención con nylon 8/0, utilizando multiples puntos que produzcan un cierre hermético, y permitan una cirugía vitreorretinana futura. Previa a la sutura se desincarcerará el humor vítreo, y se reposicionará el tejido herniado si fuera posible. En algunas ocasiones con soluciones de continuidad amplias se deberán emplear adhesivos como el cianoacrilato o parches de esclera liofilizada.
PRINCIPIOS GENERALES DE CIRUGIA VITREORRETINANA
Antes del advenimiento de la vitrectomía vía pars plana, el 75% de los ojos que presentaban traumatismos penetrantes que afectaban al segmento posterior acababan con una agudeza visual de movimiento de la mano o inferior. La hemorragia vítrea, la hemorragia coroidea, el desprendimiento de retina rhegmatógeno o traccional, y la hipotonía contribuían a la pérdida de la visión. Diferentes avances en la cirugía ocular han sido utilizados para el manejo más satisfactorio de los traumatismos oculares, esto incluye la vitrectomía por la pars plana, cirugía escleral con identación, el taponamiento con gas intraocular de larga evolución, aceite de silicona y el uso del perfluorocarbono líquido entre otros.
Aunque el traumatismo ocular puede presentarse con una gran variedad de manifestaciones vitreoretinianas, existen una serie de principios quirúrgicos básicos que deberán seguirse en cada caso. Meredith y cols establecieron que existen una serie de objetivos anatómicos y funcionales que deberán cumplirse en cada paciente afecto de trauma ocular que debe ser intervenido. Los objetivos fisiológicos son la extirpación del humor vítreo y de la hialoides posterior, para eliminar el substrato anatómico para la posible proliferación intraocular postoperatoria.
También se deberán eliminar las opacidades vítreas en general, que contienen celulas inflamatorias, y las hemorragias vítreas en particular, que contienen factores de crecimiento que estimulan la proliferación y cicatrización. Los objetivos de la vitrectomía en un traumatismo ocular incluyen extracción de la catarata, subluxación o luxación del cristalino, limpieza de la hemoragia y de las opacidades vítreas, extraer el vítreo cortical, reaplicación de la retina desprendida, cierre de todas las roturas retinianas, extracción de sangre subretiniana y colocación de una banda escleral para soportar la base de vítreo.
Procedimiento escleral. La colocación de una banda escleral ecuatorial de 360° es esencial en el manejo satisfactorio de los ojos con traumatismo penetrante tratados mediante vitrectomía. Diferentes autores han demostrado que el riesgo de desprendimiento de retina postoperatorio después de la vitrectomía en estos ojos disminuía con el uso de un procedimiento escleral. La razón principal se basa en el soporte de la base del vítreo, relajando la tracción ejercida sobre el borde posterior de la base. Este efecto previene el desprendimiento de retina secundario a proliferación y contracción en el borde posterior de la base del vítreo. Nosotros utilizamos en la mayoría de los casos una banda de silicona de 2,5 mm, si bien si ya se ha producido proliferación vitreorretiniana, podemos utilizar una banda de 4 a 6 mm de anchura.
VITRECTOMÍA
Después de retirar del segmento anterior las opacificaciones como la catarata, hipema o membrana pupilar se realiza la vitrectomía. Se realizará utilizando 3 vías, practicando las esclerotomías a 3del limbo en individuos afáquicos o pseudofáquicos, y a 4 mm del limbo en fáquicos. La infusión deberá ser colocada en una zona donde la esclera esté en buenas condiciones, alejandonos del area de penetración del globo ocular, en donde existe mayor riesgo de desprendimiento de retina y de coroides, incarceración vítrea o retiniana. La ecografia tridimensional nos ayudará notablemente a escoger el lugar de emplazamiento de la cánula, evitando las zonas de desprendimiento coroideo. En algunas ocasiones se deberá colocar la cánula en sitios inusuales, como a las 12 horas, entre las otras esclerotomías, o en el cuadrante inferonasal. Después de suturar la cánula de infusión nos aseguraremos de que está toda la punta en la cavidad vítrea libre del epitelio del cuerpo ciliar. Si está cubierta por epitelio ciliar, crearemos una apertura con un cuhillete vitreoretiniano a través de otra esclerotomía. Introduciremos una cánula de 6si la opacificación de los medios no nos permite visualizar la cánula. En muchas ocasiones es necesaria la práctica de cirugía bimanual, especialmente cuando existe proliferación vitreorretiniana o subretinana. En estos casos, se utilizará una cánula de infusión con iluminación, que en su lumen lleva una fibra óptica, que será guiada por el ayudante. Su calibre es algo superior del 19 por lo que la esclerotomía deberá ser algo mayor.
Si existe un desprendimiento de coroides en anillo que ocupa los 360° anteriores, colocaremos una cánula de infusión limbar, con el vitrectomo se eliminarán las opacidades de camara anterior y vítreo anterior, y se practicarán esclerotomías de drenaje; cuando se haya conseguido la extracción parcial del desprendimiento de coroides, se colocará la cánula de 6en el cuadrante con menos bolsa, extrayendose la cánula de cámara anterior. Si es inevitable el emplazamiento de la cánula cerca de una zona dañada, es preferible practicar la esclerotomía vertical.
Durante la parte inicial de la vitrectomía se utiliza una aspiración baja (100 mmHg) y velocidad de corte alta (700-800 cortes por minuto). Si hay un desprendimiento posterior del vitreo (DPV), el vítreo cortical es más fácilmente extraíble. Si la vitrectomía se realiza antes de los 5 primeros días después de la contusión o si la retina está aplicada es probable que no haya DVP. En pacientes jóvenes las uniones vitreorretinianas son más firmes. Se puede usar perfluorocarbono líquido (PFCL) para realizar una disección por planos entre el vítreo posterior y la retina en ojos con traumatismo penetrante, desprendimiento de retina o ausencia de DVP: después de realizar la vitrectomía central con el vitreotomo, se practica un DVP focal aspirando con el mismo vitrectomo encima de la papila; seguidamente se realiza un agujero en la hialoides posterior; después de visualizar la retina, se inyecta el PFCL para propocionar un mecanismo de disección del vítreo posterior.
Cuando se ha realizado la vitrectomía completa se debe evaluar el estado de la retina. Si hay un desprendimiento de retina bulloso, la inyección de PFCL sobre el disco aplanará la retina sin necesidad de retinotomías posteriores, dado que el fluido será desplazado anteriormente. Cuando el ojo está relleno de PFCL sube el fluido subretiniano hacia el agujero de la retina que ha provocado el desprendimiento; entonces se rellena la cavidad vítrea anterior con aire que exprime el fluido subretiniano anterior a través del agujero. La cánula de aspiración se coloca sobre el agujero y se irá aspirando el fluido subretiniano.
Si aparece hemorragia subretiniana, la sangre puede ser extraída por desplazamiento anterior mediante PFCL, y se drena periféricamente por una rotura retiniana o por una retinotomía.
ENDOFOTOCOAGULACIÓN
Habiendo conseguido la reaplicación de la retina, se practicará endofotocoagulación alrededor de los desgarros. Preferimos la utilización del laser con modo contínuo para crear una pexia uniforme, ya que si en el postoperatorio se redesprende la retina, los impactos aislados pueden provocar nuevos agujeros. En la mayoría de los casos utilizamos laser infrarrojo de 810 nm, por su mayor penetración, y por su capacidad de atravesar hemorragias intrarretinianas, relativamente frecuentes en estos pacientes.
USO DE TAPONADOR TEMPORAL
La presencia o ausencia de DR en los traumatismos oculares penetrantes determinará la necesidad de un elemento taponador de larga duración como el gas o el aceite de silicona. En los ojos con DR debido a un traumatismo se realiza una vitrectomía vía pars plana y se puede utilizar sulfuro hexafluoroso o perfluoropropano. El aceite de silicona se reserva para ojos que después de una vitrectomía vía pars plana y un procedimiento escleral, se complican con PVR y DR traccional. Otra situación en que puede ser beneficioso el aceite de silicona es en los ojos con proliferación masiva o tracción anterior que necesitan una retinotomía para producir relajación. Esto ocurre con mayor frecuencia en ojos operados después de un trauma penetrante.
La estrategia quirúrgica a seguir en cada caso se basará en la exploración preoperatoria y en los resultados de las exploraciones complementarias, decidiendo en cada caso la necesidad o no de colocación de procedimiento escleral, el lugar de emplazamiento de la infusión, la necesidad o no de drenaje transescleral, la utilización de una fuente de luz accesoria...Sin embargo, y debido a la multitud de diferentes manifestaciones del trauma ocular, deberemos improvisar sobre la marcha en muchos casos, lo que convierte esta cirugía en una de las más difíciles pero también más atractivas.
SISTEMAS DE VISUALIZACIÓN
VISUALIZACIÓN PANORÁMICA
La utilización de sistemas de visualización panorámica de campo amplio se ha hecho indispensable en la cirugía del traumatismo penetrante, y los resultados obtenidos mejoran notablemente con su uso. Las principales ventajas son:
También estos sistemas son de gran utilidad durante la utilización de los perfluorocarbonoss liquidos, ya que permite controlar el efecto de reaplicación de la retina con estas sustancias en toda su extensión; Desde luego son fundamentales en el tratamiento de los desgarros gigantes, y cuando se realizan retinotomías en las zonas de tracción periférica.
El sistema que nosotros preferimos es el sistema que utiliza lentes de contacto de alto poder dióptrico precorneales que invierte las imágenes, e incorpora un sistema en el microscopio que vuelve a invertir la imagen. Consigue una imagen de 130 a 160°, con cierta distorsión en extrema perifería.Inclinando la lente se puede visualizar la pars plana en los 360°.
QUERATOPRÓTESIS TEMPORAL
La cicatrización profusa del centro de la córnea o el edema corneal acompaña frecuentemente a los traumatismos oculares penetrantes severos con complicaciones vitreorretinianas. No es infrecuente en estos casos la necesidad de utilización de una queratoprótesis temporal para poder visualizar adecuadamente la cavidad vítrea durante la cirugía vitreorretiniana. Esencialmente se han descrito dos tipos diferentes de queratoprótesis temporales: la de Landers-Foulks y la de Eckardt.
La queratoprótesis de Landers fue introducida por primera vez en 1981, y es una queratoprótesis fabricada en polimetilmetalcrilato que mide unos 5 mm. de longitud y 6,2 mm. de diámetro, y tiene agujeros en el borde anterior que permiten suturarla a la cornea. Tiene una superficie cóncava anterior y posterior con un poder refractivo de -135,6 dioptrías en aire y -85,4 dioptrías en un ojo afáquico relleno de agua. La queratoprótesis temporal de Ekardt fue introducida en 1987, y está fabricada de silicona transparente con una superficie hidrofílica, mide unos 10 mm. de diámetro en su superficie anterior convexa y unos 7 mm. de diámetro en la parte interna, en donde está situado el cilindro óptico. Su poder refractivo es de -35 dioptrías en aire. Esta queratoprótesis se puede suturar a la córnea periférica atravésandola con la aguja de sutura de nylon de 10 ceros en cada cuadrante. Una queratoprótesis de este tipo bien suturada puede aguantar perfectamente presiones intraoculares superiores a 60 mm. de mercurio.
La queratoprótesis temporal de Eckardt tiene la ventaja de que permite una mejor visualización de la perifería de la retina y de la pars plana con identación escleral. Debido a ello nosotros preferimos utilizar esta queratoprótesis. El procedimiento quirúrgico utilizando la queratoprótesis temporal incluye la colocación inicial de una cánula de infusión larga, ya que no vamos a visualizar adecuadamente su punta, posteriormente se practicará un trépano corneal, 0,5 mm. más pequeño que la queratoprótesis y con la subsecuente sutura de la queratoprótesis. Algunos autores utilizan un anillo de Flieringa para evitar el colapso del globo ocular, pero éste no es necesario en la mayoría de los casos. Al final de la cirugía se extraerá la queratoprótesis y un transplante de cornea se suturará en su lugar en un ojo relleno de aire o de silicona. Las principal indicación es la: lesión corneal central que requiera queratoplastia asociada a patología del segmento posterior, como desprendimiento de retina, proliferación vitreoretiniana, hemorragia vítrea.
ENDOSCOPIA EN CIRUGíA VITREORETINIANA TRAUMÁTICA
En pacientes afectos de trauma abierto es frecuente la opacidad de medios, que puede ser reversible o permanente, por afectación corneal, hipema o fibrina en cámara anterior o vítrea, opacidad de cristalino. Además algunas estructuras anatómicas oculares se visualizan con dificultad o son inaccesibles utilizando los sistemas convencionales de visualización, como la superficie posterior del iris, el sulcus, los procesos ciliares y la parte anterior de la base del vítreo, asi como las uniones entre la base del vítreo y la cara posterior del cristalino y zónula. La utilización de un endoscopio permite la visualización directa intraocular de estas estructuras, sin tener que pasar a través de cornea-camara anterior-cristalino. También permite ver directamente las esclerotomías, y si existe tracción vítrea o desgarros retinianos adyacentes a ellas. En traumas abiertos con penetración en esclera anterior, permite valorar la incarceración vitrea-retiniana.
La mayoría de los endoscopios oftálmicos disponibles constan de una punta de 19-20 gauges que dispone de una fibra de iluminación de xenon con una potencia entre 125 y 300 watios, otra fibra óptica conectada a una cámara de vídeo de 3CCD, con una capacidad de resolución entre 6000 y 10.000 pixels, y otra fibra que conduce endolaser infrarrojo o verde. La punta óptica del endoscopio puede terminar en una lente múltiple (gradient lens index o GRIN) que permite mejor definición y mayor foco a cortas distancias (inferiores a 2 mm). El campo de visualización oscila entre 50 y 130°, variando según la cavidad vítrea está llena de líquido o aire. Se pueden utilizar endoscopios de 130°, que permiten una mejor orientación intraocular.
Las principales indicaciones en trauma ocular son:
1. Las opacidades de medios, como edema corneal, hipema y fibrina intracamerular, sinequias en la herida penetrante. Estará especialmente indicada en el edema corneal, que en ocasiones es reversible, evitando así la utilización de queratoprotesis temporal y queratoplastia.
2. Visualización de patología retroiridiana, en cuerpo ciliar y base del vítreo. Especialmente indicado para visualización de cuerpos extraños intraoculares anteriores, evaluación y disección de proliferación vitreorretinana anterior, disección de proliferación en cuerpo ciliar en ojos con hipotonía posttraumática.
3. Endofotocoagulación de pars plana y desgarros periféricos, mal visibles por opacidades corneales focales. Endofotocoagulación de procesos ciliares.
4. Visualización en pacientes con endoftalmitis.
Las principales limitaciones son:
La posibilidad de adaptar el endoscopio al microscopio quirúrgico puede mejorar la curva de aprendizaje y facilitar su utilización.
CIRUGÍA INMEDIATA O RETARDADA
Existen una serie de dudas sobre cuando es el mejor momento de intervenir un traumatismo penetrante del globo ocular. Se debate la necesidad de la cirugía precoz, versus la cirugía retardada para las complicaciones vitreorretinianas del traumatismo después de una reparación quirúrgica inicial.
Faulbourn y cols fueron los primeros en abogar una intervención precoz. Propusieron que la intervención precoz permitía una mejor valoración de trauma y una mejor visualización de la ora serrata para diagnosticar diálisis de la retina, desgarros, desprendimiento de la retina. La cirugía vitreorretiniana precoz nos permite también la extirpación del tejido traumatizado que tiene un potencial efecto inflamatorio y cicatricial.
Coleman ha propuesto la vitrectomía en las 72 primeras horas después del traumatismo, y él comenta que tanto Topping, Abrams y Machemer en sus modelos experimentales y en el modelo experimental en mono de Clearly y Ryan mostraban proliferación fibroblastica tan pronto como cuatro días después del trauma. En consecuencia, la cirugía precoz era necesaria para evitar el foco irritativo que suponía esta inflamación y prevenir los cambios inflamatorios y proliferativos severos que se producen secundarios a un traumatismo en la retina y en un cuerpo ciliar. En su estudio de 112 pacientes con traumatismos penetrantes severos del globo ocular, el 65% de los pacientes que fueron intervenidos mediante cirugía vitreorretiniana, en las primeras 72 horas después del traumatismo consiguieron una agudeza visual de 5/10 o superior, versus solamente el 36% del grupo que se operó entre 10 a 14 días después del traumatismo inicial. En su estudio, sin embargo, las características clínicas de los pacientes en cada grupo no fueron presentadas; por lo tanto es difícil determinar si los resultados hallados en el grupo tratado precozmente se debían a que la cirugía presentaba diferencias en las manifestaciones clínicas en cuanto a la severidad del traumatismo.
De Juan y Asociados también describieron que el pronostico visual era mejor en los pacientes que se operaban en las 72 primeras horas. Esta diferencia, sin embargo, no era estadísticamente significativa y el grupo al que se le practicó vitrectomía precoz tenía un pronóstico considerablemente mejor incluyendo superior agudeza visual inicial, más lesiones a nivel del segmento anterior y menos lesiones en el segmento posterior, una mayor proporción de cuerpos extraños intraoculares, y menor frecuencia de hemorragia vítrea severa.
Los partidarios de la intervención tardía, (después de 72 horas) constatan el hecho de que en un modelo experimental en conejo, no existe diferencia histopatológica en los ojos a los que se les practica vitrectomía inmediata versus a los ojos a los que se les practica vitrectomía después de 14 días. Los que abogan la vitrectomía tardía, aducen que la espera permite el desprendimiento del vítreo posterior. Esto permite también que el procedimiento sea más seguro y más fácil de realizar. La intervención tardía también permitiría la resolución del edema de cornea y disminuiría el riesgo del sangrado intraoperatorio severo. Debido a ello mejoraría también la visualización de la cavidad vítrea.
En la practica clínica, el cirujano de vítreorretina tiene que valorar muchos factores para determinar cuando realizar una vitrectomía en un traumatismo penetrante que afecte al segmento posterior. La presencia de desprendimiento de retina, PVR, sangre subretiniana, CEIO, material cristaliniano y sospecha de endoftalmitis todos estos factores deben ser valorados para determinar el momento óptimo de realización de la vitrectomía, y condicionararán una cirugía más precoz. Preferiremos como norma la cirugía precoz siempre que sea posible, ya que la capacidad de recuperación del globo ocular será mayor si disminuimos la inflamación postoperatoria. La hemorragia intraocular, el resto de tejidos necróticos intraoculares y la posibilidad de infección disminuirán mucho la capacidad de recuperación.
LENSECTOMÍA
La variedad de traumatismos oculares tanto penetrantes como no penetrantes hace que sea difícil estandarizar el procedimiento quirúrgico en estos ojos, y en muchos casos el procedimiento que prequirúrgicamente se tiene intención de realizar se cambia durante la cirugía, después de haber limpiado los medios. El manejo de la catarata traumática, y las indicaciones y técnicas para la implantación de LIO vendrán determinadas por las lesiones a nivel del segmento posterior y el riesgo de postoperatorio de PVR.
INDICACIONES
Las principales indicaciones de lensectomía durante la vitrectomía en un ojo que ha sufrido un traumatismo incluyen: catarata, proliferación vitreorretiniana anterior, subluxación o luxación del cristalino y facodonesis (implica lesión de la zónula de más de 180°).
La catarata traumática puede producirse en el espacio subcapsular anterior o posterior, adoptando una configuración estrellada, en los traumatismos cerrados. Estas cataratas subcapsulares posteriores evolucionan durante meses apareciendo opacificación nuclear progresiva. Generalmente provocan disminución importante de agudeza visual, e impiden la adecuada visualización del fondo del ojo al cirujano, por lo que deberán ser extraídas. Los traumatismos abiertos provocan muy frecuentemente rotura de capsula anterior, y en ocasiones tambien de cápsula posterior, sobre todo en traumas perforantes por proyectil. Este tipo de catarata evoluciona muy rápidamente por hidratación brusca del cortex cristaliniano e impide la visualización del fondo de ojo, debiendose evaluar el estado del segmento posterior de estos pacientes mediante ecografía. Producen inflamación intraocular aguda por la salida de material cortical, por lo que deberán ser intervenidas de urgencia.
La extracción del cristalino transparente estará indicada si se necesita realizar una vitrectomía anterior amplia, lo que principalmente ocurre cuando hay una proliferación vitreorretiniana anterior. También se deberá realizar cuando el diagfragma zonulo-cristaliniano esté muy dañado con inestabilidad manifiesta del cristalino (más de 180°). Dado que muchos traumatismos oculares ocurren en pacientes jóvenes, la lensectomía deberá realizarse con el vitreotomo, ya que tienen una mínima o nula esclerosis nuclear, siendo el cristalino de consistencia blanda, y en los casos de rotura traumática de la cápsula posterior, el material cortical se mezclará con el gel vítreo pudiéndose provocar tracciones sobre la retina anterior si utilizamos un facofragmentador. En pacientes de mayor edad, sin embargo, puede ser indispensable el aparato de facoemulsificación para extraer el material nuclear. La dureza del cristalino se puede determinar cuando se introduce la lanzeta o cuchillete a través del ecuador del cristalino, y puede repetirse para fragmentarlo. Durante esta maniobra se va infundiendo solución salina balanceada a través de una aguja de calibre 25 gauges que previamente habremos doblado e introducido por otra esclerotomía, atravesando el ecuador y el nucleo del cristalino, con el fin de hidratarlo.
El nucleo del cristalino es lo que se extrae primero dirigiendo este material hacia la apertura del vitreotomo con la ayuda de la aguja de irrigación. Cuando se logra el cráter central se aspira el material cortical hacia el centro y se retira. Se puede realizar indentación escleral para acercar hacia el eje visual el cortex periférico que queda detrás del iris. Es muy importante conservar la cápsula posterior durante el proceso de extracción, tanto del material nuclear como cortical, con el fin de evitar la caída de estos y el posible paso al espacio subretiniano, donde pueden ser muy difíciles de visualizar y de extraer. También se debe intentar conservar la cápsula anterior para proteger el esfínter del iris durante la extracción del córtex periférico.
Después de completar la lensectomía, se deberán retirar todos los restos capsulares y corticales. Esto es más fácil si se realiza una técnica de cirugía bimanual, cogiendo la cápsula con unas pinzas, traccionando suavemente hacia el centro, y con el vitreotomo en la otra mano, se van aspirando y cortando los restos de material y capsula. En pacientes jóvenes, la inyección de quimiotripsina puede ayudar a romper las adherencias zonulares disminuyendo la tracción anterior que se realiza en la base del vítreo.
MANEJO DE LUXACIÓN O SUBLUXACIÓN DEL CRISTALINO
Los traumatismos son la causa más frecuente de luxación o subluxación del cristalino. Los traumatismos cerrados producen un acortamiento del meridiano anteroposterior y una distensión a nivel ecuatorial, provocando una distensión y rotura zonular. Los traumatismos abiertos también pueden causar una disrupción a nivel zonular y un desplazamiento del cristalino. Se produce una subluxación del cristalino cuando hay fibras zonulares rotas y quedan otras sujetándolo, y se mantiene a nivel pupilar. Se produce una luxación cuando todas las fibras de la zónula están rotas, y está completamente desplazado hacia la cavidad vítrea o hacia la cámara anterior.
Entre los síntomas de la subluxación del cristalino se encuentran la diplopia monocular, deslumbramiento, afaquia y astigmatismo importante. La luxación posterior del cristalino produce una afaquia funcional. La luxación o la subluxación no son un problema en sí mismas, ya que los pacientes pueden tener buena visión con la correspondiente correción óptica de la afaquia. Sin embargo, un impacto contuso puede originar la formación de cataratas. Se deberán seguir unas técnicas y consideraciones cuando se vayan a extraer cataratas subluxadas o luxadas. Cuando se evalua un paciente con catarata después de un traumatismo contuso, es importante recordar que el cristalino puede estar subluxado, por lo que se debe realizar una exploración cuidadosa en la lámpara de hendidura, buscando cualquier evidencia de iridodonesis o facodonesis. En muchos casos, puede estar asociada una iridodiálisis, y se puede detectar la ausencia de la zónula mirando a través de la zona carente de iris. A veces, se puede detectar vítreo alrededor del cristalino sin alteraciones a nivel de la pupila o iridodiálisis; la presencia de prolapso vítreo en la cámara anterior indica una ruptura a nivel de la zónula.
La extracción del cristalino subluxado o luxado debería realizarse sólo cuando produce un empeoramiento de la visión. Si está indicada la extracción del cristalino subluxado, debe tenerse en cuenta durante el abordaje quirúrgico la posibilidad de prolapso del gel anterior. En cristalinos mínimamente subluxados (menos de un cuadrante de afectación zonular) se puede realizar una técnica de facoemulsificación con implante de la lente. Se debe realizar una capsulorrexis amplia por si fuese necesario inclinar el nucleo hacia en dirección anterior. Deberemos disminuir la presión de infusión, mimimizar las maniobras endosaculares, ser cuidadosos con la hidrodisección, irrigación y aspiración, realizando la fragmentación en cámara anterior, para reducir la tracción a nivel de la zónula. Utilizaremos anillos de soporte capsular para estabilizar el ecuador del saco capsular. La lente puede ser colocada en sulcus o en saco, dependiendo del grado de soporte capsular; la rotación de la lente debe ser evitada y los hápticos se colocarán en zonas con soporte zonular. Las lentes pueden ser rígidas o plegables, pero deberán tener un buen soporte ecuatorial.
Se han descrito numerosas técnicas sobre el tratamiento de cristalinos luxados siendo la técnica más comúnmente utilizada la vitrectomía vía pars plana por tres vías. Se realiza una vitrectomía completa, que en los ojos que han sufrido un traumatismo debe incluir el vítreo anterior, para reducir el riesgo de proliferación anterior. Si se tiene que realizar facoemulsificación en la cavidad vítrea, el riesgo de tracciones vítreas con el aparato de ultrasonidos es alto si quedan restos de vítreo. Esto es especialmente importante cuando la retina está aplicada y la hialoides posterior está adherida a la superficie retiniana.
La técnica clásica incluye: vitrectomía, introducción del aparato de ultrasonidos a través de pars plana, con una aspiración de 150 mmHg, el cristalino es separado de la retina en dirección hacia el centro de la cavidad vítrea y fragmentado. Frecuentemente es necesario aplastar los fragmentos nucleares entre el facofragmentador y la endoluz, con el fin de lograr trozos más pequeños que puedan ser aspirados.
Aunque este es un procedimiento efectivo para la extracción de cristalinos luxados, puede ser arriesgado ya que se pueden producir lesiones retinianas por la caída de fragmentos o por la alta energía que puede necesitar el facofragmentador para extraer el material. El riesgo de que se produzcan lesiones a nivel de la retina aumenta si está desprendida, porque es relativamente fácil atraparla con la aspiración del aparato de ultrasonido; si esto ocurre se producen amplias roturas en milisegundos, ya que los ultrasonidos deshacen muy rápidamente el tejido retiniano.
Para trabajar con efectividad y seguridad en la extracción de fragmentos cristalinianos de la cavidad vítrea, se recomienda el uso de perfluorocarbono líquidos (PFCL). Los perfluorocarbonos líquidos elevan los fragmentos desde la retina hacia la cavidad vítrea. Su alto peso específico ejerce una fuerza de aplanamiento que reaplica la retina si está desprendida mientras se eleva el cristalino. Los perfluorocarbonos líquidos proporcionan un cojín que da soporte a los fragmentos cristalinianos a la vez que evita el daño retiniano por estos.
Técnica quirúrgica con PFCL: después de realizar una vitrectomía completa (fig. 6), se inyecta el perfluoro-octano sobre el disco óptico para reflotar el núcleo separándolo de la retina y dirigiéndolo hacia la cavidad vítrea. Si hay un desprendimiento de retina asociado, el PFCL desplazará el fluido subretiniano hacia la ruptura preexistente a nivel anterior, reaplicando la retina (fig. 7). El cristalino luxado es fragmentado entonces en la cavidad vítrea mientras flota en el PFCL (fig. 8). Si pequeños fragmentos de núcleo se sueltan sobre el PFCL, deben ser retirados mediante aspiración o fragmentación. En ocasiones, pequeños restos de material cristaliniano que flotan en el PFCL se incrustan en la base del vítreo, y se pueden producir tracciones de la retina al intentar retirarlos. Es importante en estos casos intentar apartarlos de la base del vítreo tanto como sea posible. Si el cristalino luxado es de consistencia pétrea, y no es posible su fragmentación ultrasónica, es preferible una crioextracción de éste mediante una incisión a nivel limbar. Sin embargo, con los instrumentos de facofragmentación actuales, es extremadamente rara la necesidad de extracción via limbal.
En un ojo en el que además del cristalino luxado haya desprendimiento de retina, se realizará endofotocoagulación a nivel de la ruptura a través del PFCL tras haber extraído los restos de material. Se realiza recambio PFCL-aire, y se coloca el procedimiento escleral.
Nosotros preferimos utilizar perfluoro-octano respecto a los otros PFCL disponibles, por sus específicas características físicas, como su baja viscosidad, alto peso específico, alto índice refractivo y su alta presión de vapor. Si se utiliza gas como taponador temporal, pequeñas gotas residuales de perfluoro-octano se vaporizan a 37° C.
INDICACIÓN DE IMPLANTE DE LENTE INTRAOCULAR
La decisión y el tipo de implantación de lente intraocular en un ojo que ha sufrido un traumatismo, depende del estado del segmento posterior y la presencia o no del diafragma cápsulo-zonula. Si el segmento posterior del ojo está seriamente afectado por una penetración o perforación ocular traumática, con desprendimiento de retina, proliferación vitreoretinana, incarceración retiniana o hemorragia subretiniana, está indicada la realización de lensectomía sin LIO. En estos casos es muy importante extraer la maxima cantidad de gel vítreo para prevenir la PVR anterior, ya que después de una lensectomía es más fácil la vitrectomía anterior.
El riesgo de PVR en estos ojos durante el postoperatorio es alto y la fibrosis capsular no permite una adecuada visualización de la periferia retiniana, además la cápsula a nivel ecuatorial y los ligamentos zonulares son un buen soporte para la proliferación de células que crecerán y originarán membranas fibrocelulares ejercerán tracción anteroposterior a nivel de la retina periférica.
Si el estado del segmento posterior es razonablemente bueno en un ojo traumatizado y el riesgo de PVR es bajo, la colocación de LIO está indicada. Si el diafragma cápsulo-zonular está en buenas condiciones, la LIO puede ser colocada en el saco capsular o en el sulcus, dependiendo de la integridad de la cápsula posterior. En un traumatismo ocular penetrante que afecte la córnea, cápsula anterior y posterior, después de la vitrectomía y de la extracción de los restos cristalinianos, debería intentarse conservar las cápsulas cristalinianas mientras se extraen el vítreo anterior y el cortex residual. Si hay pocos restos de cápsula como para dar soporte a la LIO, entonces éstas se deberían suturar en sulcus.
La sutura de las LIOen sulcus puede tener ventajas respecto a las de cámara anterior o las suturadas al iris por diferentes razones. Las LIO de cámara anterior (CA) pueden estar contraindicadas en pacientes con glaucoma, iridodiálisis traumática, sinequias anteriores periféricas mayores de 3 horas, lesión corneal severa. Una LIO de CA puede causar además una pérdida importante del endotelio. Esto es un factor importante en gente joven, la población con mayor frecuencia afecta de traumatismos oculares. Una LIO suturada a iris puede originar una disminución de la dilatación pupilar, irritación del iris, pseudofacodonesis, uveitis crónica, edema macular quístico o erosión del iris. Una LIO fijada a nivel del sulcus produce menos iritación de los tejidos circundantes y es la posición más adecuada.
Se han descrito varias técnicas para la fijación en el sulcus de las LIO. Si hay suficiente soporte capsular posiblemente con una sola fijación será suficiente, con un flap escleral triangular en el lado opuesto a los restos capsulares y la fijación en el sulcus se logra mediante una sutura que se inserta transescleralmente cruzando el anillo ciliar a lo largo, aguja recta con sutura de polipropileno o una aguja de 27 o 30 gauges con un hilo. Cuando hay un pequeño resto capsular para la LIO, el flap escleral se realiza en los meridianos de las 3 y de las 9, se practican 2 de las 3 esclerotomías necesarias en la vitrectomía en los mismos meridianos a 2,5 mm del limbo, y se utilizan para recoger la sutura desde el espacio intraocular.
El traumatismo también puede originar luxación de la LIO, por rotura capsular o zonula (fig. 9). En estos casos la técnica de reposición de la LIO es similar a la descrita para la luxación de cristalino, usando perfluoro-n-octano para reflotar la LIO (fig. 10). Las pinzas de calibre 25 desarrollados por Chang y cols, con una plataforma distal para coger una sutura pueden ayudar a la manipulación quirúrgica sujetando la sutura alrededor de los hápticos de la LIO.
TRATAMIENTO DE LAS HERIDAS ABIERTAS PERFORANTES
El tratamiento de las heridas abiertas perforantes, con puerta de entrada y de salida, tambien llamadas de doble penetración del globo ocular, en las que generalmente un cuerpo extraño ha atravesado la cavidad ocular, penetrando en la zona preecuatorial, atravesando la cavidad vítrea y emergiendo fuera del globo ocular a traves de la esclera posterior, puede ser muy complejo. En las heridas penetrantes puras solamente existe una solución de continuidad en la pared ocular, sin puerta de salida.
Las heridas perforantes se han asociado en el pasado a mal pronóstico funcional; De Juan y cols demostraron que este tipo de heridas tenían un peor pronóstico visual que las heridas contusas y las heridas penetrantes; en su estudio sobre 18 ojos afectos de perforación ocular, solamente tres conseguían una agudeza visual de 5/200 o mejor si no se operaban de vitrectomía. El modelo experimental de Topping y cols demostró que inmediatamente después de una perforación del globo ocular, se produce una contracción extensa del vitreo en el trayecto que ha seguido el cuerpo extraño; esta contracción se continua con crecimiento fibroblástico y proliferación a lo largo del trayecto vítreo. Estas alteraciones pueden desembocar en despendimiento de retina traccional o una combinación de desprendimiento de retina traccional y regmatógeno (fig. 11). Estos autores observaron que la herida posterior se cerraba unos 4 días después de haberse producido el trauma. Abrams y cols demostraron que en los traumatismos perforantes la vitrectomía es capaz de frenar la proliferación fibroblástica probablemente por la extirpación del soporte vítreo, y también es capaz de extraer la proliferación fibrocelular y fibrovascular.
El abordaje inicial en el tratamiento de la herida perforante debe dirigirse a cerrar la puerta de entrada. Los intentos de cerrar la herida posterior se deben posponer, ya que la exposición del area afecta es generalmente difícil por localizarse muy posterior, y la manipulación que se precisa para acceder a la rotura escleral puede provocar hipertensión con salida de contenido intraocular a través de la herida e incarceración retiniana-vítrea (fig. 12). Además, la mayoría de estas lesiones posteriores cierran espontáneamente. Por lo tanto, la cirugía vitreorretinana en estos traumatismos perforantes deberá referirse a unos 7 días después de la agresión ocular.
Practicaremos una vitrectomía pars plana por tres vías siguiendo los principios básicos ya comentados (fig. 13). Si el vítreo posterior no está desprendido, practicaremos una disección de la hialoides posterior. Si el humor vitreo está incarcerado en la herida posterior, se deberá cortar alrededor de la herida; se deberá tener sumo cuidado en no provocar reapertura de la herida. Una incarceración retiniana a nivel anterior puede ser tratada sólo con procedimiento escleral. Sin embargo, en ocasiones la tracción provoca un acortamiento notable de la retina, por lo que se deberá practicar desincarceración de la retina, primero intentandolo con PFCL, ya que en ocasiones el peso de este fluido libera la retina de la puerta de entrada; si no se consigue con esta maniobra, se intentará con pinza endoocular y sistema de campo amplio (figs. 14a, 14b, 14c y 14d). Sin embargo, en la mayoría de ocasiones se deberá practicar retinotomía para liberar la retina.
Si la retina está incarcerada en la herida posterior, es frecuente que se haya producido una proliferación epirretiniana en el centro. Se disecará con pinzas y tijeras endooculares para valorar la tracción residual (fig. 15). Si persiste tracción, y la incarceración está cerca de la mácula, se puede intentar liberar la retina traccionando con una pinza; sin embargo generalmente no se consigue, por lo que practicaremos una retinotomía de relajación alrededor de la incarceración (fig. 16). La retinotomía se practicará lo más pequeña posible alrededor de la zona incarcerada, ya que al extenderse la retina, aumenta considerablemente el coloboma retiniano quirúrgico que hemos creado. En algunas ocasiones se ha producido proliferación subretiniana que aún contrae más la incarceración (fig. 17). Disecaremos la proliferación subretiniana fuera de la zona de retinotomía, ya que la disección central puede reabrir la herida. Después de un recambio fluido-aire, se harán dos o tres filas de fotocoagulación alrededor del lugar de la retinotomía (figs. 18a, 18b, 19a y 19b).
Trataremos también las roturas periféricas, que en ocasiones se producen secundarias a la tracción posterior. Una vez se hayan relajado todas las tracciones, reaplicaremos la retina con aire aspirando el fluido subretiniano a través de la retinotomía posterior.
DESGARROS Y DESPRENDIMIENTOS DE RETINA TRAUMÁTICOS
Las roturas de la retina en los ojos traumatizados se desarrollan secundariamente a la distensión ecuatorial del globo ocular. La incidencia de los desprendimientos de retina traumáticos en individuos fáquicos se sitúa en torno al 20%. Cox y cols estudiaron 160 pacientes con desprendimiento de la retina secundario a trauma ocular cerrado, correspondiendo el 60% a roturas a nivel de la ora serrata. En otro estudio de Dumas y cols sobre desprendimientos de la retina posttraumáticos, obsevó que el 84% eran secundarios a diálisis de la ora, 8% secundarios a desgarro gigante, 3% a desgarros en herradura, y 5% a desgarros redondeados. Las dialisis retinianas, todas de extensión superior a una baía de la ora, fueron claramente la causa más frecuente de desprendimiento de retina traumático. La gran mayoría de desprendimientos de retina traumáticos se obsevan en hombres de menos de 40 años. Goffstein y Burton observaron que el 70% del los desprendimientos de retina traumáticos tenían diálisis de la ora, mientras que solamente el 6% de los desprendimientos de retina no traumáticos eran secundarios a diálisis. Las localizaciones más comunes de las diálisis posttraumáticas son temporales inferiores seguidas de superonasales, superotemporales e inferonasales. El cuadrante inferotemporal se afecta entre el 27 y 73% de los casos, y el superonasal entre el 2 y 46% de los casos, según diversos autores (fig. 20).
Las diálisis retinianas generalmente tienen una lenta progresión en inicio y en sintomatología, ya que generalmente se producen en pacientes jóvenes sin sinéresis vítrea. Debido a ello, el acúmulo y progresión del fluido subretiniano es generalmente lento, y en muchas ocasiones se observan líneas de demarcación del desprendimiento de retina pigmentadas y paralelas, que señalas los diferentes estadíos de progresión del desprendimiento. Ross evaluó 50 pacientes con diálisis en ora serrata, situadas en el 72% de los casos en el cuadrante temporal inferior. En este estudio, el 41% de los desprendimientos de retina asociados se diagnosticaron más de 1 año después del trauma. Atribuyeron la mayor frecuencia de diálisis en el cuadrante temporal inferior a la falta de protección orbitaria en esta zona.
Las alteraciones más frecuentemente asociadas a las diálisis de ora traumáticas son las hemorragias vítreas, desprendimientos de pars plana, avulsiones de la base del vitreo, recesión angular y catarata traumática. Debido a que producen desprendimientos de retina muchas veces asintomáticos, también se asocian a líneas de demarcación y formación de macroquistes retinianos.
El tratamiento de las diálisis traumáticas es quirúrgico mediante colocación de procedimiento de indentación escleral circumferencial en la zona de la diálisis. El pronóstico es excelente, siendo la tasa de reaplicación de la retina del 95%, consiguiendolo en una sola operación entre el 87 y 94% de los casos. La recuperación funcional generalmente es excelente, sobre todo en aquellos casos en los que la mácula ha permanecido aplicada. Ross y cols reportaron una visión final de 5/10 o mejor en el 44% de los casos, de 4/10 a 2/10 en el 24% de los casos, y 1/10 o peor en el 32% de los casos.
Los desgarros ecuatoriales posttraumáticos se encuentran en el 36% de los pacientes la mitad de éstos son pequeños, redondos y multiples. La otra mitad son irregulares y de mayor tamaño (figs. 21 y 22)
Otras lesiones menos frecuentes que se pueden observar tras una contusión ocular son las avulsiones de la base del vítreo. Una avulsión de la base del vitreo es practicamente patognomónica de traumatismo ocular, y se asocia frecuentemente a diálisis de la ora (fig. 23).
Se ha comprobado que la presencia de degeneraciones en empalizada periféricas no aumenta el riesgo de desprendimientos de la retina posttraumáticos, la miopía si que se asocia con un mayor riesgo, ya que el 28% de los desprendimientos de retina traumáticos ocurren en pacientes miopes.
Las roturas retinianas de origen traumático sin desprendimiento pueden ser tratadas solamente con fotocoagulación láser. Sin embargo, y debido a que el riesgo de desprendimiento es relativamente alto, en roturas de gran extensión se deberá valorar la colocación de una banda ecuatorial profiláctica. Es preferible la colocación de un procedimiento circunferencial de 360° para sujetar la base del vítreo, ya que estará generalmente lesionada en toda su extensión por la deformación traumática del globo ocular.
El trauma ocular es la segunda causa de desprendimientos de retina por desgarro gigante, es decir desgarros que afecten a más de 90° de la circunferencia del globo ocular. Aproximadamente el 25% de los desgarros gigantes de retina son secundarios a traumatismos del globo ocular. La principal diferencia con los desgarros gigantes del alto miope es que el vitreo adyacente no se licua inmediatamente; debido a ello, no se produce un acúmulo inmediato de fluido subretiniano, ni una inversión del borde. En estos pacientes es importante la cirugía inmediata, por el alto riesgo de proliferación vitreorretiniana, ya que se trata generalmente de pacientes jóvenes, muchas veces el desgarro gigante se asocia a hemorragia vítrea, y existe una amplia superficie de epitelio pigmentario expuesto (figs. 24a, 24b y 24c). El trauma también induce rotura de la barrera hematorretiniana e inflamación, por lo que todos los factores inductores de la proliferación vitreorretiniana están presentes. La técnica quirúrgica incluirá vitrectomía, colocación de un procedimiento circunferencial para soportar la base del vítreo, lensectomía, dependiendo de si se asocia una catarata traumática, subluxación o luxación de cristalino, o proliferación vitreorretiniana. La utilización de sistémas panóramicos de visualización y el uso de perfluorocarbonados líquidos de alta densidad específica ha mejorado notablemente el pronóstico de estos pacientes, al facilitar la reaplicación retiniana. Se practicará fotocoagulación con laser a nivel del límite posterior de la rotura retiniana, preferiblemente después de haber practicado el intercambio por un taponador como el octofluoropropano o aceite de silicona, ya que en el intercambio es posible un discreto desplazamiento del borde posterior de la rotura. Es conveniente siempre reforzar los cuernos del desgarro, porque generalmente es donde se va a reabrir el desgarro, y eliminar la retina anterior al desgarro, ya que como no tiene aporte sanguíneo se necrosará contribuyendo a aumentar la inflamación intraocular.
CUERPO EXTRAÑO INTRAOCULAR (CEIO)
La presencia de un cuerpo extraño intraocular provoca una dificultad adicional en los traumatismos oculares, por el aumento de riesgo de endoftalmitis, hemorragia vítrea, rotura retiniana posterior e incarceración retiniana. En un estudio prospectivo multicéntrico realizado en España entre 1989 y 1991 por el GEMTO sobre 1378 ojos (1314 pacientes) afectos de trauma ocular, 165 ojos presentaban CEIO, lo que supone el 23,6% de los traumas abiertos. Esta incidencia es similar a la constatada en otras series, observando Holland y cols una incidencia del 22% y Boudet del 14%. En el 56% de los casos, la entrada del CEIO se producía como accidente laboral, mientras que el 11.7% eran un accidente de bricolaje doméstico. El 76% eran de naturaleza metálica, seguidos por cristal en los accidentes de tráfico, madera, piedra, plástico u otros materiales.
Los CEIO localizados en el polo posterior son típicamente pequeños fragmentos metálicos que tienen un borde cortante. Los objetos redondeados como los perdigones necesitan gran velocidad y penetración vertical para poder atravesar la pared ocular. Cuando penetran en el globo ocular, debido a su elevada velocidad, provocan una onda expansiva que produce lesiones generalizadas en las estructuras intraoculares, a diferencia de los objetos metálicos punzantes, que puede provocar una lesión localizada. En una serie de 105 ojos con cuerpo extraño intraocular, 76 pacientes (72%) estaban martilleando un metal, 10% habían recibido un disparo con perdigón o balín, 7% eran secundarios a explosión, y el 10% restante a otros mecanismos. En otros estudios entre el 70 y 80% de los CEIO se produjeron al martillear un metal, por lo que es con mucho la causa más frecuente, y el cuerpo extraño es generalmente un fragmento de martillo.
Entre el 80 y el 90% de los CEIO son metálicos. Los metales que se observan con más frecuencia son el hierro, seguido del plomo, pero también se han encontrado cobre, zinc, plata, oro, platino y niquel. Entre el 50% y el 80% de los CEIO son magnéticos. Otros tipos de CEIO incluyen cristal, pestañas, nylon, plastico y madera.
La localización de la penetración ocular puede variar dependiendo del mecanismo del trauma. En el estudio del GEMTO, 54% afectaban la córnea, 32% la esclera, y 14% el limbo esclerocorneal. Williams y cols observaron entrada corneal en el 65% de los ojos, entrada escleral en el 25% y entrada corneoescleral en el 10% de los casos. El tamaño de la herida variaba entre 1 y 12 mm. En el 92% de los casos solamente había un CEIO. En el 61% de los casos estaban alojados en el vítreo, en el 14% en la retina, y en el 5% eran subretinianos. El resto estaban localizados en la cámara anterior (15%) o cristalino (8%).
Los CEIO pueden causar un daño severo en el globo ocular por varios mecanismos: por daño directo en las estructuras que penetran o perforan, por la onda de expansión que lesiona estructuras a distancia, por endoftalmitis, metalosis u otras secuelas. La incidencia de endoftalmitis secundaria a trauma abierto por CEIO varía entre el 7% y el 13%, aunque puede ser tan elevada como del 30% después de contaminación por material orgánico. Thompson y cols observaron cultivos positivos en el 65% de pacientes afectos de CEIO. El 45% de los cultivos positivos correspondían a Estafilococos, mientras que el 36% a la especie Bacillus. Los ojos infectados por Estafilococo tenían un pronóstico visual mucho mejor. Los ojos infectados por Bacillus tienen un extremado mal pronóstico, siendo enucleados un 75% en esta serie, confirmando este mal pronóstico los trabajos de Vahey y Flynn. El riesgo de endoftalmitis aumenta en personas de mayor edad.
Metalosis. En pacientes con CEIO de larga evolución, la composición del material puede jugar un papel más determinante. Materiales relativamente inertes, como aluminio, oro, plata, platino, cristal, plástico y piedra, pueden ser observados simplemente si la visión permanece satisfactoria. Otros CEIO conteniendo hierro, cobre o acero requerirán extracción si la visión disminuye. En su forma clásica la siderosis provoca anisocoria, heterocromía, con oscurecimiento del iris del ojo afecto, depósitos marronosos férricos en el endotelio corneal, catarata marronosa subcapsular anterior, luxación de cristalino, toxicidad retiniana y atrofia óptica. El electroretinograma es útil en la monitorización de estos pacientes con cuerpos extraños férricos de larga evolución. Inicialmente las ondas A y B son normales a la estimulación con flash, pero al cabo de varios meses la amplitud disminuye. Se ha propuesto un modelo de radicales de oxígeno libre como el mecanismo fisiopatogénico que provoca las lesiones retinianas que se traducen en cambios electrofisiológicos. Cuando éstos se producen, el pronóstico visual es severo ya que la siderosis está muy evolucionada. Sin embargo, si el CEIO es intrarretiniano y está encapsulado por tejido fibroso, el riesgo de siderosis disminuye notablemente.
La metalosis producida por el cobre (calcosis) es similar a los cambios observados en la degeneración hepatolenticular, y se observan cuando el contenido en cobre del CEIO es superior al 85%. Se incluyen el anillo corneal de Kayser-Fleischer, catarata subcapsular anterior en girasol, decoloración verdosa de iris y vítreo, y depósitos refráctiles en la membrana limitante interna retiniana, aveces asociados a una capa verdosa transparente.
TRATAMIENTO
Aunque algunos CEIO se han relacionado con un peor pronóstico funcional si se dejan en el interior del globo ocular, estudios más recientes sugieren que se debe realizar una cirugía inmediata en cualquier CEIO, sea cual sea su composición. El pronóstico dependerá de la AV inicial, de la lesión macular-papilar, y del tamaño de la herida. Sin embargo, la composición del CEIO puede contribuir en algunas ocasiones a empeorar el pronóstico funcional final. Clásicamente el cobre intraocular provoca una inflamación severa y aguda, denominada calcosis, requiriendo intervención urgente. Estas reacciones a cuerpo extraño, sin embargo, no se observan frecuentemente en la actualidad, debido a los tratamientos antiinflamatorios utilizados. Los CEIO de materia orgánica, como las pestañas, pelos o madera, provocan un elevado riesgo de endoftalmitis bacteriana o fúngica.
Los cuerpos extraños metálicos magnéticos, que son los más frecuentes, permanecen relativamente inertes las primeras semanas, pero también tienen riesgo de endoftalmitis. Thompson y cols analizaron 492 ojos con CEIO, observando que un retraso de 24 horas en la extracción del CEIO, multiplica por cuatro el riesgo de endoftalmitis, pasando de 3,5% a 13,4%. Corroboraron Mieler y cols la reducción del riesgo de endoftalmitis con la cirugía en un estudio de 27 pacientes con CEIO, en los que observaron cultivos positivos en 7 pacientes. Los 7 pacientes fueron intervenidos de urgencia con extirpación del CEIO y ninguno de ellos desarrolló endoftalmitis.
El desarrollo de las nuevas técnicas de cirugía intraocular ha permitido un mejor abordaje de los CEIO, una mejor localización y extracción controlada, así como reducción de el riesgo de endoftalmitis, con la extracción del material que se ha introducido en el globo ocular.
Un paciente que acude a urgencias por CEIO deberá tratarse inicialmente con los mismos principios que un paciente con un ojo con penetración ocular. Se deberá practicar profilaxis antibiótica de endoftalmitis, con Vancomicina y Ceftazidina intravítrea, que cubre la mayoría de microorganismos que provoca la endoftalmitis en presencia de CEIO, icluyendo la especie Bacillus. La ciprofloxacina oral alcanza niveles terapéuticos intraoculares en un ojo inflamado, y puede utilizarse como alternativa, si el riesgo de endoftalmitis es bajo. Inmediatamente el paciente deberá ser intervenido. Aplicaremos 2 principios quirúrgicos: 1- Extracción controlada del cuerpo extraño. 2- Minimizar el trauma quirúrgico.
El primer paso será restaurar la integridad del globo ocular, excepto en aquellos casos en los que el gran tamaño del cuerpo extraño obligue utilizar la puerta de entrada para su extracción. Si el ambiente quirúrgico (ausencia de instrumentistas especializadas, cirujano no experto en cirugía vitreoretiniana, horario nocturno) no es el adecuado, será preferible suturar la puerta de entrada y diferir la vitrectomía con extracción del CEIO unas horas (máximo 24 horas) hasta que se consiga el entorno óptimo para conseguir el mínimo trauma quirúrgico y la máxima eficacia.
Se deberán aclarar los medios mediante lensectomía o vitrectomía. Si el CEIO ha entrado a través de la córnea, generalmente existirá catarata con perforación de cápsula anterior y posterior. Si no se ha producido desprendimiento de retina, se procederá a la extracción de masas cristalinianas con vitrectomo, intentando preservar las cápsulas para posterior colocación de una LIO en sulcus. Si la opacificación corneal evita la adecuada visualización del segmento posterior, deberemos emplear una queratoprotesis temporal.
Generalmente se produce incarceración vítrea en la puerta de entrada cuando la herida se sitúa a más de 3 mm del limbo. Deberemos liberar esta tracción mediante vitrectomía amplia y explorar la perifería de la retina (figs. 25a y 25b). Es muy útil la utilización de sistemas panorámicos de visualización, ya que nos ayudan en esta exploración periférica (fig. 26). Procederemos seguidamente a disecar la hialoides posterior, en donde en muchas ocasiones está alojado el cuerpo extraño. En pacientes jovenes, si se practica cirugía precoz, generalmente la hialoides estará aplicada. El riesgo de proliferación encima de la hialoides y formación de membrana epimacular postoperatoria es alto si no se extirpa (fig. 27). Seguidamente se abordará el CEIO; distinguiremos 3 situaciones diferenciadas:
1. CEIO sobre la retina. A pesar de estar sobre la retina, la alteración y blanqueamiento de la hialoides posterior produce una pseudocápsula. Sin embargo al disecar la hialoides posterior, el cuerpo extraño se movilizará facilitandose su extracción
2. CEIO intraretiniano encapsulado. En ocasiones se ha producido una encapsulación fibrinosa o fibrosa alrededor del CEIO, que se deberá extirpar. Esta cápsula se produce cuando la extracción se demora más de 10 días, sin embargo su formación no es constante y depende de la inflamación ocular asociada. Generalmente utilizamos un microbisturí en forma de lanceta para abrir la cápsula y posteriormente con pinzas o con dos instrumentos activos utilizando pinzas y tijeras liberaremos el CEIO (figs. 28a, 28b, 28c, 28d y 28e).
3. CEIO subretiniano. Los cuerpos extraños subretinianos son en ocasiones de difícil extracción por la fibrosis acompañante y por el compromiso vascular coroideo. Su extracción puede provocar rotura arterial coroidea y desprendimiento coroideo hemorragico. Se extraerán a través de la retinotomía que han producido, si bien en algunos casos con cicatrización retinana, pueden requerir una recolocación subretinana para su extracción a través de una retinotomía alejada de la mácula y papila.
Una vez liberado el CEIO, se ampliará la esclerotomía circunferencialmente hasta conseguir una puerta de salida del CEIO lo suficientemente amplia, ya que si es justa se quedará incarcerado en la esclerotomía o volverá a caer al interior de la cavidad vítrea durante su extracción, pudiendo lesionar la retina posterior, alargando innecesariamente el tiempo quirúrgico y aumentando la yatrogenia. Utilizando un endoimán si se trata de un cuerpo extraño magnético, captaremos el cuerpo extraño, llevandolo al centro de la cavidad vítrea. Seguidamente con una pinza de extracción de CEIO, si éste es relativamente grande (superior a 2 mm), o bien con una pinza de extracción de membranas epirretinianas si es pequeño, lo cogeremos firmemente de manera que el diámetro más pequeño coincida con el eje de la pinza, para poder extraerlo con mayor facilidad. En el momento de la extracción aumentaremos discretamente (30-40 mmHg) la presión intraocular, para que si se suelta de la pinza en la esclerotomía, la presión intraocular lo escupa hacia fuera (figs. 29a, 29b, 29c, 29d y 29e). Esta maniobra con endoimán y pinza se puede realizar con la luz del microscopio, si bien es más cómodo realizarla con la ayuda de una luz endoocular accesoria que se situa generalmente en la cánula de infusión (figs. 30a, 30b, 31a y 31b). Se ha sugerido la utilización de perfluorocarbonos líquidos para proteger la mácula durante la extracción. Sin embargo, los cuerpos extraños metálicos magnéticos tienen una densidad específica superior a los perfluorocarbonos, por lo que caerán al polo posterior, aunque con una velocidad atenuada. Nuestra experiencia con los PFCL y cuerpos extraños metálicos magnéticos es que no disminuyen el riesgo y aumentan la manipulación, por lo que no los utilizamos. Con los cuerpos extraños más ligeros, pueden caer en el menisco que deja el PFCL y la retina, complicando su extracción y aumentando el riesgo de lesión retiniana.
El uso de un electroimán externo ha sido muy extendido en la extracción de CEIO. El principal inconveniente de estos electroimanes es que generan un campo magnético no siempre controlable, e imprimen velocidad al CEIO magnético, pudiendo lesionar estructuras intraoculares, principalmente la retina si está mal localizado. Además producen una tracción vítrea en el lugar de la extracción, que puede provocar proliferación vitreoretinana y desprendimiento de retina en el postoperatorio. Debido a ello, preferimos practicar vitrectomía para eliminar el soporte anatómico de la proliferación, que según el modelo experimental de Clearly y Ryan puede aparecer en 2 semanas. Solamente lo utilizaremos como procedimiento aislado en aquellos CEIO que estén enclavados anteriores a la ora serrata: practicaremos una incisión circunferencial en el lugar del enclavamiento, seccionaremos el cuerpo ciliar con tijera, y colocaremos el electroimán que captará el CEIO.
Los CEIO no magnéticos se extraerán utilizando pinzas de cuerpo extraño, tras la descapsulación si están encapsulados. Se puede utilizar una técnica con 2 pinzas para situar el CEIO en el meridiano de menor sección para su extracción. Los CEIO con diámetro menor superior a 5mm pueden requerir su extracción a través de la puerta de entrada o a través del limbo. Son difíciles de manipular, y provocar una desestructuración importante del globo ocular, pudiendo añadir nuevas lesiones en su extracción. Son generalmente de naturaleza metálica o cristal. Practicaremos una incisión a nivel del limbo y con unas pinzas se pasará a través de la pupila, hasta que otras pinzas lo fijen a través del limbo, con las que se extraerá del globo ocular.
Si la rotura inducida por el CEIO en la retina-coroides es pequeña y posterior, situándose cerca del area macular, es preferible no practicar endofotocoagulación alrededor por el riesgo de tracción macular en el postoperatorio. Si la lesión se sitúa fuera de las arcadas temporales, se puede practicar fotocoagulación alrededor de la rotura, preferentemente con láser de diodo, ya que en muchas ocasiones existe hemorragia alrededor de la rotura, y el láser infrarrojo atraviesa mejor la hemoglobina. Al final del procedimiento se introducirá un gas de corta-media duración (aire ó SF6 al 25%) en la cavidad vítrea que actuará como taponador temporal. Si el CEIO se asocia a desprendimiento de retina, proliferación vitreorretiniana, incarceración, o cualquier otra patología, se tratará como ya se ha comentado en los traumas penetrantes.
PRONÓSTICO VISUAL
Debido a que la mayoría de los CEIO son pequeños y punzantes, y las heridas que provocan en la pared ocular son pequeñas, el pronostico visual en la mayoría de los casos es bueno, si se extraen con prontitud La visión final dependerá de la visión en el momento de la exploración preoperatoria y de la lesión ocular asociada, más que de la naturaleza del CEIO. Williams y cols, en un estudio sobre 105 CEIO observaron una agudeza visual final de 20/40 o mejor en el 63% de los pacientes, mientras que el 14% tenía una visión inferior a 5/200. El 6% en este estudio tuvieron que ser finalmente enucleados. Behrens-Baumann y Pretorius observaron que el 57% de 297 ojos con CEIO retuvieron una visión de 20/40 o mejor, mientras que el 20% tenía una visión de 20/200 o peor. 5% de los casos tuvieron que ser enucleados después de la extracción del CEIO, mientras que 20% tuvieron que ser enucleados cuando no se pudo extraer el CEIO.
Los factores que condicionan la agudeza visual se correlacionan directamente con la lesión en el globo ocular (fig. 32). Según Williams y cols los factores que condicionaban un pronóistico faborable (AV 20/40 o superior), eran una AV inicial de 20/40 o mejor, y solamente una o 2 intevenciones quirúrgicas. Los factores que condicionaban una mala AV eran una AV inicial inferior a 5/200 y una herida superior a 4mm. El pronóstico era particularmente pobre cuando el cuerpo extraño era un perdigón o era esférico, con 5 de cada 6 ojos acabando con una AV de movimiento de manos o inferior. De Juan y cols (73) observaron los mismos malos resultados con objetos redondos como los perdigones. La lesión por contusión y onda expansiva de los objetos no punzantes produce más lesión que el mismo CEIO. Neubauer y cols observaron que la visión final era considerablemente mejor cuando el CEIO era inferior a 2 mm.
PROLIFERACIÓN VITREORRETINIANAAL TRAUMATISMO ABIERTO
TRATAMIENTO DE LA PROLIFERACIÓN VITREORRETINANA ANTERIOR
La proliferación vitreorretiniana anterior, es decir anterior a la inserción posterior de la base del vítreo, se observa con frecuencia en los traumatismos abiertos con heridas esclerales anteriores.Es infrecuente en pacientes con desprendimiento de retina no traumático que no han sido previamente intervenidos de vitrectomía. El tratamiento quirúrgico de esta proliferación fue descrito metódicamente en 1988 y ha mejorado sustancialmente con los nuevos avances técnicos, incluyendo el uso de los PFCL. Previa colocación de un procedimiento escleral circunferencial en la base del vítreo, extraeremos la proliferación anterior con técnica bimanual, utilizando pinza y tijeras curvas o de angulo recto, iluminando el campo con una luz accesoria en la cánula de infusión o en una cuarta esclerotomía. Si introducimos una burbuja de PFCL en el polo posterior, la retina se estabiliza y nos facilita la disección. En algunos casos de contracción anteroposterior, podemos utilizar el vitrectomo o un microbisturí para disecar el puente de unión entre la retina ecuatorial y la pars plana; sin embargo, en la mayoría de ocasiones precisaremos de la técnica bimanual. En ocasiones el endosopio nos ayudará a evaluar el grado de contracción y los puntos de mayor tracción.
Si no se ha conseguido relajar el componente traccional con la disección anterior, debemos practicar retinotomías-retinectomías de relajación. Es importante la extirpación de la retina anterior a la retinotomía, ya que es tejido avascular, y su necrosis inducirá inflamación y recidiva de la proliferación.
TRATAMIENTO DE LA PROLIFERACIÓN EPIRRETINIANA POSTERIOR
La proliferación epirretiniana posterior se disecará utilizando técnicas estándar de disección, incluyendo picas, pinzas, espátulas y tijeras esencialmente. Se iniciará la disección desde la parte posterior a la anterior, utilizando el mayor grosor y firmeza de la retina posterior, traccionando de la membrana radialmente a la papila, para encontrar una resistencia de contratracción. Cuando la adherencia entre membrana y retina es íntima y existe riesgo de rotura retinana con la tracción, utilizaremos una técnica bimanual con pinzas y tijeras. Esta mayor adherencia es frecuente en individuos jóvenes afectos de trauma abierto. Podemos utilizar PFCL para identificar los lugares de tracción, y estabilizar la retina durante la disección de las membranas.
TRATAMIENTO DE LA PROLIFERACIÓN SUBRETINIANA
La incidencia de proliferación subretinana es superior en los desprendimientos de retina asociados a trauma abierto que en los desprendimientos primarios,observándose también en los desprendimientos de larga evolución y asociados a inflamación intraocular. Las membranas subretinanas generalmente no impiden la reaplicación retiniana, debiendose extraer solamente en contadas ocasiones. Después de una meticulosa disección de la proliferación epirretiniana anterior y posterior, se comprobará el grado de extensibilidad de la retina con perfluorocarbono líquido y aire, y solamente si existe tracción subretiniana, se extraerán estas membranas. En algunos casos, la presión ejercida por el PFCL y el aire es suficiente para romper los puentes de unión entre las membranas y la retina y relajar la tracción subretiniana. Se realizará la disección mediante una retinotomía localizada. Practicaremos diatermia adyacente a la membrana, para marcar la localización de la retinotomía para mejor localización y tratamiento con láser cuando se haya reaplicado la retina. Practicamos una incisión en la retina siguiendo el trayecto de las fibras nerviosas; Con unas pinzas realizaremos tracción sobre la membrana para determinar la adherencia de la membrana, y en algunas ocasiones se liberará de la retina, y si la membrana tiene configuración en anillo, será necesaria la practica de disección más extensa, generalmente con dos instrumentos, y a través de una retinotomía amplia, con inversión de la retina (figs. 33a, 33b, 34a y 34b).
Aunque los recientes avances en el conocimiento del pronóstico y las consecuencias de las lesiones traumáticas oculares en conjunción con las innovaciones en las técnicas microquirúrgicas vitreoretinianas proveen al oftalmólogo de un armamento para tratar estos casos optimamente, aproximadamente un 40% de los pacientes tendrán un handicap visual final a pesar de la mejor intervención medica y quirúrgica, en una edad laboral y personal que hacen que los traumatismos laborales sean una de las principales lacras sanitarias de nuestra sociedad. Debido a ello se deberán seguir el máximo de medidas de prevención en el trabajo y en el hogar para evitar la lesión ocular traumática.
BIBLIOGRAFÍA