
Dres. Gil Carrasco F, Paczka JA, Jiménez Román J, Gilbert Lucido ME, De los Ríos D, Sánchez Castellanos VE
Servicio de Galucoma. Asociación Para Evitar la Ceguera en México. Hospital «Dr. Luis Sánchez Bulnes»
Introducción
El empleo de tubos aloplásticos que llevan el humor acuoso desde la cámara anterior hasta reservorios ecuatoriales ha alcanzado un éxito notablemente bueno en ojos con glaucoma incontrolable (1). La evolución de los dispositivos derivadores de acuoso ha incluido desde los setons translímbicos (2-5) hasta las nuevas válvulas unidireccionales sensibles a la PIO (6-9). La presencia de un sistema valvular incorporado a un aparato artificial corto-circuito representa una ventaja ya que minimiza el riesgo de una hipotonía profunda y el aplanamiento de la cámara anterior durante el período postoperatorio inmediato, antes.de que se complete el encapsulamiento alrededor del exoplante epiescleral (8). En el presente estudio se reporta la experiencia inicial con el uso de un relativamente nuevo dispositivo para drenar acuoso en casos de glaucoma refractario, la válvula de Ahmed.
Pacientes y métodos
Dispositivo
La válvula de Ahmed (New World Inc., California. E.U.A.) es un dispositivo artificial que drena el humor acuoso hacia el espacio conjuntival a través de un tubo de silicón (diámetro externo de 0,60 mm, diámetro interno de 0,30 mm) que se encuentra unido a un plato de polipropileno con una superficie de 184 mm2 (13 x 16 mm). Este plato contiene un mecanismo valvular del tipo venturi-flow, el cual teóricamente se colapsa en el aire a una presión crítica de 8-10 mm Hg. El borde del plato posee dos orificios para la inserción de las suturas esclerales de fijación. El tubo abre hacia la superficie superior del plato. Este dispositivo establece una vesícula filtrante ecuatorial.
Técnica quirúrgica
Bajo condiciones de esterilidad y empleando una cánula fina de punta roma (g-27), se irrigó solución salina balanceada a través de la apertura distal del tubo de silicón de los implantes valvulares de Ahmed con el objeto de asegurar el flujo de líquido hacia la superficie anterior del plato.
Se emplearon cualquiera de los cuadrantes (nasal o temporal) para fijar el implante. Se disecó un colgajo conjuntivo-tenoniano base fórnix, extendiéndolo aproximadamente 90·. Esta incisión frecuentemente requirió de incisiones relajantes para facilitar adecuadamente la exposición escleral para la colocación del exoplante. El plato de polipropileno se insertó aplicando la superficie cóncava contra la esclera. Se usó una sutura de seda 7-0 doble armada para fijar el plato a la esclera de tal manera que el margen anterior del exoplante se encontrara a 8 mm del limbo. El tubo se alineó de manera radial y luego se seccionó dejando un bisel superior, de tal manera que el tubo se extendiera 2 mm desde el limbo. Se introdujo una aguja hipodérmica calibre 9-23 hacia el interior de la cámara anterior, creando un trayecto estrecho. Este trayecto dentro del tejido esclero-corneal era paralelo al plano y se establecía con una longitud de 34 mm. En seguida el tubo se insertó a través del trayecto. Se prestó particular atención a la localización del tubo en la cámara anterior. No se aplicó ningún tipo de parche biológico para cubrir el tubo. El colgajo conjuntival se cerró con un surgete continuo con nylon 10-0 o con puntos simples con seda 7-0. Al final del procedimiento, se inyectó una dosis subconjuntival de dexametasona sódica y se instilaron algunas gotas de atropina al 1%. La terapia tópica postoperatoria incluyó un corticoesteroide (sulfato de dexametasona o acetato de prednisolona) cada 1 a 3 horas, y un antibiótico (sulfacetamida sódica o sulfato de neomicina). Las dosis de éstos agentes fueron disminuyendo en la proporción en la que la inflamación postoperatoria cedía.
Pacientes
Durante el período comprendido entre junio de 1993 y febrero de 1995, se operaron 278 ojos con una capacidad visual de al menos percepción luminosa, con glaucoma de etiología diversa, incontrolable con medicamentos antiglaucomatosos. Todos los pacientes habían firmado un consentimiento informado para la realización del procedimiento. Todos los pacientes fueron monitorizados por al menos 9 meses (media 14,6 ± 5,1 meses, rango 9-28).
Categorías de evolución quirúrgica
Los parámetros de éxito quirúrgico se describen en la tabla I. Las PlOs y agudezas visuales finales registradas de los pacientes categorizados con evoluciones exitosas o fracasadas calificadas fueron aquellas obtenidas de las exploraciones más recientes en la Institución. En los pacientes categorizados como con evoluciones con fracaso completo, las PlOs y agudezas visuales fueron las registradas en las fechas en las que se recomendó una cirugía ulterior para glaucoma o cuando sucedió una complicación devastadora.

Análisis estadístico
Toda la información fue codificada y compilada en una hoja electrónica y posteriormente analizada con un paquete comercial de estadística (Statistica, 1993, Statsoft, Tilsa, OK).
En los casos bilaterales, se excluyó de manera aleatoria a uno de los ojos con objeto del procesamiento estadístico. Los resultados se expresaron como media ± desviación estándar. Para el análisis estadístico se realizaron pruebas t de Student cuando fueron apropiadas. Se consideró a una p menor a 0,05 como una diferencia estadísticamente significativa. Para evaluar el éxito se usaron los métodos convencionales así como una estimación de la función de sobrevida de las evoluciones quirúrgicas a través del estimador del producto límite de Kaplan Meier.
Resultados
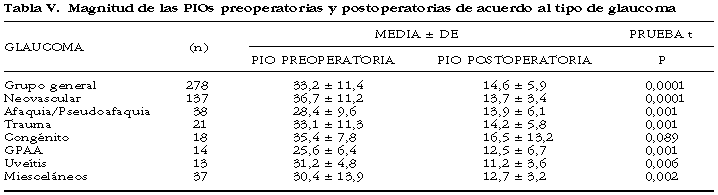
La cirugía se llevó a cabo en el cuadrante supero-temporal en 266 ojos y en el inferotemporal en 12 ojos. Se realizaron 205 procedimientos (74%) por uno de nosotros (FGC). No se encontró dificultad técnica alguna con la colocación del tubo en la cámara anterior. Los rasgos demográficos y generales de los pacientes se describen detalladamente en la tabla II. El diagnóstico clínico incluyó varios tipos de glaucoma: glaucoma neovascular (137 ojos), glaucoma asociado a afaquia y pseudofaquia (38 ojos), glaucoma traumático (21 ojos), glaucoma congénita (18 ojos), glaucoma primario de ángulo abierto (14 ojos), glaucoma asociado a uveítis (13 ojos), y glaucomas misceláneos (37 ojos).
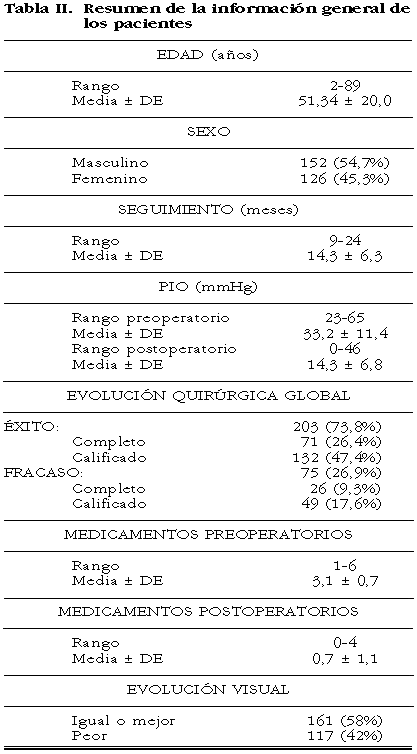
Se practicaron un total de 104 procedimientos de glaucoma (láser y cirugía) antes de la colocación de la válvula de Ahmed. Doce procedimientos (4,3%) fueron iridotomías con láser Nd:YAG, 5 (1,8%) fueron trabeculoplastias con láser de argón, y 2 (0,7%) fueron ciclofotocoagulación con láser diodo. Cincuenta y nueve ojos (21,2%) fueron sometidos previamente a trabeculectomía previa (con o sin terapia coadyuvante con mitomicina C), 13 (4,7%) fueron goniotomías, 10 (3,6%) fueron ciclocrioterapias, y 3 (1,0%) fueron esclerectomías. Ninguna de las trabeculectomías pre-implante recibieron 5-fluoracilo.
En veinticuatro ojos (8,6%) se realizó vitrectomía, 9 ojos (3,2%) recibieron un cerclaje escleral, 8 ojos (2,9%) tuvieron previamente una queratoplastia penetrante con injerto claro. De los ojos sometidos a cirugía vítreo-retiniana, en 2 ojos (0,7%) se administró silicón en el segmento posterior.
De los ojos con glaucoma neovascular, el diagnóstico más común, 86 ojos (62,8%) padecían retinopatía diabética proliferativa, 41 (29,9%) tuvieron una oclusión vascular de la retina, y 10 (7,3%) tuvieron diversas causas de neovascularización. Setenta y ocho ojos (56,9%) fueron fotocoagulados parcial o totalmente.
La proporción de complicaciones postoperatorias se resumen en la tabla III. Ocurrieron un total de 291 complicaciones en 191 ojos (68,7%) después de la colocación de la válvula de Ahmed.
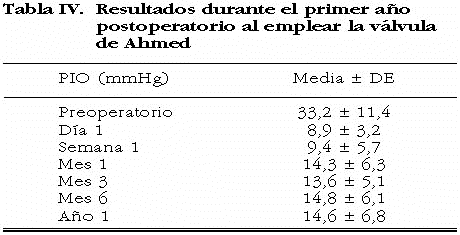
Se muestra en la tabla IV y la figura 1 el control postoperatorio de la PIO durante el período inmediato. Los valores pre y postoperatorios de PIO de acuerdo al tipo de glaucoma se describen en la tabla V.
El análisis de sobrevida de éxito para toda la población estudiada demostró una disminución continua a lo largo del tiempo, con un tiempo de falla al percentil 50 de aproximadamente 625 días. La probabilidad acumulada de éxito a 12 meses fue de 81% (figura 2).
Discusión
El presente estudio ha mostrado que la válvula de Ahmed es efectiva para reducir la PIO a corto plazo (de una PIO preoperatoria de 33,2 ± 11,4 mm Hg a una PIO media postoperatoria después de un mes de cirugía 14,3 ± 6,3 mm Hg en esta serie).
Esta nueva generación de sistemas valvulares permite la colocación de un dispositivo en una sola etapa que potencialmente elimina la necesidad de una segunda operación, asegura un control más rápido de la PIO al eliminar el período de glaucoma descontrolado durante el intervalo de una técnica de dos etapas. Adicionalmente, reduce la magnitud de la fase hipertensiva que puede observarse después de completada la técnica de dos estadios (8-9).
La válvula de Ahmed forma una vesícula de forma análoga a la de otros dispositivos pero puede ofrecer otras ventajas. Para su implantación, éste dispositivo requiere únicamente de una incisión conjuntival de un cuadrante, lo cual simplifica el procedimiento de inserción. El perfil reducido asociado al sistema valvular no obstructivo de membranas, regula de manera predecible la PIO sin necesidad de suturas restrictivas. A pesar de ello, el funcionamiento del mecanismo valvular requiere suficiente producción de humor acuoso para lograr una PIO similar a la presión de apertura del dispositivo. Virtualmente, no existe flujo de acuoso a través de la válvula cuando la PIO se encuentra por debajo de 8 mm Hg. Aunque la hipotonía no fue erradicada de la presente serie, ésta condición no se asoció a un aplanamiento recalcitrante de la cámara anterior. El mecanismo valvular que limita el flujo de acuoso es útil para mantener presiones aceptables. En 10 ojos con un drenaje excesivo de acuoso durante la fase postoperatoria inmediata resultó en cámara plana y contribuyó al desarrollo de una porción de los casos con desprendimiento coroideo. Estas condiciones pueden atribuirse a los efectos combinados de la descompresión brusca del procedimiento, así como al trauma quirúrgico. No puede desecharse la posibilidad de fuga de acuoso alrededor de algunos de los tubos implantados; sin embargo, éstas complicaciones tuvieron un curso benigno y la mayoría de ellos se resolvieron con una conducta conservadora.
El éxito quirúrgico global fue de aproximadamente 81% en este heterogéneo grupo de pacientes, similar a los resultados de otros estudios de implantes; aunque el número de pacientes, criterios de éxito y longitud de seguimiento muestra una amplia variación. Estas diferencias interestudio hacen difícil comparar con exactitud las proporciones de éxito entre los diversos reportes de implantes (6-8, 11-19). En el estudio de Coleman y colaboradores (20), en el que se evaluó prospectivamente la evolución clínica de 68 ojos sometidos a la colocación de válvula de Ahmed, se reportó una probabilidad acumulada de éxito a los 12 meses del 78%, porcentaje similar al observado en nuestra serie.
El control de la PIO depende del tipo de glaucoma. En el presente reporte, las PlOs postoperatorios más elevados ocurrieron en ojos de glaucomas congénitos y misceláneos; los valores más bajos se observaron en el grupo de glaucoma asociado a uveítis. Los ojos con glaucoma congénito y asociado a uveítis parecen tener un pronóstico menos adecuado para el control de la PIO. Mermoud et al 19 encontraron que los éxitos más altos ocurrieron en los ojos con glaucoma de ángulo abierto o ángulo cerrado, ya fueran fáquicos o afacos/pseudofacos, y los éxitos más bajos sucedieron en ojos con glaucoma neovascular.
Aún cuando ésta experiencia inicial es alentadora ya que demostró que la válvula de Ahmed es efectiva y relativamente segura para disminuir la PIO, los resultados a mediano y largo plazo relacionados al control de la PIO, la preservación de la visión y el alivio de los síntomas son necesarios para evaluar adecuadamente este nuevo dispositivo.
Resumen
Propósito: Presentar los resultados clínicos iniciales de la implantación de la Válvula de Ahmed en 208 ojos con glaucoma incontrolable.
Métodos: El dispositivo es un implante para glaucoma que drena el humor acuoso, que contiene un sistema valvular unidireccional que produce cierta resistencia a la salida del humor acuoso. Se evaluaron de manera retrolectiva 208 ojos con glaucoma refractario de etiología diversa que fueron sometidos a la colocación de válvula de Ahmed.
Resultados: La presión intraocular (PIO) preoperatoria promedio (± desviación estándar) de 33,2 ± 11,4 mm Hg fue reducida (p= 0,0001) a 14,3 ± 6,3 mm Hg en el primer mes postoperatorio. 101 ojos (73,7%) tuvieron evoluciones clínicas consideradas con éxito global (PIO < 22 mm Hg y > 5 mm Hg sin cirugía adicional de glaucoma, ni complicación ocular devastadora o pérdida de la percepción luminosa). La probabilidad acumulada de éxito a 12 meses fue de 81%. El tiempo de seguimiento fue de al menos 9 meses (media 14,6 ± 5,1 meses). Las agudezas visuales permanecieron sin cambio al compararse con las preoperatorias o mejoraron en el 58% de los pacientes. Las complicaciones postoperatorias más frecuentes fueron: desprendimiento coroideo transitorio asociado a hipotonía (24,8%) e hipema (16,5%).
Conclusiones: La experiencia clínica inicial actualmente reportada con la válvula de Ahmed demostró que este dispositivo puede ser una alternativa efectiva y relativamente segura para disminuir la PIO cuando las circunstancias demandan el empleo de un aparato artificial para el control de glaucomas refractarios.
Bibliografía
1. Kak LJ: Tube shunts for refractory glaucoma. En: Tasman W, Jaeger DE, editors. Duane's Clinical Ophthalmology. Philadelphia: JB Lippincott, 1993: 1-14.
2. Troncoso MU: Use of tantalum implants for inducing a permanent hypotony in rabbit eyes. Am J Ophthalmol. 1949; 32: 499-506.
3. Bock CK: Subconjunctival draining of the anterior chamber by a glass seton. Am J Ophthalmol; 1950; 33: 929-935.
4. Muldoon WE, Ripple PH, Wilder HC: Platinum implant in glaucoma surgery. Arch Ophthalmol. 1950; 45: 666-672.
5. Kuljaca Z, Ljubojevic, Momirov D: Draining implant for neovascular glaucoma. Am J Ophthalmol. 1983; 96: 372-376.
6. Hitchings RA, Joseph NH, Sherwood M et al.: Use of one-piece valved tube and variable surface area explant for glaucoma drainage surgery. Ophthalmology. 1987; 94: 1.079-1.084.
7. White TC: Clinical results of glaucoma surgery using the White glaucoma pump shunt. Ann Ophthalmol; 24: 365-373,1992
8. The Krupin Eye Valve Filtering Surgery Study Group: Krupin Eye Valve with disk for filtration surgery. Ophthalmology. 1994; 101: 651-658.
9. Molteno ACB, Van Bijon G, Ancker E: Two-stage insertion of glaucoma drainage implants. Tran Ophthalmol Soc NZ. 1979; 31: 17-26.
10. Williams AS: Setons in glaucoma surgery. En: Allingham RR, Bellows AR, Richter CU, editors. Principles and practice of ophthalmolgy. Glaucoma. Philadelphia, WB Saunders. 1994: 1.655-1.667.
11. Krupin T, Kaufman P, Mandel Al, Tery SA: Long-term results of valve implants in filtering surgery for eyes with neovascular glaucoma. Am J Ophthalmol; 1983; 95: 775-782.
12. Schocket SS, Nirankari VS, Lakhanpal V, Richards RD, Lerner BC: Anterior chamber tube shunt to an encircling band in the treatment of neovascular glaucoma and other refracttory glaucomas. A long-term study. Ophthalmology. 1985; 92: 553-562.
13. McDonnell PJ, Robin JB, Schanzlin DJ: Molteno implant for control of glaucoma in eyes after penetrating keratoplasty. Ophthalmology. 1988; 95: 364-369.
14. Minckler DS, Heuer DK, Hasty B, Baerveldt G, Cutting RC, Barlow WE: Clinical experience with the single plate Molteno implant in complicated glaucoma. Ophthalmology. 1988; 95: 1.181-1.188.
15. Beebe WE, Starita RJ, Fellman RL, Lynn JR, Gelender H: The use of Molteno implant and anterior chamber tube shunt to encircling band for the treatment of glaucoma in keratoplasty patients. Ophthalmology. 1990; 97: 1.414-1.422.
16. Freedman J, Rubin B: Molteno implants as a treatment of refractory glaucoma in black patients. Arch Ophthalmol. 1991; 109: 1.417-1.420.
17. Lloyd MA, Heuer DK, Baerveldt G, Minckler DS, Martone JF, Lean JS, et al.: Combined Molteno implantation and pars plana vitrectomy for neovascular glaucomas. Ophthalmology; 1991; 98: 1.401-1.405.
18. Heuer DK, Lloyd MA, Abrams DA, et al.: Which is better? One or two? A randomized clinical trial of single-plate versus double-plate Molteno implantation for glaucomas in aphakia and pseudophakia. Ophthalmology. 1992; 99: 1.512-1.519.
19. Mermoud A, Salmon JF, Alexander P, Straker C, Murray ADN: Molteno tube implantation for neovascular glaucoma. Lomg-term results and factors influencing the outcome. Ophthalmology. 1993; 100: 897-902.
20. Coleman AL, Hill R, Wilson MR, et al.: Initial clinical experience with the Ahmed Glaucoma Valve Implant. Am J Ophthalmol. 1995; 120: 23-31.