
Dres. Rodríguez-Galietero A1, Quijada A1, Muñoz Ruiz G1, Belda Sanchís JI1, Díaz-Llopis M2
(1) Servicio de Oftalmología.
Hospital Universitario La Fe de Valencia.
(2) Profesor Titular de Oftalmología. Universidad del País Vasco.
Introducción
Inoculando al animal experimental homogeneizados de tejidos oculares o antígenos externos es posible inducir inflamación ocular. La utilización de «Modelos Experimentales de Inflamación Ocular» ha permitido demostrar la autoinmunidad específica de los tejidos oculares. Estudiar la fisiopatología de las uveítis endógenas y reproducir modelos de inflamación e infección ocular al conseguirse con su empleo:
Inducir uveítis en el animal de laboratorio semejantes a las que se producen en humanos, mediante la inoculación de antígenos y coadyuvantes conocidos.
«Trasladar» la inflamación de un animal a otro inoculando extractos de ganglio linfático (no suero). Ello ha permitido definir el papel de los linfocitos T como mediadores inmunológicos principales e indispensables de las uveítis endógenas.
Ensayar fármacos que actúen sobre el sistema inmune: inmunosupresores, corticoides, inmunorreguladores y antioxidantes.
Desarrollar inhibidores selectivos de la activación de los linfocitos T-helper que son la verdadera clave de apertura de la respuesta inflamatoria, como la ciclosporina A.
La información derivada de los resultados de estos modelos ha permitido su aplicación al hombre. Se pueden distinguir 2 tipos fundamentales de uveítis experimentales (tabla I).

Uveítis experimentales infecciosas
Hay descritos pocos modelos de uveítis experimentales infecciosas (tabla II). Su utilización ha permitido demostrar que la provocación de infecciones en el animal de experimentación proporciona un modelo de lesiones similares a las producidas en el hombre. Esto permite el ensayo y posterior aplicación clínica de nuevas terapias y el avance en el conocimiento de la fisiopatología. En estos modelos se han observado diferentes hechos:
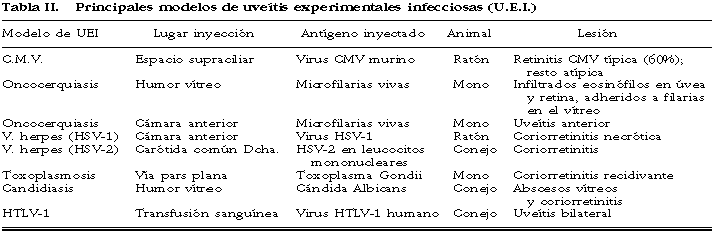
1. La infección experimental del conejo por transfusión sanguínea de virus humanos HTLV-1 induce una uveítis bilateral desarrollada incluso tras 3,5 años de la inoculación. Esta observación aplicada a humanos sugiere que la uveítis que aparece en el curso de la infección por HTLV-1 pudiera ser una entidad clínica distinta y no asociada a la infección HTLV-1 (1).
2. Los resultados obtenidos tras inocular Toxoplama Gondii en monos hacen suponer que la reactivación de la enfermedad enquistada depende de factores distintos de la inmunosupresión de la proliferación del toxoplasma. Por contra, la inmunodeficiencia celular sí parece relacionarse con la extensión de la enfermedad (2).
3. La inyección en ratones de Citomegalovirus murinos (MCMV) demuestra en un 60% el desarrollo de la típica retinitis por CMV con inclusiones víricas intracelulares en retina y EPR, infiltrados focales retinianos y zonas sin lesión (3). La aplicación de este modelo al hombre podría utilizarse para el ensayo de pautas inmunológicas y/o farmacológicas en la retinitis por CMV.
4. La inyección intravítrea de Candida Albicans en conejos produce un modelo experimental infeccioso con afectación retino-coroidea y vítrea que ha permitido valorar la eficacia y toxicidad retiniana real «in vivo» de liposomas encapsulados de anfotericina B (4).
5. El lugar de inoculación de microfilarias de Onchocerca lienalis en el mono proporciona 2 modelos experimentales diferentes de Onchocerquiasis (5,6): 1) su inyección en la cámara anterior ocasiona un modelo de uveítis anterior; 2) su inyección intravítrea produce un modelo de inflamación con vasculitis retiniana e infiltrados perivasculares de eosinófilos, coroiditis eosinofílica y alteraciones en el epitelio pigmentario. La localización de las microfilarias se produce en las zonas alteradas del epitelio pigmentario y no en la retina. Con estos modelos se ha visto que la retina del mono es similar a la humana infectada por onchocerquiasis, utilizándose éstos para estudios experimentales de fármacos activos contra esta entidad como el citrato de dietil carbamacina (5).
6. Inyectando vía sistémica leucocitos mononucleares (MNLs) infectados con virus del herpes tipo 2 (HSV-2) en conejos recién nacidos se provoca una coriorretinitis herpética mucho más intensa que la producida por el mismo número de virus HSV-2 libres, implicándose tal simbiosis en la patogénesis de la coriorretinitis herpética de tales conejos (7,8). Su aplicación en el hombre apunta la posibilidad de que las células que parasitan los HSV-2 quedasen atrapadas en la circulación retiniana produciendo así las lesiones oculares.
7. El modelo murino de Von Szily con herpes simple tipo 1 (HSV-I) ha demostrado mediante inoculación de HSV-l en la cámara anterior del ratón la producción de una coriorretinitis necrotizante en el ojo contralateral, permaneciendo la retina del ojo inyectado intacta histológicamente. Se ha demostrado que esta necrosis se relaciona directamente con la presencia de antígenos virales, mientras que en la retina intacta no se detectan estos antígenos por inmunohistoquimia (9,10). Se ha demostrado que en este tipo de modelo los linfocitos T CD4+ son capaces de modular la retinitis (11).
Uveítis experimental autoinmune (U.E.A.)
La UEA, modelo de uveítis aplicable al hombre
Los modelos de uveítis autoinmunes experimentales (UEA) no han logrado determinar la patogenia de las uveítis endógenas humanas pero son ampliamente utilizados para estudiar los fenómenos celulares y bioquímicos que suceden en la inflamación, ensayándose así nuevos productos. Dado que clínicamente existe una base razonable para diferenciar uveítis anteriores y posteriores, a efectos prácticos es posible diferenciar dos tipos de UEA:
Modelos experimentales de uveítis anterior aguda.
Modelos experimentales de uveítis posterior.
Modelos de uveítis anterior aguda
UEA inducida por adyuvante-inductor de artritis
Inyectando «adyuvante completo de Freund» en la almohadilla plantar de ratas Lewis se provoca un fenómeno «artritis reumatoide-like» (12) que cursa en un 60% con una uveítis anterior aguda (13). Aunque inicialmente se creyó que el fenómeno representaba una reacción inmune frente al colágeno tipo II(14), estudios posteriores lo relacionan con los proteoglicanos de los cartílagos (15), lo que aplicado al hombre tiene especial relevancia. al encontrarse éstos en el humor vítreo fisiológico (16).
UEA inducida por proteínas del cristalino
La primera referencia al respecto data de 1922 cuando Verhoeff y Lemoine describen como «endoftalmia facoanafiláctica» (hoy «uveítis facoantigénica») una reacción inflamatoria masiva tras la rotura capsular anterior del cristalino, demostrando después que se trataba de una autosensibilización frente a proteínas del cristalino. Este hallazgo abocó en la «teoría del secuestro antigénico» en boga durante muchos años, al pensarse en el cristalino como un órgano avascular aislado de la circulación general. Desde que en 1979 se demostró el paso de todos los tipos de proteínas del cristalino («cristalinas») a la circulación (17) no se acepta al cristalino como ejemplo de secuestro antigénico. Las cristalinas, proteínas solubles del cristalino, son sus antígenos más significativos, en especial la cristalina alfa, que es la de mayor potencia inmunógena. Se han demostrado Ac anticristalino en el 50% de sujetos normales y en pacientes cataratosos; por ello se piensa que los linfocitos T pueden haber desarrollado una «auto-tolerancia parcial» mantenida por microniveles de estas proteínas (18).
Aunque en un principio se pensaba que la uveítis inducida por proteínas del cristalino afectaba únicamente al segmento anterior, se ha demostrado que la inyección intraperitoneal en el animal experimental produce también edema y vasculitis necrotizante retiniana y coroidea (19).
Con la inducción experimental de la «uveítis facoantigénica» se ha avanzado en los conocimientos inmunes del cuadro, habiéndose implicado Ac, complemento. inmunocomplejos y linfocitos T (20). Aunque se requiere para su producción de la rotura de la cápsula del cristalino, existen casos descritos por aumento de la permeabilidad capsular (21). Por otro lado, en las maniobras de extracción extracapsular no se genera reacción inmune si se eliminan todos los restos cristalinianos. Por ello, es de actual interés la información que nuevas técnicas de investigación sobre las cristalinas aplicadas sobre este modelo puedan aportar (22).
UEA inducida por melanina
Modelo desarrollado en 1991 por Broekhuyse et al (23). Descrito inicialmente como «uveítis anterior experimental autoinmune» por la severa iridociclitis que produce, actualmente se conoce como «uveítis experimental inducida por la proteína melanina». Consiste en la inoculación de l µg de melanina bovina extraída de coroides o iris (24,25). Se emplean ratas Lewis a pesar de que su úvea no se haya pigmentada, ya que posee melanosomas inmaduros con melanina (26).
La inflamación se inicia a los 3-8 días post-inoculación, progresa en 7-10 días, disminuyendo paulatinamente para autolimitarse en 1 mes. Es una iridociclitis severa con intensa celularidad y «flare», sinequias anteriores y posteriores (27). Este modelo posee caracteres distintivos:
No produce inflamación retiniana al no afectar fotorreceptores (26), epitelio pigmentario, nervio óptico, piel, meninges, ni glándula pineal (28). La falta de inflamación en estos lugares donde se ha demostrado la existencia de melanina es aún un enigma.
Sólo en casos de intensa severidad se aprecia hipopión, hifema y precipitados queráticos (26).
Solo desarrolla afectación coroidea en casos de inflamación muy severa, por lo que se postula que tal vez la intensidad de la coroiditis sea «dosis-dependiente» (27).
Tras la resolución del cuadro, se han documentado recurrencias con reaparición de las lesiones uveales tras un breve período de quietud inflamatoria (26).
La úvea es el «tejido diana» en este modelo, ya que se trata de un tejido rico en melanina y con abundantes melanocitos. Dada la participación de los melanocitos en la enfermedad de Vogt-Koyanagi-Harada se baraja la posible aplicación de este modelo al hombre para estudiar las lesiones producidas en las células que contienen melanina en esta enfermedad (29-32). Como se trata de un modelo que presenta reactivaciones espontáneas, podrían experimentarse terapias para prevenir las recurrencias de muchas formas clínicas de uveítis en humanos.
UEA inducida por endotoxina (UIE)
La inyección en el animal de laboratorio de lipopolisacáridos de la pared externa de las bacterias gram negativas provoca una uveítis anterior aguda (33), bilateral, dosis-dependiente (34-36) detectable a las 2-4 horas de la inoculación y autolimitada en unas 48 horas (36). Un hecho a tener en cuenta es que la inyección de elevadas dosis de toxina parece saturar los mecanismos inflamatorios intraoculares (37) lo que ha permitido corroborar que incrementando considerablemente la dosis de endotoxina no se consigue aumentar en modo alguno la reacción inflamatoria ocular generada (38).
Se ha descrito un período refractario de respuesta a la inyección repetida de endotoxina (39) durante el cual el ojo no es capaz de producir las sustancias mediadoras habituales de la inflamación en la UIE (40). No se conoce la razón de este hallazgo, aunque se piensa en una posible relación con la incapacidad para generar TNF por los macrófagos tras inyectar la endotoxina (41).
Aunque la UIE se ha considerado clásicamente como un modelo aislado de uveítis anterior aguda, recientemente se ha demostrado la coexistencia de vasculitis retiniana e infiltración inflamatoria de retina y coroides (42). Las principales características bioquímicas de este modelo se resumen en la tabla III. Las endotoxinas más empleadas son de «Escherichia Coli» (43) que produce alteraciones gastrointestinales, «Salmonella Typhimurium» (44,45) que es la más utilizada actualmente y «Shighella Flexneri» (36). Se han usado diferentes vías de administración: intravenosa (46), subcutánea (44), intravítrea (47) e intraperitoneal (38). Los animales de laboratorio más empleados son ratas de las razas Lewis y Wistar, y conejos albinos de rata New Zealand, prefiriéndose en general estos últimos por su fácil manipulación y su mayor contenido en humor acuoso (43).

La aplicación al hombre del modelo de UIE es útil para estudiar formas de uveítis endógenas (tabla IV). Algunas de ellas se han relacionado con infecciones por bacterias gram negativas ya que desde antiguo se conoce la facultad de algunas bacterias y toxinas de actuar sobre tejidos uveales. Existe predisposición a la UAA en los pacientes portadores del Ag HLA B27, el cual muestra regiones homólogas estructuralmente a proteínas de superficie de estas bacterias (48,49). Igualmente se ha demostrado una asociación entre uveítis clínicas y enfermedades inflamatorias intestinales en las cuales los productos bacterianos difunden merced a la permeabilidad de las paredes intestinales (50). No obstante, existen diferencias entre la UIE y la UAA humana:

La UAA del hombre es precedida semanas antes de infección intestinal por bacterias gram negativas que han sido implicadas en las uveítis endógenas (Shigella, Yersinia, Salmonella). Las principales entidades relacionadas son: síndrome de Reiter, enfermedades inflamatorias intestinales, espondilitis anquilopoyética, artritis crónica juvenil artritis psoriásica y la enfermedad de Behçet (33,34,44,51,52). En el animal experimental, sobre todo en la rata, aparece a las 2-4 horas post-inyección (34,53).
En el hombre, la uveítis suele ser unilateral, a diferencia de la experimental que es bilateral, incluso tras inyección intravítrea (37,47).
La respuesta al tratamiento con AINES es alta en la UIE comparada con la humana, lo que podría explicar que la vía de la ciclooxigenasa tuviera un papel prioritario en los animales y fuera solo complementaria en el hombre.
Modelos de uveítis posterior
La inflamación del segmento posterior incluye una variedad de síndromes clínicos englobados bajo el término de «uveítis endógenas posteriores» (tabla V). Se pueden presentar bajo múltiples formas, identificándose como entidades clínicas distintas, aunque patogénicamente cada una podría corresponder a distintos aspectos de un misma respuesta coriorretiniana (36). Aunque la teoría de la autoinmunidad de las uveorretinitis fue propuesta por Elschnig en 1910 (54), hasta 1965 no se desarrolla un modelo de uveítis autoinmune experimental en el cobaya (55). Se conocen diferentes autoantígenos con capacidad inmunogénica para provocar UEA en el animal experimental.

UEA inducida por antígeno S (Ag-S)
El Ag-S, considerado como el Ag uveitogénico más potente descrito, fue descubierto, aislado a partir de homogeneizados de retinas bovinas y caracterizado en 1977 (56). Se localiza, siendo por tanto sus órganos diana, en la capa de fotorreceptores de la retina: segmento externo, interno, cuerpo celular y pedículo sináptico (57) y glándula pineal de algunas especies (58) (no olvidar el origen embriológico común de ambas estructuras). Actualmente el modelo de UEA aguda por Ag-S es el más empleado (59,60) al provocar una inflamación severa, reproductible, autolimitada y modificable terapéutica o inmunológicamente. No obstante, conviene saber que este modelo agudo es sólo una de las múltiples respuestas inflamatorias frente al Ag-S (36) (tabla VI).

La duración del cuadro se relaciona con el animal empleado; en ratas Lewis la inflamación es explosiva y de corta duración, mientras que en otras especies de ratas, ratones y cobayas es más crónica. En monos presenta una apariencia clínica similar a las vasculitis retinianas del hombre (6l). La cantidad de Ag-S inoculado determina en parte las lesiones; así:
Dosis bajas de Ag-S desencadenan las lesiones que serán comentadas posteriormente.
Dosis altas en ratas sensibilizadas producen cuadros inflamatorios graves bilaterales con desprendimiento de retina exudativo, vitritis intensa, y a veces con apariencia de necrosis retiniana aguda (36). Se inician como retinitis en animales con retina muy vascularizada (mono y rata), presentando mayor grado de coroiditis en animales con retina poco vascularizada como el cobaya (36). Recientemente, se han demostrado 2 lugares uveopatogénicos específicos de la molécula del Ag-S que podrían explicar este hecho (62). Asimismo, existen estudios que muestran que tanto conos como bastones contienen Ag-S, aunque éstos parecen ser antigénicamente diferentes (63).
El total de lesiones de esta UEA se produce aproximadamente en 3 semanas y presenta el siguiente patrón secuencial:
1.º Infiltrado mononuclear coroideo de bajo grado con macrófagos en la capa de fotorreceptores que fagocitan restos de las lesiones producidas en los segmentos externos de los fotorreceptores.
2.º Desarrollo de unos focos inflamatorios pequeños en la unión coroides-retina semejantes a los nódulos de Dallen-Fuchs de la oftalmía simpática, VKH y/o retinitis sarcoide.
3.º Sustitución del tejido dañado por otro cicatricial compuesto por fibroblastos (36,64).
UEA inducida por rodopsina
Desde que se descubrió el Ag-S se conocen varios autoantígenos retinianos con capacidad inmunógena para provocar diferentes formas de UEA (tabla VII). La UEA inducida por rodopsina no es un modelo muy empleado habitualmente, siendo las lesiones que provoca dosis-dependientes (tabla VIII). Produce un modelo de coriorretinitis severa con retinitis de predominio central y uveítis anterior (65). Típicamente el epitelio pigmentario no se afecta; de hecho, se dice que en este modelo la membrana de Bruch y el epitelio pigmentario parecen tener una elevada resistencia a las células citotóxicas (66).
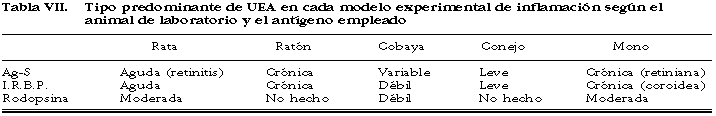

UEA por IRPB («Interphotoreceptor retinoid binding protein»)
La inoculación experimental de IRPB («Interphotoreceptor retinoid binding protein»), molécula descubierta, aislada, purificada y caracterizada por Wiggert et al en 1985 (67) produce una uveorretinitis con predominio de afectación coroidea (68), acompañada de pinealitis, como en la UEA por Ag-S, e inflamación de tejidos perimeníngeos (36).
Los principales cambios clínicos consisten en envainamiento de vasos retinianos y lesiones blanco-amarillentas profundas. La zona más afecta es la coroides, donde se forman granulomas con la estructura de los nódulos de Dallen-Fuchs (69) por lo que este modelo podría aplicarse a humanos al recordar la oftalmía simpática y la enfermedad de Vogt-Koyanagi-Harada.
A diferencia de la UEA por Ag-S, ésta aparece 1 día antes, presenta una reacción ligeramente más severa y según el tipo de animal un curso más corto (70).
Este tipo de UEA abre ciertas perspectivas en el tratamiento de la rehabilitación visual del desprendimiento de retina, ya que se ha demostrado sobre desprendimientos de retina experimentales que la IRBP incrementa notablemente los niveles de regeneración del pigmento rodopsina (7l) de la retina.
Bibliografía
1. Taguchi H, Sawada T, Fukushima A: Bilateral uveitis in a rabbit experimentally infected with human Tlymphotropic viruc type 1. Lab Invest 1993; 69: 336-339.
2. Holland GN, O'Connor GR, Díaz RF: Ocular toxoplasmosis in immunosuppressed nonhuman primates. Invest Ophthalmol Vis Sci 1988; 29: 835-842.
3. Atherton SS, Newell CK, Kanter MY, Cousins SW: Retinitis in euthymic mice following inoculation of murine cytomegalovirus (MCMV) via the supraciliary route. Curr Eye Res 1991; 10: 667-677.
4. Liu KR, Peyman GA, Khoobehi B: Efficacy of liposome-bound amphotericin B for the treatment of experimental fungal endophthalmitis in rabbits. Invest Ophthalmol Vis Sci 1989; 30: 1.527-1.534.
5. Donnelly JJ, Taylor HR, Young E: Experimental ocular onchocerciasis in cynomolgus monkeys. Invest Ophthalmol Vis Sci 1986; 27: 492-499.
6. Semba RD, Donnelly JJ, Rockey JH: Experimental ocular onchocerciasis in cynomolgus monkeys II. Chorioretinitis elicited by intravitreal onchocerca lienalis microfilariae. Invest Ophthalmol Vis Sci 1988; 29: 1.642-1.651.
7. Ohashi Y, Oh JO, Tung Ou KH, Nichols B: Role of virus-infected mononuclear leukocytes in herpetic chorioretinitis of newborn rabbits. Invest Ophthalmol Vis Sci 1986; 27: 1.459-1.465.
8. Berra A, Rodríguez A, Heiligenhaus A, Pazos B, Van Rooijen N, Foster S: The role of macrophages in the pathogenesis of HSV-I induced chorioretinitis in BALB/c mice. Invest Ophtfialmol Vis Sci 1994; 35: 2.990-2.998.
9. Whittum-Hudson JA, Pepose JS: Immunologic modulation of virus-induced pathology in a murine model of acute herpetic retinalnecrosis. Invest Ophtbalmol Vis Sci 1987; 28: 1.541-1.548.
10. Opremcak EM, Foster CS, Hemady R: Chorioretinal disease patterns in congenic mice following intraocular inoculation with HSV-I. Invest Ophthalmol Visual Sci 1989; 30 1.041-1.046.
11. Azumi A, Cousins SW, Kanter MY, Atherton SS: Modulation of murine herpes simplex virus type 1 retinitis in the uninoculated eye by CD4+ T lymphocytes. Invest Ophthalmol Vis Sci 1994; 35: 54-63.
12. Steffan C, Wick G: Delayed hypersensitivity reactions to collagen in rats with adjuvant-induced arthritis. Z Immunidatforsch 1971; 141: 169-180.
13. Waskman BH, Bullington SJ: Studies of arthritis and other lesions induced in rats by injection of mycobacteríal adjuvant. Arch Ophthalmol 1961; 64: 751-761.
14. Stuart JM, Townes AS, Kang AH: Type II collagen-induced arthritis. Ann N Y Acad Sci 1985; 480: 355-362.
15. Cohen IR: The self, the world and autoimmunity. Sci American 1988; 258: 34-40.
16. Stuart JM, Cremer MA, Dixit SM, Kang AH, Townes AS: Collagen induced arthritis in rats. Arthr Rheum 1979; 22: 347-360.
17. Sandberg HO, Closs O: The alpha and gamma crystallin content in aqueous humor of eyes with clear lenses and with cataracts. Exp Eye Res 1979; 28: 601-610.
18. Marak GE, Font RL, Alepa FP: Immunopathogenicity of lens crystallins in the production of experimental lens-induced granulomatous endophthalmitis. Ophthalmic Res 1978; 10: 30-35.
19. Rao NA, Fernandez MA, Sevanian A: Treatment of experimental lens-induced uveitis by dimethyl thiourea. Ophthalmic Res 1988; 20: 106-111.
20. Marak GE, Font RL, Alepa FP: T-cell function in lens-induced endophthalmitis. In: Shimizu K, Oosterhuis JA. XXIII Concilium Ophthalmologicum. Amsterdam: excerpta médica, 1979; 950-953.
21. Kraus-Mackiw E, Büttner K, Müller-Ruchholtz W: Lens-induced uveitis: further immunological studies in an experimental model. Av Graefes Arch Klin Exp Ophthalmol 1977; 202: 297-303.
22. Rao CM: Synchronous scan fluorescence: a novel approach to study crystallins and lens. Invest Ophthalmol Vis Sci 1991; 32: 1.058.
23. Broekhuyse RM, Kuhlmann ED, Winkens HJ, Van Vugt AHM: Experimental autoimmune anterior uveitis (EAAU), a new form of experimental uveitis. I. Induction by a detergent-insoluble, intrinsic protein fraction of the retina pigment epithelium. Exp Eye Res 1991a; 52: 465-474.
24. Broekhuyse RM, Kuhlmann ED: Experimental autoimmune anterior uveitis. The preparation of uveitogenic ocular melanin. Invest Ophthalmol Vis Sci 1993b; 34: 698-700.
25. Bora NS, Kim MC, Kabeer NH, Simpson SC, Tandhasetti MT, Cirrito TP et al: Experimental autoimmune anterioruveitis. Invest Ophthalmol Vis Sci 1995; 36: 1.056-1.066.
26. Chan CC, Hikita N, Dastgheib K, Whitcup SM, Gery I, Nussenblatt R: Experimental melanin-protein-induced uveitis in the Lewis rats. Immunopathologic processes. Ophthalmology 1994; 101: 1.275-1.280.
27. Broekhuyse RM, Kuhlmann ED, Winkens HJ: Experimental autoimmune anterior uveitis (EAAU) II. Dosedependent induction and adoptive transfer using a melanin-bound antigen of the retinal pigment epithelium. Exp Eye Res 1992; 55: 401-411.
28. Broekhuyse RM, Kuhlmann ED, Winkens HJ: Experimental autoimmune anterior uveitis (EAAU) III. Induction by immunization with purified uveal and skin melanins. Exp Eye Res 1993a; 56: 575-583.
29. Chan CC: Relationship between sympathetic ophthalmia, phacoanaphylatic endophthalmitis, and Vogt-Koyanagi-Harada disease. Ophthalmology 1988; 95: 619-624.
30. Norose K, Yano A, Aosai F, Segawa K: Immunologic analysis of cerebrospinal fluid lymphocytes in Vogt-Koyanagi-Harada disease. Invest Ophthalmol Vis Sci 1990; 31: 1.210-1.216.
31. Sakamoto T, Murata T, Inomata H: Class II major histocompatibility complex on melanocytes of Vogt-Koyanagi-Harada disease. Arch Ophthalmol 1991; 109: 1.270-1.274.
32. Kahn M, Pepose JS, Green WR: Immunocytologic findings in a case of Vogt-Koyanagi-Harada syndrome. Ophthalmology 1993; 100: 1.191-1.198.
33. Rosenbaum JT, McDevitt HO, Guss RB, Egbert PR: Endotoxin-induced uveitis in rats as a model for human disease. Nature 1980; 286: 611-613.
34. Bhattacherjee P, Willians RN, Eakins KE: An evaluation of ocular inflammation following the injection of bacterial endotoxin into the rat food pad. Invest Ophthalmol Vis Sci 1983a; 24: 196-202.
35. Herbort CP, Okumura A, Mochizucki M: Immunopharmacological analysis of endotoxin-induced uveitis in the rat. Exp Eye Res 1989; 48: 693-705.
36. Forrester JV, Liversidge J, Dua HS, Towler H, McMenamin PG: Comparison of clinical and experimental uveitis. Curr Eye Res 1990; 9: 75-84.
37. Ferrick MR, Thurau SR, Oppenheim MH, Herbort CP, Ni M, Zachariee C et al: Ocular inflammation stimulated by intravitreal interleukin-8 and interleukin-1. Invest Ophthalmol Vis Sci 1991; 32: 1.534-1.539.
38. Cousins SW, Guss RB, Howes EL, Rosenbaum JT: Endotoxin-induced uveitis in the rat: observations on altered vascular permeability, clinical findings, and histology. Exp Eye Res 1984; 39: 665-676.
39. Hoekzema R, Murray PI, Van Haren MAC, Helle M, Kijlstra A: Analysis of interleukin-6 in endotoxin-induced uveitis. Invest Opbthalmol Vis Sci 1991; 32: 88-95.
40. Howes EL, Goldyne ME, Perez D, Goldstein IM, Rosenbaum JT: Lipopolysaccharide tolerance inhibits eye inflammation. I Reduced immune complex or lipopolysaccharide effects. Arch Ophthalmol 1985; 103: 257-260.
41. Hoekzema R, Verhagen C, Van Haren MAC, Kijlstra A: Endotoxin-induced uveitis in the rat. The significance of intraocular interleukin-6. Invest Ophthalmol Vis Sci 1992; 33: 532-539.
42. Ruiz JM, Thillaye B, De Kozak: Retino-choroidal changes in endotoxin-induced uveitis in the rat. Ophthalmic Res 1992; 24: 162-168.
43. Csukas S, Paterson CA, Brown K, Bhattacherjee P: Time course of rabbit ocular inflammatory response and mediator release after intravitreal endotoxin. Invest Ophthalmol Vis Sci 1990; 31: 382-387.
44. Herbort CP, Okumura A, Mochizucki M: Endotoxin induced uveitis in the rat. A study of the role of inflammation mediators. Graefe`s Arch Klin Exp Ophtbalmol 1988; 226: 553-558.
45. Chan CC, Ni M, Miele L, Cordella-Miele E, Ferrick M, Mukherjee AB, Nussenblatt RB: Effects of antiflammins on endotoxin induced uveitis in rats. Arch Ophthalmol 1991; 109: 278-281.
46. Rubin RM, Samples JR, Rosenbaum JT: Prostaglandin-independent inhibition of ocular vascular permeability by a platelet-activating factor antagonist. Arch Ophthalmol 1988; 106: 1.116-1.120.
47. Forrester N, Worgul BV, Merrian GR: Endotoxin-induced uveitis in the rat. Albrecht von Graefe`s. Arch Klinn Ophthalmol 1980; 213: 221-233.
48. Schwimmbeck PL, Yu DTY, Oldstone MBA: Autoantibodies to HLA B27 in the sera of HLA B27 patients with ankylosing spondylitis and Reiter's syndrome. J Exp Med 1987; 166: 173-181.
49. Zhang J-J, Hamachi M, Hamachi T, Zhao Y-P, YU DTY: The bacterial outer membrane protein that reacts with anti-HLA B27 antibodies is the OMPA protein. J Immunol 1989; 143: 2.955-2.960.
50. Aoki K: A study of endotoxemia in ulcerative colitis and crohn's disease: I. clinical study. Acta Med Okayama 1978; 32: 147-158.
51. Rosenbaum JT: Endotoxin-induced uveitis in rats. In: Tabara-Cello. Animal models of ocular diseases. Springfield: Thomas CC, 1984; 247-253.
52. Schlaegel TF: Etiologic diagnosis of uveitis. En Tasman W, Jaeger EA. Duane's Clinical Ophthalmology. Philadelphia: JB Lippincott Company, 1990.
53. Okumura A, Mochizuki M: Endotoxin-induced uveitis in rats: morphological and biochemical study. Jpn J Ophthalmol 1988; 32: 457-465.
54. Elschnig A: Studien zur sympathischen ophthalmie. Die antigene Wirkung des Augenpigmentes. Graefes Arch Ophthal 1910; 76: 509-546.
55. Wacker WB, Lipton MM: Experimental allergic uveitis. Homologous retina as uveitigenic antigen. Nature 1965; 206: 253-254.
56. Wacker WB, Donoso LA, Kalsow CM, Yankeelov JA, Organisciak DT: Experimental allergic uveitis. Isolation, characterization and localization of a soluble uveitopathogenic antigen from bovine retina. J Immunol 1977; 119: 1.949-1.958.
57. Mirshahi M, Faure JP, Brisson P, Falcon J, Guerlotte J, Collin JP: S-antigen immunoreactovity in retinal rods and cones and pineal photosensitive cells. Biol Cell 1984; 52: 195-198.
58. Kalwow CM, Wacker WB: Rabbit ocular and pineal autoimmune response to retina antigens. Curr Eye Res 1986; 5: 579-586.
59. De Kozak Y, Sakai J, Thillaye B, Faure JP: S-antigen-induced experimental autoimmune uveoretinitis in rats. Curr Eye Res 1981; 1: 327-340.
60. Mochizuki M, Kuwabara T, McAllister C, Nussenblatt RB, Gery I: Adoptive transfer of experimental autoimmune uveoretinitis in rats: immunopathogenic mechanisms and histological features. Invest Ophthalmol Vis Sci 1985; 26: 1-9.
61. Nussenblatt RB, Kuwabara T, De Monasterio FM, Wacker WB: S-antigen uveitis in primates. A new model for human disease. Arch Ophthalmol 1981; 99: 1.090-1.092.
62. Donoso LA, Merryman CF, Shinohara T: S-antigen. Identification of the MAbA9-C6 monoclonal antibody bindings site and the uveitopathogenic sites. Curr Eye Res 1986; 5: 995-1.004.
63. Nork TM, Mangini NJ, Millecchia LL: Rods and cones contain antigenically distinctive S-antigens. Invest Ophthalmol Vis Sci 1993; 34: 2.918-2.925.
64. McMenamin PG, Crewe J: Endotoxin-induced uveitis. Kinetics and phenotype of the inflammatory cell infiltrate and the response of the resident tissue macrophages and dendritic cells in the iris and ciliary body. Invest Ophthalmol Vis Sci 1995; 36: 1.949-1.959.
65. Schalken JJ, Winkens HJ, Van Vugt AHM: Rhodopsin-induced experimental autoimmune uveoretinitis: dose-dependent clinicopathological features. Exp Eye Res 1988; 47: 135-145.
66. Broekhuyse RM, Stekhoven JHS, Arends M: Experimental autoimmune retinitis in the rat induced by immunization with rhodopsin: an ultrastructural study. Exp Eye Res 1991b; 53: 141-149.
67. Wiggert B, Chader GJ: Monkey interphotoreceptor retinoid-binding protein (IRBP): isolation, characterization, and syntesis. In: Bridges CD, Addler AJ. The interphotoreceptor matrix in health and disease. New York: Liss, 1985; 89-110.
68. Sanui H, Redmond TM, Kotake S: Uveitis and immune responses in primates immunized with IRBP-derived synthetic peptides. Curr Eye Res l990; 9: 193-198.
69. Hirose S, Kuwabara T, Nussenblatt RB: Uveitis induced in primates by interphotoreceptor retinoid-binding protein. Arch Ophthalmol 1986; 104: 1.698-1.702.
70. Broekhuyse RM, Winkens HJ, Kuhlmann ED: Induction of experimental autoimmune uveoretinitis and pinealitis by IRPB. Comparison to uveoretinitis induced by S-antigen and opsin. Curr Eye Res 1986; 5: 231-240.
71. Duffy M, Sun Y, Wiggert B: Interphotoreceptor retinoid binding protein (IRBP) enhances rhodopsin regeneration in the experimentally detached retina. Exp Eye Res 1993; 57: 771-782.