Dres. Verdejo MC1, Marco P2, Pinazo-Durán MD2
Departamento de Biología y Patología Celular.
Centro de Investigación del Hospital Universitario La Fe. Valencia
(1) Licenciada en Medicina y Cirugía. Especialista en Oftalmología.
(2) Doctor en Medicina y Cirugía. Especialista en Oftalmología.
Introducción
Aunque la pérdida de la función visual es un suceso tardío en el curso de la retinopatía diabética y de la vitreorretinopatía proliferativa, alrededor de un 80% de los pacientes quedarían totalmente ciegos en pocos años si se abandonaran a su evolución espontánea y se dejasen sin tratar los signos de isquemia retiniana periférica y neovascularización por el inicio de una maculopatía, hemorragia vítrea o desprendimiento de retina traccional (1-4).
En el caso de la retinopatía diabética proliferativa (RDP), el estímulo para la neovascularización parece provenir de la hipoxia debida a la oclusión de extensas zonas en los capilares retinianos y el desencadenamiento de la producción de factores de crecimiento (2,3). Estos procesos ocurren fundamentalmente en la papila y en la unión de la retina normal con la hipóxica. El primer tejido neovascular surge en la superficie retiniana aunque los cambios que acontecen paralelamente en el vítreo y la penetración de los neovasos en la membrana limitante interna se adhieren a la hialoides posterior y favorecen la proliferación. La formación de tejido fibroso dará lugar a la aparición posterior de bandas traccionales entre la retina y hialoides provocando contracciones y desprendimientos que tienen muy mal pronóstico.
Por otra parte, los trabajos publicados previamente sugieren que el estímulo desencadenante en el caso de la vitreorretinopatía proliferativa (VRP) parece ser la inflamación causada por las rotura de la retina (4,5), con la subsecuente puesta en marcha de los mecanismos de activación de los polinucleares neutrófilos que van a generar proteasas y radicales libres (RL) por la vía de la xantina y xantina-oxidasa. Estos fenómenos conducirían inexorablemente a la proliferación y fibrosis con formación de membranas y bandas de tracción entre el tejido retiniano y la hialoides y posteriores desgarros y desprendimientos de la retina.
Nuestras investigaciones anteriores nos permiten sugerir que el globo ocular, y de una forma particular la retina y el nervio óptico, son especialmente vulnerables al ataque oxidativo (6,7) y que los RL desempeñan un papel crucial en la patogénesis de las vitreorretinopatías (8,9). Sin embargo, aún no se han elucidado las bases celular y molecular que rigen los primeros pasos que originarán estas enfermedades. De hecho, nuestra hipótesis de trabajo en este momento va encaminada a encontrar el eslabón de conexión entre los hechos bioquímicos que conducen por una parte a la formación de RL y alteración de los mecanismos de defensa antioxidante y subsecuentemente el estímulo celular que induce los fenómenos de proliferación y fibrosis vitreorretiniana y su cronificación. Para ello hemos efectuado la bioseparación del ácido desoxirribonucléico (ADN) en vítreos humanos procedentes de vitrectomías programadas en el curso de la RDP y VRP, procediendo a su cuantificación mediante un método espectrofluorimétrico. Los resultados se compararon con los de un grupo de pacientes con vítreos considerados como no patológicos, intervenidos por desprendimientos de retina regmatógenos no severos, membranas epirretinianas y/o agujeros maculares.
Material y métodos
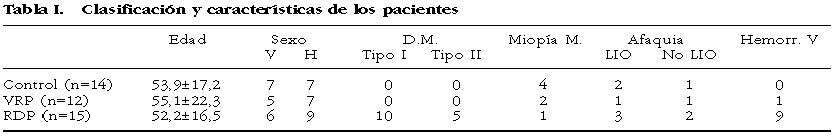
50 muestras de vítreo humano fueron obtenidas en el curso de la vitrectomía vía pars plana previamente a la apertura de la infusión. La cantidad de vítreo extraída fue de 1.000 ml que se depositaron en un crio-eppendorf en el mismo quirófano, sumergiéndolo inmediatamente en nitrógeno líquido para su traslado. En el laboratorio 4 alícuotas de 250 µl fueron separadas, identificadas y almacenadas en congelador a –70°C, hasta su procesamiento. Sin embargo, en el transcurso del trabajo 9 muestras tuvieron que ser desechadas por problemas en la manipulación con el fin de eliminar cualquier interferencia en la obtención, transporte o procesado que pudiera alterar los resultados. Finalmente, 41 vítreos fueron clasificados según su procedencia en: a) pacientes con retinopatía diabética proliferativa en estado avanzado (RDP) (n=15), b) ojos con vitreorretinopatía proliferativa establecida (VRP) (n=12) y c) grupo de vítreos controles aparentemente sanos que fueron obtenidos de pacientes intervenidos por desprendimiento de retina regmatógeno no severo, membranas epirretinianas y/o agujero macular (GVC) (n=14).
La primera y segunda alícuotas se destinaron en parte a la determinación de la concentración proteica (10) y el resto para la medida del MDA por la técnica del ácido tiobarbitúrico (TBA) según ha sido descrita con anterioridad (7-9,11,12). Algunas muestras de cada grupo, escogidas al azar se destinaron también a la determinación del 4-HNE mediante la técnica del LPO 586 cuyo protocolo ha sido adaptado a nuestras muestras según los descritos previamente (13,14).
La tercera alícuota se destinó a la medida de la actividad enzimática superóxido dismutasa (SOD) y catalasa (CAT) respectivamente, según las técnicas descritas (7,15,16).
La cuarta alícuota se utilizó para efectuar la bioseparación del ADN genómico, utilizando la técnica colorimétrica comercializada por Hoechst European Corporation y descrita por Labarca y Paigen (17) con las adaptaciones necesarias introducidas por nosotros para el procesamiento del vítreo. Para el ensayo se utilizaron también restos de las alícuotas primera, segunda y tercera con el fin de analizar la variabilidad que pudiera existir entre los resultados en una misma muestra y efectuar una autocomprobación de la prueba.
El método de bioseparación y cuantificación del ADN genómico está basado en la emisión fluorescente producida cuando el bisbenzimidazol (Hoechst 33258) se une al ADN previa disociación de la cromatina en el tejido. Varias muestras de ADN fueron obtenidas de "Sigma Chemical Company" D1501 lote 072H9563. La descripción del protocolo es como sigue: los eppendorf se descongelaron dejándolos unos minutos a temperatura ambiente y sin sonicar se centrifugaron en "Heraeus Biofuge (Sepatech)" a 13.000 x g durante 15 minutos. A continuación se añaden 50 µl por eppendorf del tampón-1 (Tris 100 mM, ClNa 5 M y EDTA 2,5 mM, pH 12) que se incuba durante 1 hora en estufa a 37°C y se vuelve a congelar a –70°C. De nuevo se descongela y congela por dos veces y finalmente se separan 50 µl de cada muestra que se disponen en pocillos de la placa microtitter añadiendo 100 µl por pocillo del colorante Hoechst 33258 diluido en tampón-2 a concentración de 2 mg/ml mezclando bien con pipeta multicanal. La concentración de la solución colorante se obtiene añadiendo 2 ml de la misma en 1 ml del tampón 2 (Tris 40 mM, ClNa 2 M y EDTA 1 mM, pH 7,4). Una vez bien agitado se lee en cytoflor a sensibilidad 5 y con el fluoroskan en las condiciones de excitación filtro 360/40 y emisión filtro 460/4. La curva patrón de ADN se prepara diluyendo la solución de ADN en el tampón 3 (Tris 40 mM, CLNa 2 M y EDTA 1 mM pH 4,8) preparando la solución A a 80 mg/ml mezclando con tampón 3 y la solución B a 20 mg/ml también en tampón 3, y añadiendo volúmenes concretos según cada pocillo. El cálculo del contenido final de ADN genómico se efectúa interpolando los valores de la fluorescencia de las muestras en la recta patrón obtenida con las concentraciones decrecientes del ADN, tal como se describieron en el protocolo inicial (18). Todos los datos fueron procesados estadísticamente y son el resultado de la media ± desviación standard de 3-5 determinaciones. Los resultados fueron analizados mediante un programa BASIC desarrollado en nuestro laboratorio (6-9,12-14,19). Para analizar las diferencias entre grupos se aplicó el test "t" de Student. También se efectuó un análisis de la correlación mediante el programa Solo Statistics de Los Angeles CA.
Resultados
La clasificación y las principales características de los pacientes se muestran en la tabla I.

La medida de la peroxidación lipídica mediante el test del TBA demostró que los valores basales de MDA fueron significativamente superiores en los grupos de pacientes con VRP y RDP frente a los controles de la misma edad (p=0,0001). Sin embargo, no existieron diferencias estadísticamente significativas entre ambos grupos VRP y RDP (fig. 1). La determinación de 4-HNE mediante el test del LPO 586 demostró igualmente que los valores del hidroxialkenal estaban significativamente aumentadas en los pacientes con vitreorretinopatías cuando se compararon con los controles (p=0,0001) como aparece en la tabla II.

Cuando se analizaron las actividades de los principales sistemas de defensa antioxidante, los enzimas SOD y CAT mostraron disminución significativa de su actividad en los casos de VRP y RDP con respecto a los pacientes del grupo GVC (figs. 2 y 3). Sin embargo, como en el caso anterior, no existieron diferencias significativas respecto a la actividad de ambos enzimas en los grupos VRP y RDP.
Respecto a la bioseparación y cuantificación del ADN genómico en los tres grupos estudiados, observamos que existía un aumento muy significativo de los valores en los grupos VRP y RDP frente a los del GVC (fig. 4), asumiendo que existe una relación directa con la celularidad (ADN genómico=número de células). El análisis estadístico demostró que la variabilidad entre alícuotas de la misma muestra era muy pequeña, alrededor del 3-4%. Por otra parte, el análisis de la correlación demostró valores positivos entre la formación de RL (nmol/mg prot) y el incremento del ADN genómico (µg/ml) en los pacientes que presentaron VRP (r=0,0235) y RDP (r=0,0156).
Discusión
Tanto la RDP como la VRP representan una de las principales causas de ceguera en todo el mundo (1,2,4). Sin embargo, pese a la evidente actividad investigadora desarrollada alrededor de estos procesos, tanto en el caso de los modelos animales como en humanos, favorecida en los últimos años por los avances en la cirugía del segmento posterior y la aparición de modelos experimentales, no se han podido esclarecer ni los mecanismos que provocan el comienzo de la enfermedad proliferativa vítreo-retiniana ni su progresión inexorable. De hecho, el vítreo no es una estructura fácil de manipular ni de procesar tanto "in vivo" como "in vitro".
La peroxidación lipídica es uno de los mecanismos evidentes de daño celular como consecuencia de la formación de RL (20). En el curso de este trabajo y en otros efectuados con anterioridad (6-9) hemos descrito el aumento de los niveles basales de aldehídos peroxídicos en pacientes que sufrían procesos vaso y fibroproliferativos en estadios avanzados de su enfermedad con respecto a los controles. Augustin y cols. (21) también demuestran el incremento de la actividad oxidativa en las muestras de vítreo procedentes de pacientes diabéticos y procesos vitreoproliferativos con respecto a los vítreos controles, tomando como éstos los vítreos de las mismas características que en nuestro estudio. Sin embargo, a pesar de la evidente actividad oxidativa detectada en las vitreorretinopatías no encontramos diferencias significativas entre los grupos VRP y RDP. Esto sugiere que independientemente de los orígenes de cada una de las patologías (proceso inflamatorio, mecanismos de hipoxia/reperfusión) la formación de RL en un nexo a tener en cuenta tanto en los inicios como en las fases avanzadas de cada una de las patologías, como demuestran las muestras obtenidas de los pacientes incluidos en este estudio.
Los enzimas antioxidantes SOD y CAT mostraron ambos disminución significativa de su actividad en las vitreorretinopatías con respecto al grupo control. Puesto que el análisis estadístico de los tres grupos demostró que en todos y cada uno de ellos el sexo y la edad de los pacientes eran similares, asumimos que nuestros resultados son independientes de la variabilidad que experimentan estos enzimas no solo individualmente sino también en relación a la edad. Aunque las actividades SOD y CAT fueron inferiores en el grupo RDP, no existieron diferencias significativas con los pacientes de VRP. Esta disminución de la actividad enzimática en los grupos VRP y RDP favorecerían el ataque oxidativo haciendo los tejidos más susceptibles a la prolongación en el tiempo de dichas patologías. De aquí el reciente interés por el estado nutricional y los suplementos en la dieta y así como el aporte programado de elementos antioxidantes en el curso de los procesos clínicos (22) y en los actos quirúrgicos (23,24).
Y ante todos estos hechos cabe preguntarse: ¿Cómo actúan los RL sobre las estructuras vitreorretinianas para inducirles el daño irreversible? El planteamiento de varias hipótesis nos permite postular los siguientes mecanismos: 1) Peroxidación de la membrana celular y alteración de los mecanismos de transducción de señales. 2) Cambios en las estructuras citoplasmáticas (A. Golgi, R. Endoplásmico, etc.) y desorganización celular. 3) Ataque directo al núcleo con alteración del ADN genómico induciendo inestabilidad genética y mutaciones puntuales. 4) Modificación de la matriz extracelular con variaciones en el medio ambiente celular y en los mecanismos de reparación. 5) Variaciones enzimáticas por alteraciones genéticas que inducen cambios en los valores Km y enzimas menos eficientes. 6) Modificaciones en los mecanismos de apoptosis, tanto en el sentido de inducción como inhibición de la misma.
Es un hecho bien conocido que el núcleo está dirigiendo todos los procesos que acontecen en la célula desde la síntesis de proteínas hasta la diferenciación y muerte celular. Las células ciclan de forma regular entre una fase de síntesis y una fase de degradación. La síntesis en cada ciclo es iniciada por la transcripción de una o varias familias de ADN altamente repetitivo (para una revisión ver Britten R y Davidson E: Gene regulation for higher cels. A theory. Science 1969, 165: 349 y/o Klevecz R: Quantized generation time in mammalian cells as an expression of the cellular clock. Proc. Nastn. Acad. Sci. USA. 1976, 73: 4012, y/o Witkowski J: The myth of cell immortality. Trends Biochem. Sci. 1985, 10: 258). Además es precisó que un iniciador de la transcripción active a determinados segmentos del ADN que controlan a su vez la transcripción de los ARN mensajeros (25). Estudios efectuados sobre la fusión celular indican que las células maduras que no se dividen contienen un inhibidor del crecimiento del que se sabe que tiene el poder de anular la replicación de células jóvenes e incluso de algunas células transformadas (26). Es posible que una proteína antiproliferativa asociada a la membrana pudiera estar relacionada con estos hechos. Puesto que existe un aumento en la formación de especies eactivas del oxígeno en los procesos vaso y fibroproliferativos vitreorretinianos ¿sería el daño directo al ADN el causante de la proliferación celular indiscriminada? y si esta hipótesis resultase cierta ¿podrían los radicales libres por sí mismos alterar los mecanismos de inhibición del crecimiento celular en los tejidos oculares dañados, como sugieren algunos autores? (27).
En este trabajo hemos efectuado un conjunto de experimentos encaminados a aislar y cuantificar el ADN genómico de los vítreos humanos procedentes de vitrectomías. Aunque existen varias pruebas para la preparación de los ácidos nucleicos de los tejidos, todas coinciden en comenzar con alguna forma de lisis celular seguida de desproteinización y posterior recuperación del ácido nucleico en cuestión. Las principales diferencias entre los diversos ensayos recaen en la extensión de la desproteinización, el peso molecular del ácido nucleico separado y la forma de inactivar las endonucleasas (17,18,25). Algunas son bastante complejas y requieren el uso de columnas "spin", geles de agarosa, PCRs, o productos muy causticos como el fenol, etc., de forma que el tiempo de determinación se alarga invariablemente. Con la técnica de bioseparación y cuantificación del ADN genómico utilizada en el presente estudio hemos demostrado el aumento significativo de los valores en el grupo de pacientes con vitreorretinopatías (independientemente del tipo del proceso) frente a los del grupo control. Puesto que debemos minimizar la presencia del ADN mitocondrial y por lo tanto descartar su posible interferencia con el ADN genómico, la relación entre cantidad de ADN y número de células sería 1: 1. Esto significaría que ambas patologías, la RDP y la VRP, podrían seguir un patrón similar en lo que respecta al análisis molecular cuantitativo de los procesos de proliferación celular. Como resumen de nuestras observaciones al emplear esta técnica podemos decir que la valoración de la fluorescencia del compuesto Hoechst 33258 es lineal y aumenta paralelamente al incremento de las cantidades del ADN en las muestras, resultados que hemos podido comprobar en nuestros experimentos. El procedimiento es fácilmente reproducible, relativamente rápido y la sensibilidad de esta prueba es muy apreciable ya que permite la determinación del ADN incluso a bajas concentraciones sin requerir el uso de aparatos muy sofisticados, además de que la variabilidad entre los resultados de alícuotas del mismo paciente era mínima. En cuanto a la posibilidad de que la presencia de ácido ribonucleico (ARN) en las muestras pudiera interferir con los resultados de la determinación del ADN, podemos decir que aunque no hemos realizado la bioseparación del ARN en estos experimentos, observaciones anteriores afirman que no existe ninguna interferencia entre los ácidos nucleicos para el resultado final de la cuantificación de ADN genómico (17,18).
Nuestros resultados sugieren que los mecanismos de hipoxia/reperfusión y de inflamación, favorecidos por la disminución de los mecanismos de defensa antioxidante, son capaces de inducir la producción de RL por la vía de la peroxidación lipídica y con ellos el daño celular en los tejidos oculares y de una forma particular en la retina y en el vítreo. De ello se deduce que el conjunto de alteraciones provocadas por la acción de los lipohidroperóxidos sobre dichos tejidos puede dar lugar a una serie de fenómenos moleculares entre los que las citoquinas, componentes de la matriz extracelular y otras moléculas reguladoras pudieran estar implicadas (3,5,28), induciendo los procesos de proliferación celular que contribuyen a perpetuar el proceso. Podemos concluir que como resultado de nuestro trabajo hemos detectado la existencia de una correlación fuertemente positiva entre la formación de RL, la disminución de las enzimas antioxidantes SOD y CAT y el aumento del contenido en ADN en la RDP y en la VRP. Postulamos que determinados cambios en los mecanismos de muerte celular programada o "apoptosis", concretamente el desequilibrio entre la inhibición de la muerte celular y los mecanismos proliferativos, conllevarían un aumento indiscriminado de la celularidad, como hemos constatado en el presente estudio, junto con los cambios moleculares subsecuentes al aumento del proceso de hibridación repetitiva del ADN en tejidos postmitóticos que darían lugar al aumento del ADN o a la deaminación hidrolítica de los componentes de las bases que podrían ser la causa de la perpetuación en el tiempo de estos procesos proliferativos.
Nuestros próximos experimentos estarán encaminados hacia el estudio de determinadas características moleculares en el curso de las vitreorretinopatías, siguiendo esta misma línea de investigación.
Resumen
A pesar de los años de investigación clínica y experimental, las bases celular y molecular que rigen los procesos proliferativos vítreo-retinianos continúan sin poder esclarecerse, de manera que siguen constituyendo un grave problema social a nivel mundial. Puesto que las especies reactivas del oxígeno están directamente implicadas, tanto en las fases iniciales como en los estadios avanzados de diversas patologías oftalmológicas, nos planteamos la posible relación entre la formación de radicales libres (RL) en el curso de las vitreorretinopatías y el daño a las estructuras nucleares, utilizando 41 muestras de vítreo procedentes de pacientes de 53,7±17 años de edad que extraídas durante vitrectomía vía pars plana por desprendimiento de retina regmatógeno, agujero macular y/o membrana epirretiniana (grupo de vítreos Control, GVC, n=14), desprendimiento de retina con proliferación vitreorretiniana (grupo PVR, n=12) y retinopatía diabética proliferativa con o sin hemorragia vítrea (grupo RDP, n=15) y congeladas a 70°C se destinaron en primer lugar a determinación de productos de la peroxidación lipídica [malonildialdehido (MDA) y 4 hidroxinonenal (4HNE)] y medida de la actividad de los enzimas antioxidantes superóxido dismutasa (SOD) y catalasa (CAT). En una segunda fase se llevó a cabo la bioseparación y cuantificación del ADN genómico mediante la técnica colorimétrica comercializada por Hoescht (33258) y lectura en citofluor. Los resultados sugieren un aumento significativo en la formación de RL (p_0,001) y disminución de la actividad antioxidante SOD and CAT (p_0,0001), que se presentan de forma paralela al incremento en el contenido de ADN genómico en los grupos VRP y RDP con respecto al GVC. Concluimos que la separación de ácidos nucleicos en el vítreo es una técnica accesible y relativamente rápida para cuantificar el material celular existente en esta estructura, existiendo una correlación positiva entre el aumento en el contenido de ADN y la formación de RL en las vitreorretinopatías.
Summary
In spite of years of epidemiological and experimental research the cellular and molecular basis of the vitreoretinal processes remains unclear. Vitreoretinopathies constitute up today a serious problem in all around the world. Free radical (FR) formation has been involved in the initial steps as well as the advanced stages of several ophthalmological diseases. Because of this, the aim of the present work was to analyse the relationship between FR formation in the course of vitreoretinopathies, and damage to the nuclear estructures. 41 vitreous samples were obtained during vitrectomies which were performed in eyes suffering from proliferative vitreoretinopathy [(n=12) PVR], diabetic patients with advanced proliferative vitreoretinopathy [(n=15) DPR], and finally a group of eyes operated because of non-severe rhegmatogenous retinal detachment, epiretinal membranes and/or macular hole [(n=14) GVC]. Vitreous samples were frozen at 70°C and stored until processing. The peroxidic by-products [malondialdehide (MDA) and 4-hidroxinonenal (4-HNE)] were determined and the activity of the antioxidant enzymes superoxide dismutase (SOD) and catalase (CAT) were measured. In a second step, the bioseparation and quantitative determination of the genomic desoxirribonucleic acid (DNA) in the vitreous was assayed by a sensitive procedure based on the enhancement of fluorescence occurring when a coloured by-product (Hoechst 33258) binds to DNA. Data suggested that FR formation was significantly elevated in the vitreoretinopathies when compared to the CVG (p_0.0001). Furthermore, SOD and CAT displayed significantly lower activities in PVR and DRP as compared to the controls (p_0.0001). In conclusion, a simple and rapid assay for quantitative determination of DNA in the vitreous is reported herein. Taken our results all together reflected a positive correlation between DNA content and FR formation in the pathological vitreous.
Agradecimientos
Las autoras quieren expresar su gratitud al Prof. Jaime Renau-Piqueras por la lectura y corrección del manuscrito y a la Dra. M.ª José Gómez Lechón por su ayuda en la puesta a punto del protocolo para la determinación del contenido en ADN genómico de las muestras.
Bibliografía