 Fig. 1
Fig. 1REVISIÓN
Dres. Cano-Parra J1, Muñoz Ruiz G1, Gómez Lechón MJ2, Iborra FJ2, Díaz-Llopis M1, Menezo JL3
Universidad de Valencia. Facultad de Medicina.
Cátedra de Oftalmología. H. Universitario La Fe.
(1) Médico adjunto de Oftalmología.
(2) Centro de Investigación del H. La Fe.
(3) Jefe de Servicio.
Este trabajo de investigación ha sido parcialmente financiado con la beca de la Sociedad Catalana de Oftalmología 1994 a JCP.
Introducción
La vitreorretinopatía proliferante (VRP) es la causa más frecuente de fracaso en la cirugía del desprendimiento de retina (1-3). La VRP está causada por una proliferación fibrocelular que constituye membranas con capacidad contráctil, en la superficie y debajo de la retina (4). Se han desarrollado diversos modelos animales de VRP en que mediante la inyección de 250.000 fibroblastos autólogos dérmicos en el ojo intacto del conejo (5) o una inyección menor de fibroblastos después de vitrectomía mecánica (6) o de compresión vítrea por gas (7), nos permiten ensayar fármacos que inhiban el desarrollo de la VRP y estudiar su farmacocinética, posible toxicidad y potenciales efectos sistémicos (8-10). Entre los diversos fármacos ensayados están el 5-fluoruracilo y sus derivados (11). Entre los derivados del 5-fluoruracilo, la 5-fluorouridina (5-FUR) ha demostrado in vitro (12) e in vivo en un modelo animal primitivo de simple inyección intravítrea de fibroblastos (13) que es más activa y eficaz que el 5-fluoruracilo para inhibir la VRP. Hasta ahora no se habían estudiado la eficacia y toxicidad de los liposomas de 5-fluorouridina en un modelo refinado experimental de VRP, así como tampoco se había definido la histología de la VRP de este modelo experimental que simula más adecuadamente la proliferación subcrónica de la VRP humana.
Material y métodos
Preparación de liposomas de 5-fluorouridina
La 5-FUR es soluble en agua y alcohol.
Se preparan liposomas de fosfatidilcolina de huevo multivesiculares encapsulando 5-FUR a una razón en peso de 4 g fosfatidilcolina de huevo/1 g de 5-FUR para conseguir una concentración final 0,1 mg 5-FUR/0,1 ml de suspensión. Brevemente el método fue: 48 mg de fosfatidilcolina de huevo de pureza 99% (Avanti Polar Lipids, Birmingham, AL) se disolvieron en cloroformo al 10% hasta conseguir una película fina. Se procede a la evaporación e hidratación, utilizando el método de Bangham se hidrató la película lipídica con una solución acuosa de 12 ml de agua que contenían 12 mg de 5-FUR. Posteriormente realizamos una filtración secuencial con filtros entre 1 micra y 0,2 micras, que nos sirven para esterilizar y extrusionar los liposomas consiguiendo a la vez de esterilizar, extrusionar el fármaco en liposomas de tamaño entre 50-300 nm y con un potencial Z medido mediante movilidad electroforética de -23 mV (a mayor potencial, mayor estabilidad frente a la fusión y agregación en el tiempo). Congelamos la suspensión a -80° C y la descongelamos justo antes de inyectarla a nivel intravítreo, volviéndola a pasar por una batería de filtros entre 1 y 0,2 micras, procedimiento que a la vez que esteriliza, aumenta el volumen de encapsulación de la 5-FUR, hasta una eficiencia de captura final de alrededor del 70%.
Se parte de Lecitina de huevo de un 99% de pureza. El extracto crudo de fosfátidos se realiza en una columna de vidrio rellenada de alúmina y equipada con un disco de porcelana porosa como soporte del adsorbente. La relación entre alúmina/extracto crudo de lecitina es de 25:1, ya que así se previene una sobrecarga en la columna además de conseguirse una óptima resolución del fosfátido.
Se pesan 250 g de Al2 O3 (óxido de aluminio 90 de Merck), de actividad II-III, se suspenden en cloroformo y se echan en la columna. La disposición en capas del adsorbente es de aproximadamente de 22 cm de altura.
Se pesan 10g de L-alfa Fosfatidilcolina de huevo y se disuelven en el cloroformo hasta conseguir una disolución al 5%. Se añade a la columna.
Se deja fluir la muestra a lo largo de la columna hasta que alcance un nivel menor de 1 cm por encima de la superficie de alúmina.
Se adicionan 500 ml del primer sistema solvente que es el cloroformo. El flujo de este eluyente es de aproximadamente 18 ml/min.
El segundo y tercer solventes son respectivamente cloroformo: metanol (9:1 v/v) y cloroformo:metanol:agua (2:5:2 v/v). Los volúmenes adicionados son 1.500 mL para el sistema binario, cuyo flujo es de 222 mL/min y 2400 mL del sistema ternario, cuyo flujo es de 5 mL/min.
Todas las fracciones son analizadas posteriormente por Cromatografía en capa fina (TLC):
Para el desarrollo de los cromatogramas se ha utilizado el eluyente clorofomo: acetona: metanolácido acético: agua (6:8:2:1 v/v) usado por Rouser y cols (14). Como soporte se utilizaban cromatofolios de Aluminio para HPTLC de silicagel 60 F254 de Merck.
La detección y caracterización de los fosfolípidos se han llevado a cabo utilizando los siguientes reactivos:
Todas las fracciones que contienen fosfatidilcolina purificada (iodometría+, Dragendorff++ y Ninhidrina-) se concentran en el rotavapor. El residuo se pesa, se disuelve en etanol absoluto, y posteriormente se vuelve a concentrar, repitiéndose este paso tres o cuatro veces con el fin de eliminar al máximo los disolventes orgánicos de alta toxicidad. El producto final se almacena en atmósfera de nitrógeno por debajo de 0°C hasta su utilización.
Para todo el desarrollo experimental posterior se ha fijado una concentración de fosfolípidos de 10-4 M para proporcionar una concentración de liposomas especialmente adecuada a los sistemas de detección disponibles.
Se procedió a preparar liposomas de lecitina de huevo a una concentración de 10-4 M, usando una proporción de 4 g de lecitina/1 g de 5-FUR. La temperatura de trabajo ha sido en todos los casos de 25°C y posteriormente se congelaron a -80°C.
Estudio eficacia
Un total de 32 conejos pigmentados de peso entre 1,5 y 2,5 kg fueron anestesiados con Ketamina HCl (50 mg/kg) y sus pupilas dilatadas con colirios tópicos de fenilefrina al 5% y tropicamida al 0,25% previamente a todos los procedimientos. Utilizamos la técnica de compresión vítrea mediada por gas (15). Primero provocamos 6 áreas de criolesiones transesclerales a través de las cuales pudiéramos realizar inyecciones intravítreas sin riesgo de desprendimiento regmatógeno de retina. Diez días después de la criopexia inyectamos 0,2 ml de gas C3F8. Tres días después el gas ocupaba alrededor del 90% de la cavidad vítrea. Entonces, insertamos una aguja de 30 G 1/2 a nivel superior y otra a nivel inferior por la que inyectamos 0,2-0,3 ml de una solución de Ringer-lactato con la salida del gas por la aguja superior, logrando así un intercambio de gas por líquido. Diez días después del intercambio inyectamos 25.000 fibroblastos homólogos conjuntivales que habían sido cultivados previamente en condiciones standart, con una viabilidad del 100% y del pase n.º 1, se suspendieron en 0,1 ml de tampón fosfato salino (PBS). Los conejos fueron randomizados en 2 grupos, y utilizando un sólo ojo por conejo se inyectaron en el grupo control (n=16) solamente 0,1 ml de liposomas vacíos después de los 25.000 fibroblastos mientras que en el grupo T (tratado) (n=16) inyectamos 1 hora después de los fibroblastos, una segunda inyección de 0,1 ml de liposomas de 5-FUR a una concentración de 0,1 mg 5-FUR/0,1 ml de liposomas en condiciones estériles.
Cada ojo fue examinado por oftalmoscopia indirecta y se tomaron fotografías del fondo de ojo los días 0, 7, 14, 21 y 28 después de la inyección de fibroblastos. Todos los conejos se sacrificaron el día 28 por una sobredosis de 1.5 ml de pentobarbital sódico inyectado en la vena de la oreja.
Se clasificaban los ojos en estadios de VRP en cada punto de la observación siguiendo los estadios de Hida (16) valorando el éxito o fracaso del tratamiento en función de la presencia (estadios 5-7, fig. 1) o ausencia de desprendimiento de retina (estadios 0-4, fig. 2). Se realizó un análisis estadístico mediante el test de Fisher, que es una variante del test de chi-cuadrado para grupos pequeños.
Durante todos los experimentos se siguieron las normas de la C.E.E. y de la declaración de Helsinki sobre uso de animales para investigación.
Estudio de toxicidad
Para evaluar los posibles efectos tóxicos de la dosis intravítrea de los liposomas de 5-FUR (1 mg/ml) se inyectaron 9 conejos pigmentados (6 ojos para el fármaco y 3 ojos de control) siguiendo el mismo modelo refinado de VRP pero sin la inyección de fibroblastos para evitar cualquier artefacto retiniano atribuible a la proliferación de fibroblastos. Utilizamos tres puntos de observación (24 horas, 14 y 28 días) valorando en cada punto de la observación, dos ojos tratados con el fármaco y un ojo control (de liposomas vacíos). Una vez sacrificados los conejos en los distintos puntos de observación y enucleados los ojos, se diseccionaron por el ecuador del globo, y se procesaron muestras de 3 diferentes áreas retinianas (incluyendo las zonas inferiores donde por la gravedad era de esperar un mayor depósito del fármaco) para microscopia óptica y electrónica de transmisión, siguiendo un protocolo específico de preparación histológica (17).
Estudio histológico de la VRP
Hemos utilizado 7 conejos pigmentados a los que hemos sometido a un modelo experimental de VRP previamente descrito (15). Se enuclearon los 7 ojos el día 28 post-inyección de fibroblastos. Se seccionaron los globos por su ecuador y se estudiaron varios cortes de diversas zonas retinianas. Previamente se fijaron según técnicas específicas para estudio a microscopia óptica (Hematoxilina-Eosina), y m. electrónica (7 ojos).
Protocolo de microscopia electrónica de transmisión
Se incluyó el globo ocular (7 ojos) en una solución al 2% de glutaraldehido +1,5% formaldehido en tampón de cacodilato sódico 0,1M y pH 7.4 durante media hora el globo completo, y 1,5 horas más después de seccionar el globo por su ecuador.
Posteriormente se deshidrató en alcoholes e incluyó en Epon según un protocolo estandart y se realizaron secciones semifinas (1 µ) que se tiñeron con azul de toluidina, para identificar las zonas de interés para los cortes ultrafinos (0,5 µ), que teñidas con Acetato de Uranilo 2% se visualizaron al microscopio electrónico de transmisión (Phillips 400).
Resultados
Estudio de eficacia
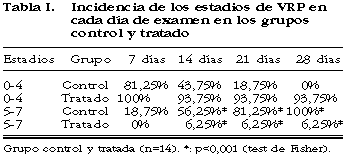
La inyección intravítrea de liposomas multivesiculares de 5-FUR fue bien tolerada por los animales (no mostraron signos de aumento de inflamación, ni alteraciones retinianas macroscópicas). Ningún animal murió durante el transcurso de los experimentos. Hallamos diferencias estadísticamente significativas en la incidencia de DR entre los grupos control y tratado en los días 14, 21 y 28 (tabla I, fig. 3). En el día 14 en el grupo control tenían DR en el 56,25% (9/16) mientras en el grupo tratado tenía DR el 6,25% (1/16) (p=0,002). En el día 21 en el grupo control tenían DR el 81,25% (13/16) de los conejos, mientras que en el grupo tratado sólo lo tenía el 6,25% (1/16) (p<0,00005). En el día 28, todos los animales del grupo control tenían DR (16/16) mientras que en el grupo tratado sólo el 6,25% tenían DR (1/16) (p<0,00000003).
Estudio de toxicidad
En los 9 ojos estudiados (3 ojos por punto de observación, 2 ojos tratados con liposomas de 5-FUR y otro ojo tratado con liposomas vacíos) a nivel de microscopia óptica, se hallaron leves signos de toxicidad en los 3 puntos de observación (24 horas, 14 días y 28 días), estando bien preservada la estructura retiniana incluso a nivel de la retina inferior donde por efecto de la gravedad se depositan los liposomas y es presumible que existieran dosis mayores del fármaco. Estaban conservadas todas las capas retinianas en todos los puntos de observación, pero se observaban alteraciones en los ojos tratados, de tipo de vacuolización a nivel de los segmentos externos de los fotorreceptores que eran mínimas a las 24 horas, mayores a las 15 días (fig. 4) y que tendían a disminuir significativamente con el paso del tiempo, siguiendo paralelamente la lenta liberación de la 5-FUR contenida en los liposomas. Por otra parte a nivel de los estudios de microscopia electrónica realizados a los 28 días, no se han hallado alteraciones significativas a nivel de los fotorreceptores ni a nivel de organelas como mitocondrias. En conclusión, existe una toxicidad leve (mayor a las 2 semanas) y aparentemente transitoria.
Estudio histológico de la VRP
El estudio de microscopia óptica de la retina mostró pliegues de todo el espesor retiniano producidos por la tracción de una membrana epirretiniana con celularidad de aspecto glial (fig. 5).
El estudio ultraestructural de la membrana epirretiniana (MER), muestra una estructura formada por prolongaciones celulares gliales, dispuestas en haces paralelos, mostrando un citoplasma con presencia de filamentos intermedios, de disposición paralela y aislados microtúbulos. Las organelas son escasas, formadas por estructuras vesiculares de contenido claro y mitocondrias alargadas, regulares y con crestas (fig. 6). Las células presentan diferenciaciones de unión, con engrosamientos y densificación de la membrana o bien formando imágenes semejantes a desmosomas (fig. 7). En uno de los límites de la MER, se muestran microvellosidades cortas e irregulares, definiendo una polaridad celular (fig. 3). Se observa una membrana basal fina que delimita una estructura de un tejido fibroso (fig. 8) junto a fibrillas de colágena de disposición irregular (fig. 9).
Discusión
Estudio de eficacia
El mecanismo de acción de la 5-FUR es inhibir la síntesis de RNA e interferir la síntesis de proteínas. Además tiene un efecto anticontráctil sobre los fibroblastos "in vitro". Además disminuye la quimiotaxis para los fibroblastos y las células del EPR. Por tanto interfiere varias fases de la VRP: quimiotaxis, proliferación y contracción mediada por células. La inyección intravítrea de 5-FUR en un modelo primitivo de VRP (simple inyección intravítrea de fibroblastos), inhíbe el DR traccional en el 70,5% frente al 10% de los ojos control (13).
La inyección intraocular repetida de fármacos para el tratamiento de la VRP tiene inconvenientes: riesgo de desprendimiento de retina, endoftalmitis, oclusión de la arteria central de la retina, molestias subjetivas, etc. Un sistema de liberación lenta como los liposomas tiene la ventaja de eliminar picos iniciales del antimetabolito que pueden ser tóxicos, así como mantener niveles terapéuticos durante más tiempo, logrando evitar la repetición de inyecciones. Además se sintetizan en condiciones estériles y pueden incorporar cantidades precisas de una droga. Las membranas son estables y pueden deformarse sin romperse (el diámetro de una aguja de 30 G puede ser mayor que el diámetro de los liposomas, dado que éstos pueden deformarse) y por su gran tamaño tienden a localizarse en el sitio de la inyección. Por otra parte pueden bloquear el drenaje linfático retardando el aclaramiento de los fármacos (18-20).
Se ha postulado que el aclaramiento de los liposomas se relaciona inversamente con su tamaño (18), lo que explicaría las diferencias halladas en el aclaramiento por diversos autores. Liposomas muy grandes en el vítreo tendrían el inconveniente de enturbiar la visión. Se ha comunicado que a pesar de repetidos lavados vítreos, un alto porcentaje de liposomas permanecía adherido a las estructuras oculares como la retina. Así pues pueden ser útiles como sistemas de liberación lenta incluso en ojos vitrectomizados-lensectomizados.
Respecto a la preparación de los liposomas preferimos nuestro método al de la evaporación en fase reversa dado que éste último deja fácilmente residuos orgánicos altamente tóxicos, difíciles de eliminar (21). Los estudios de microscopia electrónica después de la inyección de liposomas conteniendo oro coloidal (22), encuentran restos en los lisosomas de las células epirretinales a distintos niveles de membranas multicelulares (21). El mecanismo por el que los liposomas entrarían en las células sería la endocitosis. Al parecer por estudios de marcaje con I125 de liposomas, los liposomas con la cabeza del fosfolípido negativa (como por ejemplo la fosfatidilserina cabeza negativa pero potencial Z positivo), son los que se adhieren más a las estructuras oculares, hallándose los niveles más altos adheridos a la retina. Los estudios de microscopia electrónica con liposomas de oro coloidal revelan que aunque se adhieran extensamente a la membrana limitante interna no entran en la retina, con lo que disminuiría la toxicidad retiniana a la vez que se aumenta específicamente la liberación del farmaco a través de liposomas cargados negativamente a nivel de las células epirretinianas.
El aclaramiento de 1 mg de 5-FUR libre en el vítreo del conejo tiene una vida media de 4,5 horas, mientras que cuando es encapsulada en liposomas multivesiculares es posible detectar niveles supraterapéuticos 14 días después de la inyección, al menos el 10% de la droga inyectada permanecía en el vítreo (56±8,0 µg/ml, ID50 50 µg/ml). La vida media en el vítreo de la 5-FUR encapsulada en liposomas era 30 veces mayor que administrada libre (23).
Además es conocido que la forma de presentar un fármaco puede aumentar su eficacia. Así si a un cultivo de fibroblastos se le aumenta el tiempo de exposición de 1 a 72 horas de 5-FUR aumenta su eficacia en 20 veces. Así pues, es posible que con la administración en liposomas se consiga que el fármaco tenga niveles terapéuticos en vítreo a pesar de haber caído bajo el nivel de ID50 determinado in vitro. Esto explicaría la inhibición de la VRP en nuestro modelo más crónico que el ensayado por Assil y cols, dónde sólo 1/18 ojos desarrollaba DR después del día 14, mientras que en nuestro modelo lo hacen 7/18 ojos. Nuestro modelo refinado suma la rotura de la barrera hematorretiniana por la inflamación de la crioterapia, y un colapso vítreo por la inyección de gas a la inyección de fibroblastos, induciendo un estimulo más crónico y evolutivo de las membranas epirretinianas.
Otras publicaciones (24) han estimado que la vida media de la inyección de 0,1 mg de 5-FUR en liposomas es superior a 5 días (124 horas) en el ojo fáquico no vitrectomizado del conejo. En otro reciente estudio de García-Arumí (25) de 5-FUR a una dosis de 0,25 mg/0,1 ml encapsulada en liposomas multivesiculares (de fosfatidilcolina y recubiertos de colágeno, preparados por el método de evaporación en fase reversa), inyectándolos en el vítreo de conejos previamente vitrectomizados obtenía una vida media de la 5-FUR de 52±7 horas, mientras que la vida libre del mismo fármaco no encapsulado era de 0,82 horas y observando solamente una ligera vacuolización a nivel de los segmentos externos de los fotorreceptores. Serán necesarios más estudios de farmacocinética y de toxicidad para saber si modificando la dosis o la composición de los liposomas se consigue inhibir sin toxicidad la VRP en el ojo afáquico y/o vitrectomizado con gas o aceite de silicona, situaciones en que supuestamente hay un aclarado más rápido de los fármacos inyectados a nivel intravítreo.
Estudio de toxicidad
En un estudio de toxicidad de la inyección intravítrea en conejos de liposomas de 5-FUR- 5`monofosfato realizado por Gariano y cols en 1994 (26), liposomas preparados según el método descrito por Assil y cols en 1991 (22), se evaluaba mediante examen oftalmoscópico, electrorretinograma e histología a microscopia óptica y electrónica la toxicidad de inyecciones de 10, 50, 100 µg/0,1 ml de 5-FUR libre o contenida en liposomas. En este estudio por oftalmoscopia indirecta no se observaban alteraciones corneales ni cristalinianas. A nivel del vítreo y de la retina inferior, como en nuestro estudio (27), se podían observar unas 2 semanas después de la inyección restos de liposomas. Respecto al estudio de ERG a los 10, 30 y 90 días de la inyección intravítrea las latencias y amplitudes de las ondas A y B eran indistinguibles de los practicados en los ojos controles. A nivel de microscopia óptica, no se observó ninguna toxicidad en los animales en que se inyectaron liposomas vacíos, sin embargo cuando se inyectaron 50 ó 100 µg/0,1 ml de 5-FUR libre o contenida en liposomas se observaba a los 10 días una vacuolización de los segmentos externos de los fotorreceptores, aunque esta vacuolización no fue mayor a nivel inferior de la retina, donde presumiblemente las concentraciones eran más altas. A nivel de microscopia electrónica, esta vacuolización se hallaba a nivel intra y extracelular de las células del EPR. En este estudio (26) a los 30 días de la inyección de 50 ó 100 µg/0,1 ml de 5-FUR libre o contenida en liposomas no se observaba esta vacuolización ni ninguna otra alteración retiniana, sin embargo nosotros sí que hemos observado que permanece una discreta vacuolización a nivel de los segmentos externos de los fotorreceptores. En un animal sacrificado y estudiado a los 90 días de la inyección de 100 µg/0,1 ml de 5-FUR contenida en liposomas no se observaban alteraciones oftalmoscópicas, de ERG, ni ninguna otra alteración histológica retiniana. En conclusión en este estudio (26) se sugiere que con dosis de 100 µg/0,1 ml de 5-FUR contenida en liposomas existiría solamente una leve toxicidad transitoria y con dosis de 10 µg/0,1 ml de 5-FUR libre o contenida en liposomas no se observaba esta vacuolización ni ninguna otra alteración retiniana en ningún momento de las observaciones.
Estudios previos (22) han encontrado con dosis intravítreas de 1 mg de 5-FUR libre, existía toxicidad oftalmoscópica consistentes en pequeñas hemorragias vítreas, atenuación de vasos retinianos y áreas focales de atrofia. Tanto en el estudio de Gariano como en el nuestro solamente se han observado una transitoria alteración de tipo vacuolización de los segmentos externos de los fotorreceptores.
Estudio histológico de la VRP
El primer estudio ultramicroscópico de una membrana epirretiniana en una paciente afecta de hemorragia vítrea realizado por Kenyon y Michels en 1977 (28), permitió diferenciar que células con apariencia de fibroblastos en microscopia óptica resultaron ser astrocitos fibrosos en el examen ultraestructural, en función de las características:
1. Núcleo ovoideo.
2. Numerosos filamentos intracitoplásmaticos.
3. Procesos intracitoplasmáticos elongados.
4. Elaboración extracelular de la membrana celular.
5. Uniones intercelulares tipo zona occludens.
6. Matriz extracelular de colágeno de diámetro fibrilar uniforme (25-30 nm) y macroperiocidad.
La morfología de las membranas experimentales inducidas en nuestro modelo experimental sería similar a esta gliosis encontrada en casos de VRP humana secundaria a traumatismos perforantes o hemorragias vítreas complicadas. Se considera que los macrófagos liberarían radicales superóxido al intentar aclarar la hemoglobina vítrea, lo que dañaría la superficie retiniana según postuló Burke en 1981 (29). Estos mismos macrófagos que hallamos en las membranas de nuestro modelo refinado experimental, podrían actuar fagocitando los restos de fibroblastos que inyectamos en el vítreo, induciendo lesiones focales en la membrana limitante interna, a través de donde proliferarían los astrocitos fibrosos, que son el principal componente hallado en nuestras membranas. Hemos identificado ultraestructuralmente estos astrocitos fibrosos en base a las siguientes características morfológicas:
Tienen forma fusiforme, alargados, agrupándose en ovillo o en monocapa con tendencia a la prolongación. En las superficies laterales y apicales se observan numerosas interdigitaciones con las células vecinas a través de zónulas occludens predominantemente aunque también es posible observarlas de tipo adherens. La presencia de filamentos intracitoplasmáticos de tipo intermedio de 10 nm de diámetro como describió Gipson es lo que distingue estas células del resto (30). Unido a este contenido celular se encuentra colágeno fibrilar en proporción variable según el especimen, compuesto por fibrillas entre 10 y 25 nm de diámetro. No obstante hay fibrillas, de hasta 50 nm, con una macroperiodicidad.
Conclusiones
Nuestros resultados sugieren que la inyección intravítrea de los liposomas con 5-FUR a una dosis de 1 mg/ml en un modelo experimental refinado de VRP en conejos previene el desprendimiento de retina traccional pero con una toxicidad leve sobre los segmentos externos de los fotorreceptores de la retina.
Resumen
Finalidad del trabajo. Hemos ensayado los liposomas de lecitina de 5-fluorouridina en un modelo experimental refinado de vitreorretinopatía proliferante (VRP) en conejos para estudiar la eficacia, toxicidad de este fármaco y la histología de las membranas producidas en este modelo experimental.
Material y métodos. 1. Estudio Eficacia. Hemos utilizado 32 conejos pigmentados a los que hemos sometido a un modelo experimental de VRP. Primero provocamos 6 áreas de criolesiones a dos mm del limbo. Diez días después inyectamos 0,2 ml de gas C3F8. Diez días después realizamos un intercambio gas-Ringer Lactato. Diez días después inyectamos 25.000 fibroblastos homólogos conjuntivales y randomizamos los animales en dos grupos (N=16). Una hora después en el grupo tratado inyectábamos 0,1 ml de liposomas de lecitina conteniendo 5-fluorouridina a una concentración de 1 mg/ml mientras en el grupo control, inyectamos 0,1 ml de liposomas de lecitina sin fármaco. Examinamos el fondo de ojo y estadiamos la VRP (clasificación de HIDA) los días 7, 14, 21 y 28. Realizamos una comparación estadística de la incidencia de desprendimiento de retina traccional entre ambos grupos, los días 7, 14, 21 y 28. 2. Estudio Toxicidad. Se inyectaron 9 conejos pigmentados, 6 ojos con 0,1 ml de los liposomas de 5-FUR 1 mg/ml (dosis que inhíbe la VRP) y 3 ojos de control con liposomas vacíos siguiendo el modelo refinado de VRP pero sin la inyección de fibroblastos. Utilizamos tres puntos de observación (24 horas, 14 y 28 días) valorando en cada punto de la observación, dos ojos tratados con el fármaco y un ojo control, que se enucleaban y procesaban para m. óptica y electrónica. 3. Estudio histológico del Modelo. Enucleamos 7 ojos del grupo control de la VRP el día 28 después de la inyección celular y procesamos estos ojos para m. óptica y electrónica.
Resultados. 1. Eficacia: encontramos diferencias estadísticamente significativas (test de Fisher) en la incidencia del desprendimiento de retina en los días 14 (1/16 frente a 9/16 en el grupo control, p=0,002), en el día 21 (1/16 frente a 13/16 en el grupo control, p<0,0001), en el día 28 (1/16 frente a 16/16 en el grupo de control, p<0,00001). 2. Estudio toxicidad: la inyección intravítrea de liposomas fue bien tolerada por los animales y no se observaron signos macroscópicos de toxicidad (edema o necrosis de retina). En los 9 ojos estudiados (3 ojos por punto de observación, 2 ojos tratados con liposomas de 5-FUR y otro ojo tratado con liposomas vacíos) a nivel de microscopia óptica, se hallaron leves signos de toxicidad transitoria en los 3 puntos de observación (24 horas, 14 días y 28 días). Estaban conservadas todas las capas retinianas en todos los puntos de observación, pero se observaban alteraciones en los ojos tratados de tipo de vacuolización a nivel de los segmentos externos de los fotorreceptores que era mínimas a las 24 horas y mayores a las 15 días, siguiendo paralelamente la lenta liberación de la 5-FUR contenida en los liposomas. 3. Estudio histológico del modelo: el estudio de microscopia óptica muestra una membrana epirretiniana con celularidad de aspecto glial. A nivel ultraestructural de la MER se muestra una estructura formada por prolongaciones celulares gliales, mostrando un citoplasma con presencia de filamentos intermedios.
Conclusiones. La inyección intravítrea de liposomas de 5-fluorouridina es útil en la prevención del desprendimiento de retina en un modelo experimental refinado de VRP. Nuestros resultados de m. óptica y electrónica sugieren que los liposomas con 5-FUR a una dosis de 1 mg/ml, muestran una toxicidad leve y transitoria sobre los segmentos externos de los fotorreceptores de la retina. El principal componente celular encontrado a nivel ultraestructural en las membranas epirretinianas en un modelo experimental refinado de VRP es de estirpe glial y la matriz extracelular esta formada principalmente por colágeno.
Palabras clave
Vitreorretinopatía proliferante, modelo refinado experimental, estudio ultraestructural, liposomas de 5-fluorouridina.
Summary
Purpose. The authors evaluated efficacy, toxicity and histology of 5-fluorouridine encapsulated in multivesicular liposomes for the treatment of a refined experimental model of proliferative vitreoretinopathy (PVR).
Methods. 1. Efficacy study. A total of 32 pigmented rabbits were used to create PVR by intravitreal injection of 25.000 homologous subconjunctival fibroblasts 10 days after vitreous gas compression (C3F8). The rabbits were randomized into two goups. One hour after fibroblast injection the treated group (n=16) received one single intravitreal injection of 0.1 ml of multivesicular liposomes containing 5-fluorouridine (1 mg/ml) while the control group (n=16) received one sham intravitreal injection of empty liposomes. The fundus findings were documented on days 0, 7, 14, 21 and 28 after the fibroblast injection. The degree of traction retinal detachment (TRD) in each group was graded according the Hida`s classification and compared using Fisher`s exact test. 2. Toxicity study. Six eyes were injected with 0.1 ml of liposomes containing 5-FUR (1 mg/ml) and 3 control eyes were injected with empty liposomes. Eyes were enucleated at 24 h, 14 days or 28 days for light and electron microscopy studies. 3. Histological study. The authors studied induced epiretinal membranes in 7 pigmented rabbits. We enucleated the eyes in the day 28 after cell injection and we process these eyes for light and electron microscopy studies (7 eyes) to study the morphology and the cell composition of these experimental epiretinal membranes.
Results. 1. Efficacy study. There were statiscally significant differences (Fisher’s exact test) in the rate of TRD between control and treated groups. The authors found that the rate of traction retinal detachment on day 14 were: control, 56.25%; treated, 6.25% (P=0.003) and on day 28 were: control, 100%; treated, 6.25% (P<0.0001). 2. Toxicity study. Intravitreal injection of liposomes was well tolerated by the rabbits. Light and electron microscopic studies showed slight vacuolization of outer photorreceptor segment in all cases. Nevertheless in treated eyes, effect was minimal at 24 h, maximal at 14 days, and slopping thereafter until 28 days. 3. Histological study.
Light and electron microscopic studies manifested a preretinal membrane, with glial cells in parallel shape. The extracellular matrix was mainly composed of collagen.
Conclussion. These results suggest that multivesicular liposome-encapsulated 5-fluorouridine prevent experimental PVR. Intravitreal injection of liposome encapsulated 5-fluorouridine (L5-FUR) in rabbits induced mild toxicity in outer photorreceptor layer. The glia is the main cell component found in the preretinal membranes in a refined experimental model of PVR.
Key Words
Experimental model, PVR, ultrastructural study, 5-fluorouridine encapsulated in multivesicular liposomes.
Bibliografía