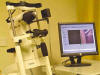
Fig. 1. Módulo Rostock ajustado al HRT II (izquierda) y monitor de control (derecha).
ACTUALIZACIONES TECNOLÓGICAS EN OFTALMOLOGÍA
GONZÁLEZ HERNÁNDEZ M1
(1) Hospital Universitario de Canarias.
INTRODUCCIÓN
El uso de la microscopía especular se ha generalizado para el estudio del endotelio corneal, de manera que se ha hecho imprescindible a la hora de tomar decisiones sobre la cirugía de cataratas, en pacientes con distrofias corneales o para analizar la viabilidad de las córneas donantes para la queratoplastia, pero la técnica se limita al estudio exclusivo de esta capa de la córnea.
La microscopía confocal en vivo permite visualizar las estructuras de todas las capas corneales, pero su desarrollo es relativamente reciente (1) y su uso clínico está aun por generalizar. Sin embargo el creciente interés por la cirugía del segmento anterior y en particular por la cirugía refractiva, ha hecho crecer la acción investigadora en esta técnica, favoreciendo su desarrollo. Nos encontramos ante unas imágenes espectaculares, aunque por novedosas resultan frecuentemente de dudosa interpretación, siendo por tanto algo limitadas sus aplicaciones y aportaciones a la clínica diaria.
No por ello resultan carentes de interés, más bien todo lo contrario; la microscopía confocal se presenta como una nueva herramienta que permite observar in vivo la histología corneal y complementar las observaciones de biomicroscopía convencional, siendo un reto para el mejor entendimiento de la histopatología córneal.
La comparación con preparaciones histopatológicas presenta dificultades, dado que en este caso no se pueden utilizar tinciones para destacar alguno de sus componentes. También resulta difícil comparar las mismas áreas corneales in vivo e in vitro superando las diferentes condiciones ópticas de unos y otros microscopios.
El interés por el estudio de la imagen corneal llevó a los Prof. Stave y Guthoff de la universidad de Rostock (Alemania) a desarrollar el módulo de córnea para el HRT II (2). A las sabidas aplicaciones de éste instrumento en el estudio de la papila en el glaucoma y en la patología macular, han añadido una nueva aplicación adicional: el estudio corneal que ha sido admitido por la FDA en octubre de 2004 (fig. 1).

Fig. 1. Módulo Rostock ajustado al HRT II (izquierda) y monitor de control
(derecha).
Gracias al diseño de los microscopios confocales, cualquier luz fuera del plano focal es suprimida y solo la imagen de este plano contribuye a la imagen, proporcionando imágenes muy claras y definidas en tiempo real.
Las ondas del láser emitido con un ancho de banda concreto se modifican al atravesar la córnea. Debido a la dispersión y refracción de las diferentes estructuras (citoplasma, membranas ricas en lípidos) una parte de la luz es trasmitida a otros planos y otra cambia de dirección al encontrarse con zonas de distinto índice de refracción, interviniendo en este proceso el tamaño y orientación de las partículas.
El módulo de Rostock presenta como ventaja sobre otros microscopios confocales como el Tandem Scanning (TSCM), el Confoscan de Nidex o el Koester de Alcon, que utiliza la radiación monocromática láser del HRT II, evitando las aberraciones cromáticas y proporcionando unas imágenes extremadamente nítidas.
El módulo consta de una lente de alta potencia que proporciona un foco de láser inferior a 1mm de diámetro. Esta lente, combinada con un mecanismo para desplazamiento antero-posterior del foco (z-scan), permite cambiar el plano confocal dentro de la córnea y tomar imágenes a diferentes profundidades sin perder nitidez.
Con el software adecuado se consigue un microscopio confocal digital que además de permitir visualizar las estructuras corneales in vivo determina la densidad celular o de depósitos en cualquier plano. También proporciona valores paquimétricos que permiten conocer con bastante exactitud la profundidad a la que se toman las imágenes.
Un capuchón (TomoCap) de PMMA estéril, proporciona un área de contacto higiénica y mantiene constante la distancia entre la córnea y el microscopio aplanándola ligeramente. Para mantener la interfase óptica entre la lente y el Tomocap y entre éste y el ojo, se utiliza un gel transparente.
Una cámara de vídeo externa permite controlar la fijación del paciente, el centrado y la presión que se ejerce sobre la córnea. De esta manera el microscopio hace contacto sobre ella justamente en el eje óptico (controlando los reflejos del láser sobre la córnea) para de esta manera poder tomar imágenes en planos paralelos a la superficie corneal. Imágenes tomadas fuera del eje óptico producen cortes sagitales a través de diferentes capas corneales (fig 2).

Fig. 2. Corte sagital en el que se aprecian las distintas capas del epitelio. De
izquierda a derecha se observan el epitelio superficial, medio y basal, el plexo
nervioso y el estroma anterior.
INTERPRETACIÓN DE LAS IMÁGENES (3)
Al observar una imagen, y para mejorar su interpretación, debemos tener en cuenta que lo que observamos es luz reflejada y dispersada (scattered) por las estructuras corneales. Según su densidad y poder refringente los diferentes componentes celulares y depósitos se verán más o menos luminosos, codificados en una escala de grises. Por ejemplo, las paredes celulares del endotelio se observan oscuras y su citoplasma gris claro, mientras que el citoplasma del epitelio basal se observa gris oscuro y las paredes celulares blancas debido a sus diferentes condiciones morfológicas, anatómicas y bioquímicas. La alta concentración de desmosomas podría ser la responsable de que las paredes epiteliales aparezcan claras, y la alta densidad de organelas contribuye a la dispersión de la luz, condicionando que algunas células se observen más claras. Éste es el caso de las células del epitelio superficial a punto de descamarse o de las dendritas de los queratocitos activados.
CARACTERÍSTICAS TÉCNICAS
El rango máximo de enfoque del módulo Rostock es de 1.500 µm. En los modelos actuales se pueden utilizar lentes adicionales con las cuales el campo de visión varía de 250x250 µm a 400x400 µm o bien 500x500 µm, dependiendo de la lente que se utilice. La fuente luminosa es un láser de diodo de 670 nm y el tiempo de adquisición de imágenes bidimensionales de 0,024 seg.
Existen tres modos para la adquisición de imágenes:
Secciones: Imágenes individuales bidimensionales.
Volúmenes o z-scan: 40 imágenes bidimensionales tomadas en un rango de 80 µm de profundidad (una imagen cada 2 µm), que pueden ser visualizadas como fotogramas individuales o como secuencia de fotogramas (vídeo). El tiempo de adquisición de cada serie es de 6 seg (cada imagen individual en 0,024 seg). Con el software adecuado (no comercializado aún) es posible realizar reconstrucciones tridimensionales.
Secuencia: 30 imágenes en un mismo plano a la misma profundidad corneal. Las imágenes pueden ser también visualizadas como vídeo o como imágenes individuales.
El software permite determinar densidades ya sean celulares, de depósitos, nerviosas, etc. en cada capa corneal, mediante conteo manual, o bien elegir diferentes formatos de impresión.
MANEJO
Siendo una prueba de contacto, la colaboración del paciente es imprescindible y es recomendable el uso de colirio anestésico. Justo antes de comenzar, se debe instilar gel en el ojo, para mantener la interfase óptica y proteger la córnea.
Tras ensamblar el módulo de córnea en el HRT II y colocar el TomoCap con gel para mantener la interfase óptica, se introducen los datos del paciente, se enfoca sobre la superficie del TomoCap y, en caso necesario, se sitúa en cero la posición de la paquimetría. A continuación se selecciona en el ordenador el tipo de imagen que se desea adquirir. Se le explica al paciente en qué consiste el examen y se le sitúa en la mentonera. El paciente mantiene la fijación en un punto externo, lo que permite centrar el ojo y el módulo gracias al reflejo del haz del láser. Se acerca el TomoCap hasta hacer contacto con el vértice corneal. Mediante el aditamento de ajuste antero-posterior se localiza el plano focal correspondiente a la capa de células que se desea medir. Se debe tener cuidado de no ejercer excesiva presión para evitar la formación de pliegues y mantener la integridad corneal, aunque es inevitable aplanarla ligeramente.
APLICACIONES
La córnea normal (4,5):
Epitelio superficial: Se observan células poligonales con citoplasma, núcleos oscuros y bordes claros e hiper-reflectantes, exceptuando aquellas células a punto de descamarse, que poseen citoplasmas reflectantes, paredes nucleares oscuras y núcleos hiper-reflectantes. La densidad normal en la córnea central es de 840±265 cel/mm2 (fig. 3).
Epitelio medio: Las células poligonales poseen citoplasma y núcleos oscuros -estos últimos difíciles de visualizar- paredes celulares claras y tamaño y forma homogéneos. La densidad normal, en la cornea central, es de 5.070±1.150 cel/mm2.
Epitelio basal: Las células poligonales poseen citoplasma y núcleos oscuros —estos últimos difíciles de visualizar— bordes claros y tamaño y forma homogéneos, como el epitelio medio, pero la densidad normal es algo mayor, concretamente 8.996±1.532 cel/mm2 (fig. 4).
Membrana de Bowman: Es amorfa y difícil de observar en sujetos normales. Se localiza justo debajo del epitelio basal y a menudo se ve atravesada por nervios ramificados.
Plexo nervioso: Claramente observable bajo la membrana de Bowman aunque ocasionalmente se pueden observar nervios también en el estroma anterior (fig. 5).
Células de Langerhans: Células inflamatorias con forma dendrítica. Se observan principalmente en la membrana de Bowman, plexo nervioso y estroma anterior en usuarios de lentes de contacto e inflamaciones corneales y ocasionalmente en pacientes normales. Aunque por regla general se observan sólo sus núcleos, en ocasiones se aprecian sus dendritas, incluso formando una malla (6) (fig. 6).
Estroma superficial: Alta concentración de núcleos de queratocitos hiper-reflectantes y rara vez ramificaciones nerviosas (fig. 7).
Estroma medio: Menor concentración de núcleos de queratocitos (fig. 8).
Estroma profundo: Concentración de queratocitos mayor que en estroma medio y menor que en estroma anterior (fig. 9).
Membrana de Descemet: Amorfa, normalmente no se visualiza en sujetos normales.
Endotelio: Células hexagonales hiper-reflectantes con paredes y núcleos oscuros, difíciles de observar en sujetos normales y patológicos (fig. 10.

Fig. 3. Epitelio superficial. Las células a punto de descamarse se observan
hiper-reflectantes.

Fig. 4. Epitelio basal con citoplasma oscuro y paredes claras.
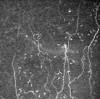
Fig. 6. Células de Langerhans a la altura del plexo nervioso.

Fig. 7. Estroma anterior con abundantes núcleos de queratocitos.
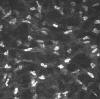
Fig. 8. Estroma medio en el que disminuye el número de queratocitos con respecto
al estroma anterior.
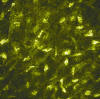
Fig. 9. Estroma posterior en el que aumenta el número de queratocitos con
respecto al estroma medio.
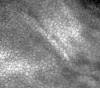
Fig. 10. Endotelio normal en el que se aprecian
ligeros pliegues por presión.
Las aplicaciones en patología corneal se ven solo limitadas por aquellos procesos en que esté contraindicada una prueba de contacto. Algunos ejemplos en que la técnica resulta útil son:
Distrofias: Un ejemplo es la distrofia de Fuchs en la que se observan claramente las guttae endoteliales (fig. 11) y los cambios estromales y epiteliales secundarios en el estadio III (fig. 12). Otro es la distrofia en piel de cocodrilo o en mosaico de Vogt (fig. 13).
Cirugía refractiva: Útil para determinar el espesor del tapete corneal realizado por el microqueratomo (flap), visualizar depósitos y controlar la regeneración del plexo nervioso (7) (figs. 14 y 15).
Infecciones: Permite observar procesos de cicatrización, determinar la densidad de celulas de Langerhans e identificar los quistes de acantamebas.
Queratoplastias: Permite contar las células endoteliales no sólo en vivo sino en córneas de banco mediante un adaptador (todavía sin comercializar), observar las suturas, desplazamientos entre donante y receptor, etc. (fig 16).

Fig. 11. Endotelio de sujeto con distrofia de Fuch
en estadio II.
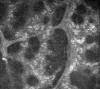
Fig. 12. Epitelio de sujeto con distrofia de Fuchs
en estadio III.

Fig. 13. Estroma medio de sujeto con distrofia de
Vogt.

Fig. 14. Localización depósitos tras cirugía LASIK
a la altura del flap corneal (abajo-derecha).

Fig. 15. Localización depósitos tras cirugía LASIK
a la altura del flap corneal (abajo derecha).
Fig. 16. Conteo de células endoteliales en paciente
con queratoplastia estable.
Otras aplicaciones dentro de la Oftalmología son el seguimiento de ampollas filtrantes (8,9) ojos secos (10-12), tumores melanocíticos (13), queratoconos, portadores de lentes de contacto, Oftalmología veterinaria (14), etc. La película lagrimal puede ser observada con una lente de no contacto aun en evaluación (no comercial), de manera que se puede medir el BUT (break up time, o tiempo que tarda la película lagrimal en romperse) (15).
Incluso fuera de la Oftalmología está demostrada su utilidad en la investigación de patología de garganta, lengua (16), piel, etc.
FUTUROS DESARROLLOS
La Universidad de Rostock sigue trabajando en este módulo de córnea, desarrollando la mencionada lente de no contacto, que evita aplanarla y permite estudiar no sólo las estructuras corneales sino también la estructura de la película lagrimal y observar el cristalino hasta la cápsula posterior añadiendo una lente de 50x. La adaptación del módulo de córnea al HRA (Heidelberg Retina Angiograph) permite visualizar los vasos del iris, la conjuntiva, los párpados etc con posterioridad a la inyección de fluoresceína, o bien la fluorescencia de los tejidos tras aplicarla en colirio. Un nuevo control de enfoque y desplazamiento del módulo mediante un joystick acoplado a la mesa facilita el manejo. La modificación del contraste durante el examen en el monitor de control incrementa la calidad de algunas imágenes.
Otras líneas de investigación son el adaptador para análisis de córneas de banco de ojos y diferentes modelos de TomoCaps (con indentación para cortes sagitales; con hendidura central para evitar contacto directo con la superficie y observar mejor células epiteliales superficiales; con anillo de electrofisiología; con menor zona de contacto para examinar ratas, etc.). Nuevo software permitirá hacer reconstrucciones tridimensionales, aunque es necesaria la óptima colaboración por parte del paciente para que el movimiento durante la captura de imágenes sea mínimo.
Por lo tanto, el módulo Rostock de microscopía confocal para córnea es un instrumento novedoso que proporciona imágenes histológicas in vivo de asombrosa calidad. El continuo avance instrumental y la experiencia harán que la técnica sea cada vez más cómoda de utilizar, ampliará progresivamente sus aplicaciones.
BIBLIOGRAFÍA
Cavanagh HD, Jestre JV, Essepian J, Shields W, Lemp MA. Confocal microscopy of the living eye. CLAO J 1990; 16: 65-73.
Stave J, Zinser G, Grummer G, Guthoff R. Modified Heidelberg Retinal Tomograph HRT. Initial results of in vivo presentation of corneal structures. Ophthalmologe 2002; 99(4): 276-280.
Bochert R, Zhivov A, Kraak R, Stave J, Guthoff RF. Contribution to comprehension of image formation in confocal microscopy of cornea with Rostock cornea module. Br J Ophthalmol 2005; 89: 1351-1355.
Eckard A, Stave J, Guthoff F. In vivo investigations of the corneal epithelium with the confocal Rostock laser scanning microscope. Cornea 2006; 25(2): 127-131.
Guthoff RF, Stave J. In vivo micromorphology of the cornea: Confocal microscopy principles and clinical applications. En: Essentials in Ophthalmology: Corneal and external eye disease pp 173-208. Thomas Reinhard, Frank Larkin (ed).
Zhivov A, Stave J, Vollmar B, Guthoff R. In vivo confocal microscopic evaluation of Langerhans cell density and distribution in the normal human corneal epithelium. Graefes Arch Clin Exp Ophthalmol 2005; 243(1): 1056-1061.
Paic B, Anhalm H, Boehnke M. Predictability of Flap thickness created with the interlase femtosecond laser for laser in situ keratomileusis and the clinical outcome. 10th Montecarlo winter refractive surgery meeting. Montecarlo, febrero 2006.
Messmer EM, Zapp DM, Mackert MJ, Thiel M, Kamplik A. In vivo confocal microscopy of filtering blebs following trabeculectomy. En www.dog.org/dog/dog2005_poster_messmer.pdf.
Labbe A, Dupas B, Harmard P, Baudolin C. In vivo confocal microscopy study of blebs after filtering surgery. Opthalmol 2005; 112(11): 1979.
Leduc C, Dupas B, Ott-Benoist AC, Baudolin C. Advantages of in-vivo HRTII corneal confocal microscope for investigation of the ocular surface epithelia. J Fr Ophthalmol 2004; 27(9 Pt 1): 978-986.
De Incola R, Labbe A, Amar N, Dupas B, Baudolin C. In vivo confocal microscopy and ocular surface diseases: anatomical-clinical correlations. J Fr Ophthalmol, 2005; 28(7): 691-698.
Erdélyi B, Kraak R, Guthoff R, Németh J. Córneal microscopic investigation of the córnea in dry eye. Szemészet 2005; 142(3): 135-138.
Messmer EM, Mackert MJ, Zapp DM, Kampik A. Differential diagnosis of melanocytic conjunctival tumors by in vivo confocal microscopy. 15th SOE Congress. Berlín, Alemania, septiembre 2005.
Kafarnik C, Fritsche J, Reese S. In vivo confocal microscopy of the cornea. ECVO/ESVO Meeting. Porto, Portugal, junio 2005.
Guthoff RF, Stave J. Comunicación personal. Rostock, Febrero 2006.
Justa T, St Aveb J, Paua HW, Guthoff RF. In vivo observation of papillae of the human tongue using confocal laser scanning microscopy. ORL 2005; 67: 207-212.