REVISIÓN ACTUALIZADA
MONTERO MORENO JA1, RUIZ MORENO JM2, FERNÁNDEZ MUÑOZ M3, DE LA VEGA GALIANA C4
(1) Doctor en Medicina y Cirugía. Unidad de
Retina Vítreo. Instituto Oftalmológico de Alicante, VISSUM. Servicio de
Oftalmología. Hospital Pío del Río Hortega. Valladolid.
(2) Doctor en Medicina y Cirugía. Profesor Titular del Departamento de
Oftalmología. Universidad Miguel Hernández de Alicante.
(3) Doctora en Medicina y Cirugía. Servicio de Oftalmología. Hospital Pío del
Río Hortega. Valladolid.
(4) Doctora en Medicina y Cirugía. Unidad de Retina Vítreo. Instituto
Oftalmológico de Alicante, VISSUM.
RESUMEN
Presentamos un resumen del empleo del acetónido de triamcinolona intravítreo en el tratamiento de la patología vitreorretiniana.
El acetónido de triamcinolona es un esteroide en forma depot que, pese a no estar formulado para su uso oftalmológico, está experimentando un gran auge en su empleo intraocular, tanto para el tratamiento del edema macular de diferentes causas, como complemento de la terapia fotodinámica por su acción antiangiogénica o en la cirugía del segmento posterior, para mejorar la visualización de estructuras y reducir la proliferación vitreorretiniana.
Palabras clave: Acetónido de triamcinolona, degeneración macular asociada a la edad, edema macular, cirugía vitreorretiniana.
El acetónido de triamcinolona (Trigon depot®) (AT) es un derivado sintético de la triamcinolona, cuatro veces más potente que ésta, y ocho veces más potente que la prednisona en modelos animales de inflamación. Se presenta en forma de un polvo cristalino, en suspensión en viales de 1 cc y 40 mg. Es insoluble en agua y soluble en alcohol, metanol y cloroformo. En la presentación comercial Trigón depot® (Squibb Industria Farmacéutica, SA. Barcelona), tiene como vehículo el alcohol bencílico, así como 0,75% de carboximetilcelulosa, 0,04% de polisorbato, e hidróxido sódico y ácido clorhídrico para ajustar el pH final entre 5.0 y 7.5 (1).

Desde un punto de vista farmacológico el AT es un éster de triamcinolona (fig. 1), lo cual le proporciona su mecanismo depot. En contacto con las esterasas tisulares se produce una desesterificación liberándose la forma activa que es ligeramente más soluble en agua.
![]()
Fig. 1. Molécula de acetónido de triamcinolona
(izquierda) y de triamcinolona (derecha), tras la pérdida del grupo éster.
El AT se viene utilizando con frecuencia cada vez mayor en la práctica médica y quirúrgica oftalmológica, en ensayos piloto para el tratamiento de patología edematosa, proliferativa y neovascular, y como adyuvante en la cirugía vitreorretiniana.
El uso intravítreo del AT fue iniciado en los años 70 por Machemer en un modelo animal, con el objetivo de conseguir una eficacia superior a la obtenida mediante la administración tópica, sistémica o periocular (2). En la actualidad el empleo intravítreo a diferentes concentraciones es cada vez más habitual en el tratamiento del edema macular asociado a retinopatía diabética (3), oclusión de vena retiniana (4), cirugía (5) e inflamación (6). Igualmente, sus propiedades antiangiogénicas se emplean en el tratamiento de la neovascularización subretiniana (NVC), ya sea de forma aislada (7,8) o asociada a la terapia fotodinámica (TFD) (9-18).
De forma similar, la concentración de AT que se debe emplear para su uso intraocular tampoco es bien conocida, con un amplio rango entre 1 y 25 mg/0,1 ml. En la actualidad, cada vez más autores propugnan el empleo de altas concentraciones (20 a 25 mg/0,1 ml) para su uso intraocular (3,19-21).
La farmacocinética del AT en el ojo no es bien conocida, si bien parece que la forma libre alcanzaría el equilibrio a una concentración en torno a los 25-30 microgramos/ml, midiéndose en el humor acuoso niveles de 2,1 a 7 microgramos/ml tras la inyección intravítrea. Se desconocen cuáles son sus niveles terapéuticos; sin embargo los resultados obtenidos en la clínica sugieren resultados favorables tras su administración a dosis superiores a los 4 mg, sin haberse comunicado su toxicidad tras la administración de dosis de 20 mg o superiores. Este aspecto la diferencia de otros corticoides como la prednisona, para la cual se ha descrito toxicidad en su uso intravítreo. Probablemente esta diferencia sea debida a la relativamente baja concentración de medicamento en forma libre que se consigue con el AT, lo cual le proporcionaría un rango terapéutico muy favorable (1,22).
Se ha calculado que la administración de AT intravítrea en dosis de 20 mg, equivaldría en términos de concentración y de duración del efecto farmacológico a la administración intramuscular de unos 300 g de dicho fármaco.
Los estudios realizados en modelos animales otorgan al AT una vida media de 18,6 días tras la inyección intravítrea de 4 mg en ojos intactos frente a tan sólo de 3,2 días para ojos vitrectomizados, siendo detectable la presencia del fármaco a los 93 días de la inyección.
El AT disponible comercialmente utiliza alcohol bencílico como disolvente, lo cual se cree puede ser la causa de algunos de los casos producidos de endoftalmitis estériles.
Dado que el AT es un medicamento que no está diseñado ni en su formulación ni en su concentración para su uso intraocular, se han desarrollado diferentes procedimientos para su purificación y concentración. Por un lado se utilizan procedimientos de filtración para posteriormente lavar y recuperar el polvo depositado en el filtro, ya libre de excipientes y a la concentración deseada; y por otro lado procedimientos de centrifugación o decantado del preparado comercial (fig. 2). Si bien estos procedimientos pueden facilitar la disminución de la concentración de los excipientes, especialmente del alcohol bencílico, la predictibilidad de la concentración final es discutible. Se ha observado que el empleo de filtros con poro de mayor tamaño, supone una reducción de la concentración final útil del fármaco, probablemente por un atrapamiento de los cristales en el poro o por el paso de parte del fármaco a través del filtro. En cambio los procedimientos de centrifugación y decantación consiguen resultados más predecibles, si bien la centrifugación y posterior resuspensión del precipitado pueden suponer una mayor manipulación del fármaco incrementando los riesgos de contaminación (23).

Fig. 2. Decantado y concentración del acetónido de triamcinolona en la jeringa
de insulina colocada a 45º. Tras la decantación del fármaco, se purga el
sobrenadante y se inyecta con una aguja de 30G.
El empleo intravítreo del AT no se encuentra libre de efectos secundarios siendo los más frecuentes la aparición de cataratas y la elevación de la presión intraocular. Destaca por su gravedad la posible aparición de endoftalmitis. El desprendimiento de retina o la producción de hemorragias vítreas, si bien son posibles, son muy infrecuentes (24).
Cabe reseñar a este respecto la aparición de endoftalmitis estéril con hipopión, habitualmente antes de las 24 horas de la inyección, con ausencia de gérmenes detectables mediante cultivos ni reacción en cadena de la polimerasa. Este proceso es poco frecuente (inferior al 1%), habitualmente cede tras la administración de corticoides tópicos y/o lavado de la cámara anterior, y se asocia hasta en un 57% de los casos a inyecciones repetidas de AT, lo que podría relacionarlo con un mecanismo inmunológico más que con la toxicidad directa provocada por el AT o por los excipientes (25,26).
Existen otros procedimientos de administración de corticoides en forma de depósito, bien por vía intravítrea unidos a un polímero, como es el caso de Posurdex (Dexametasona), Fluometolona, o por vía yuxtaescleral posterior como el Retaane (Anecortave) o el mismo AT.
Entre las aplicaciones prácticas de la inyección de AT intravítrea se incluyen en la actualidad:
El tratamiento de la degeneración macular, bien de forma aislada o asociado a la terapia fotodinámica (TFD), por su acción inhibidora de la proliferación vascular.
El tratamiento del edema macular asociado a uveítis, a las oclusiones venosas retinianas, a la retinopatía diabética y a la cirugía, por su efecto reductor de la permeabilidad vascular.
La reducción de la inflamación postquirúrgica y de la proliferación vitreorretiniana (38).
Como adyuvante de la cirugía para mejorar la visualización del vítreo, hialoides posterior, membrana limitante interna y membranas epirretinianas.
DEGENERACIÓN MACULAR ASOCIADA A LA EDAD (DMAE)
Jonas demostró el efecto beneficioso de la inyección intravítrea de 20 mg de AT en el tratamiento del desprendimiento seroso del epitelio pigmentario (DSEP), consiguiendo su aplanamiento y en ocasiones la mejoría de agudeza visual, si bien en otras formas de DMAE no se han conseguido tan buenos resultados (28).
El estándar de tratamiento de las formas exudativas de DMAE es en estos momentos la TFD, si bien los nuevos antiangiogénicos experimentan un auge cada vez mayor, fruto de los buenos resultados comunicados con Macugen®, Lucentis® y Avastin®. LA TFD tiene un efecto limitado por la reaparición de los neovasos, y la necesidad de repetición del tratamiento, con disminución progresiva de la agudeza visual. Con la finalidad de evitar dicha repermeabilización se ha postulado el empleo de fármacos antiangiogénicos por vía intravítrea (Macugen®, Lucentis®, Avastin®, AT) o yuxtaescleral (Retaane®, AT). Los esteroides son una opción aceptable por su acción antiangiogénica y proangiostática, además de reducir la permeabilidad vascular. Entre ellos el AT es barato, accesible y ha demostrado su capacidad angiostática en modelos animales de neovascularización. Los resultados antiangiogénicos del AT se han podido comprobar tanto por vía intravítrea como yuxtaescleral. Hemos podido comprobar cómo el empleo de inyecciones intravítreas de 20 mg de AT a los 3 días de la realización de TFD, en pacientes con formas clásicas, mínimamente clásicas y ocultas de DMAE, reduce la necesidad de repetir el tratamiento a los 3 meses (del 93 al 33%), a los 6 meses (del 66 al 21%) y al año (del 33 al 0%) (fig. 3). Además hemos conseguido una estabilización significativa de la agudeza visual, en comparación con los resultados de la TFD aislada. En estos casos el empleo de altas dosis de AT en la inyección se vería justificado por la reducción de necesidad de repetir la inyección (la duración del AT en vítreo sería de unos 6 meses), reduciendo con ello la morbilidad derivada del proceso de inyección (24).

Fig. 3. Angiografías correspondientes a membranas neovasculares ocultas
(izquierda), mínimamente clásicas (centro) y clásicas (derecha) tras terapia
fotodinámica seguidas de inyección intravítrea de 20 mg de acetónido de
triamcinolona. Fila superior: previa al tratamiento. Fila central: a los 3 meses
del tratamiento. Fila inferior: a los 6 meses del tratamiento.
De forma similar, el empleo de AT como adyuvante de la TFD en casos de NVC asociados a grandes hemorragias subretinianas planas y en ausencia de desgarros del epitelio pigmentario, se ha asociado a buenos resultados anatómicos y funcionales (29). Estos casos, para los cuales no existe un tratamiento consensuado, se enfrentan por un lado a la toxicidad química del hierro liberado por la hemorragia que actúa promoviendo la inflamación mediante la liberación de radicales libres, y por otro lado a la evolución del proceso causante de la hemorragia, la NVC. El tratamiento de 10 pacientes con NVC asociada a la DMAE con un componente hemorrágico superior al 50% de la lesión (no tratables mediante TFD, según los criterios convencionales), mediante TFD asociada a 20 mg intravítreos de AT, se asoció en 5 casos al cierre de la lesión NV a los 3 meses y en 8 casos al cierre a los 6 meses. Además, la agudeza visual permaneció estable en 2 ojos, mejoró en 6 y empeoró en 2 casos. También se asistió a la reducción de la hemorragia en todos los casos con desaparición completa en 5 casos. Igualmente se apreció cómo el pronóstico visual era mejor en aquellos casos en los que la fóvea no se encontraba afectada por la hemorragia en las fases iniciales.
Un nuevo enfoque de la asociación entre TFD y AT es el caso de los DSEP extensos. En estos casos, debido al riesgo de aparición de desgarros del epitelio pigmentario, bien espontáneos o asociados a la TFD, se recomienda la asociación de AT intravítrea, seguida de la realización de TFD en un plazo entre 15 días y 1 mes, cuando se haya logrado el aplanamiento del DSEP.
EDEMA MACULAR ASOCIADO A LA UVEÍTIS
El AT intravítreo es también un tratamiento eficaz en el manejo de de la inflamación ocular de origen no infeccioso y asociado a las uveítis. Debido a los riesgos que se asocian a este procedimiento, y que se relacionan al final del trabajo, esta modalidad terapéutica debe reservarse para casos de uveítis posteriores e intermedias y panuveítis, que comprometan seriamente la visión del ojo, o en casos en los que el tratamiento sistémico no sea bien tolerado, siempre que se haya descartado la etiología infecciosa.
Se ha empleado con éxito, entre otras en el tratamiento de oftalmía simpática (40), enfermedad de Behçet, vasculitis retiniana idiopática (41) y en la enfermedad de Vogt-Koyanagi-Harada (42). En concreto, el éxito en el tratamiento con AT se asocia más a aquellos casos con un gran componente edematoso retiniano, y peor en los casos de Behçet.
El edema macular cistoide es la primera causa de disminución de la agudeza visual en la uveítis, y con frecuencia es resistente a los tratamientos mediante corticoides y antiinflamatorios tópicos o sistémicos e inmunosupresores. Antcliff y cols (43) han publicado buenos resultados tras el tratamiento del edema macular cistoide resistente a otros tratamientos asociado a la uveítis mediante inyecciones intravítreas de 2 mg de AT. En los 6 pacientes tratados se apreció mejoría del edema al cabo de 1 semana, con resolución completa en 5 casos, si bien el edema reapareció antes de 3 meses. Igualmente se pudo apreciar que la recuperación anatómica de la mácula no se asoció a la mejoría de la agudeza visual, probablemente debido a la larga evolución del edema.
Parece ser que el TA es un tratamiento eficaz en el manejo del edema cistoide asociado a la uveítis, teniendo en cuenta que la mejoría de la agudeza visual se correlacionará con el tiempo de evolución, aspecto éste que debe limitar la aplicación de este tratamiento, que no está exento de riesgos.
RETINOPATÍA DIABÉTICA
El AT se ha empleado en pacientes con edema macular diabético, bien de forma aislada o en asociación a fotocoagulación posterior, en concentraciones entre los 4 y los 20 mg (33-36). Sin embargo se echan en falta estudios homogéneos randomizados, ya que en las series publicadas se incluyen pacientes con y sin láser previo, y los seguimientos son muy variables.
Se ha podido comprobar una reducción del edema macular tanto mediante OCT como angiográfico, si bien la mejoría de la agudeza visual no es tan notable. Además con frecuencia se hace necesario repetir la inyección a los 3 ó 6 meses. También en estos casos se ha podido comprobar cómo la larga evolución del edema y la presencia de isquemia macular tendrán una repercusión negativa sobre la mejoría de la agudeza visual.
Otra opción sería su asociación a la cirugía de catarata en pacientes con edema macular en quienes la opacidad de medios impedía la fotocoagulación, o ésta no había tenido buenos resultados. En una serie con estas características, Habib y colaboradores inyectaban 4 mg de AT al final de la cirugía, consiguiendo importantes mejorías en la agudeza visual y reducción del edema macular en casi todos los casos (36).
En pacientes con retinopatía diabética proliferativa y desprendimiento de retina traccional, su uso asociado a la vitrectomía parece reducir la tasa de redesprendimiento y proliferación vitreorretiniana (38).
EDEMA MACULAR POR TROMBOSIS VENOSA (TV)
El empleo de AT intravítrea (12,35) puede reducir el edema angiográfico y en OCT y mejorar la agudeza visual en casos de edema macular asociado a TV. Sin embargo en las formas isquémicas es frecuente la falta de respuesta funcional al tratamiento (fig. 4).
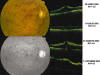
Fig. 4. Retinografía, angiografía y tomografía de coherencia óptica en un
paciente con trombosis de vena central de retina, previa y tras la inyección de
20 mg de acetónido de triamcinolona intravítreo, con evolución de la agudeza
visual. Tras la mejoría inicial de la agudeza visual, reapareció el edema
macular y la agudeza visual volvió a descender, sin respuesta posterior a los
corticoides.
En los cuadros no isquémicos la respuesta es habitualmente más favorable y comparable a la que se consigue en pacientes con edema macular diabético.
En este proceso la acción del AT se explicaría por su papel estabilizador de la barrera hematorretiniana, y por su actuación sobre las prostaglandinas y leucotrienos y posiblemente también sobre el factor de crecimiento endotelial vascular (VEGF).
EDEMA MACULAR CISTOIDE POSTQUIRÚRGICO
Se ha empleado la inyección intravítrea de AT en el tratamiento del edema macular cistoide postquirúrgico (EMCP) refractario a otros tratamientos, a concentraciones entre 1 y 25 mg/0,1 ml, apreciándose con todas ellas buenos resultados anatómicos y en ocasiones funcionales, dependientes del tiempo de evolución. Habitualmente también se aprecia una vuelta al estado inicial entre las 6 semanas y los 6 meses, siendo con frecuencia necesario recurrir a la repetición de la inyección.
Probablemente el efecto del AT esté mediado por la inhibición de la síntesis de leucotrienos y prostaglandinas y la estabilización de la barrera hematorretiniana.
Un caso especial en el que algunos autores recomiendan el empleo de TA intravítrea en la prevención del EMCP son los pacientes con retinopatía diabética, recomendándose la realización de la inyección en el momento de la cirugía para reducir o evitar su aparición.
Si bien el escenario más frecuente es el de la cirugía de la catarata, se ha empleado también tras la cirugía filtrante, queratoplastia, y cirugía vitreorretiniana.
OTROS EDEMAS MACULARES
De forma menos habitual, se ha empleado la inyección de AT en el tratamiento del edema macular asociado al otros procesos vasculares como la enfermedad de Coats, las telangiectasias yuxtafoveales, y la retinopatía postirradiación. En estas series el número de casos es tan reducido (en ocasiones único) que no permiten una valoración real de sus resultados.
En los casos asociados a retinosis pigmentaria se han conseguido buenos resultados en casos aislados, asociados a una reducción objetiva del edema macular. Sin embargo, se carece de series prospectivas que respalden estos datos.
CIRUGÍA
El AT se está utilizando actualmente también en la cirugía vitreorretiniana para facilitar la visualización del vítreo y de la hialoides posterior y permitir así una vitrectomía más completa y un mejor despegamiento de la hialoides. También se puede emplear en la visualización de las membranas epirretinianas y de la membrana limitante interna, en sustitución de otros colorantes de mayor toxicidad que se venían empleando, como el verde indocianiana y el azul tripán (39,44).
Se ha empleado en la visualización del perfluorocarbono líquido al final de la cirugía para facilitar su completa eliminación (45).
Otras aplicaciones en cirugía, son la visualización de los restos de vítreo tras la cirugía complicada del segmento anterior (46).
A una mayor difusión del empleo del AT contribuye el hecho de reducir la aparición de edemas maculares tras la cirugía, especialmente en pacientes diabéticos, y de reducir el riesgo de proliferación vitreorretiniana.
INCONVENIENTES DEL USO INTRAVÍTREO DE AT
Entre los inconvenientes del AT cabe destacar:
— Es un medicamento que no está diseñado, recomendado ni indicado por el fabricante para su uso intraocular ni periocular. Por este motivo se hace necesario eliminar el disolvente, potencialmente tóxico, y concentrar el fármaco. De entre los procedimientos mencionados, pensamos que el más seguro en cuanto a la predictibilidad de la dosis final y por la menor manipulación y derivada de ella, menor riesgo de contaminación e infección, es la decantación.
Además ha de recordarse que se trata de una administración fuera de su indicación original. Debemos ser especialmente cuidadosos al explicar al paciente el procedimiento y sus riesgos, así como a la hora de obtener su consentimiento informado
— El riesgo de infecciones está siempre presente en todo procedimiento que conlleve la entrada en el globo ocular. Es necesario extremar las medidas asépticas que rodean a la inyección. En especial se recomienda el empleo de colirios antibióticos los días previos y posteriores a la inyección, el empleo de blefarostato y pinzas estériles, la instilación de povidona iodada al 5% inmediatamente antes de la inyección con lavado de los fondos de saco conjuntivales (lavado con 10 cc de la disolución de povidona iodada al 5%), el empleo de guantes y campo estéril, y reducir al mínimo la manipulación del fármaco. En estos casos la alta concentración del esteroide puede enmascarar los signos inflamatorios iniciales de la endoftalmitis, por lo que con frecuencia el único signo apreciable sería una disminución de la agudeza visual.
— La aparición de cataratas y la elevación de la presión intraocular (PIO) es muy probable (entre el 30 y el 50% de los casos).
La elevación de la PIO suele ser transitoria y puede aparecer al cabo de varios meses tras la inyección. Suele desaparecer durante el segundo año del seguimiento. No siempre se asocia a pacientes respondedores a los corticoides por vía tópica. La respuesta al tratamiento médico es habitualmente buena, aún cuando en ocasiones es necesario asociar varios fármacos e incluso inhibidores de la anhidrasa carbónica por vía oral. Se han comunicado buenos resultados tras la trabeculoplastia láser, y en ocasiones se hace preciso recurrir a la cirugía filtrante.
No obstante, pensamos que los riesgos tratables de cataratas y elevación de la PIO son riesgos asumibles ante patologías que de otra forma pueden comprometer seriamente la visión central (24).
BIBLIOGRAFÍA
Hardman J, Limbird L, Goodman A. Goodman and Gilman’s The pharmacological basis of therapeutics. Décima edición, McGraw-Gil. Chicago 2001; 1673-1685.
Machemer R, Sugita G, Tano Y. Treatment of intraocular proliferation with intravitreal steroids. Trans Am Ophth Soc 1979; 77: 177-178.
Jonas JB, Söfker A. Intraocular injection of crystalline cortisone as adjunctive treatment of diabetic macular edema. Am J Ophthalmol 2001; 132: 425-427.
Park CH, Jaffe GJ, Fekrat S. Intravitreal triamcinolone acetonide in eyes with cystoid macular edema associated with central retinal vein occlusion. Am J Ophthalmol 2003; 3: 419-425.
Boscia F, Furino C, Dammacco R, Ferreri P, Sborgia L, Sborgia C. Intravitreal triamcinolone acetonide in refractory pseudophakic cystoid macular edema: functional and anatomic results. Eur J Ophthalmol 2005; 15: 89-95.
Degenring RF, Jonas JB. Intravitreal injection of triamcinolone acetonide as treatment for chronic uveítis. Br J Ophthalmol 2003; 87: 361.
Gillies MC, Simpson JM, Luo W, Penfold P, Hunyor AB, Chua W, Mitchell P, Billson F. A randomized clinical trial for a single dose of intravitreal triamcinolone acetonide for neovascular age-related macular degeneration. Arch Ophthalmol 2003; 121: 667-673.
Jonas JB, Kreissig I, Degenring R. Intravitreal triamcinolone acetonide for treatment of intraocular proliferative, exudative, and neovascular diseases. Prog Retin Eye Res 2005; 24: 587-611.
Spaide RF, Sorenson J, Maranan L. Combined photodynamic therapy with verteporfin and intravitreal triamcinolone acetonide for choroidal neovascularization. Ophthalmology 2003; 110: 1517-1525.
Rechtman E, Danis RP, Pratt LM, Harris A. Intravitreal triamcinolone with photodynamic therapy for subfoveal choroidal neovascularization in age related macular degeneration. Br J Ophthalmol 2004; 88: 344-347.
Spaide RF, Sorenson J, Maranan L. Photodynamic therapy with verteporfin combined with intravitreal injection of triamcinolone acetonide for choroidal neovascularization. Ophthalmology 2005; 112: 301-304.
Augustin AJ, Schmidt-Erfurth U. Verteporfin therapy combined with intravitreal triamcinolone in all types of choroidal neovascularization due to age related macular degeneration. Ophthalmology 2006; 113: 14-22.
Augustin AJ, Schmidt-Erfurth U. Verteporfin and intravitreal triamcinolone acetonide combination therapy for occult choroidal neovascularization in age related macular degeneration. Am J Ophthalmol 2006; 141: 638-645.
Ruiz-Moreno JM, Montero J, Barile S, Zarbin M. Photodynamic therapy and high doses intravitreal triamcinolone to treat exudative age-related macular degeneration: One year outcome. Retina 2006; 26: 602-12.
Chan WN, Lai TY, Wong AL, Tong JP, Liu DT, Lam DS. Combined photodynamic therapy and intravitreal triamcinolone injection for the treatment of subfoveal choroidal neovascularization in age related macular degeneration. A comparative study. Br J Ophthalmol 2006; 90: 337-341.
Nicolo M, Ghiglione D, Lai S, Nasciuti F, Cicinelli S, Calabria G. Occult with no classic choroidal neovascularization secondary to age related macular degeneration treated by intravitreal triamcinolone and photodynamic therapy with verteporfin. Retina 2006; 26: 58-64.
Krebs I, Binder S, Stolba U. A new treatment regimen in combined intravitreal injection of triamcinolone acetonide and photodynamic therapy. Graefes Arch Clin Exp Ophthalmol 2005; 6: 1-5.
Ruiz-Moreno JM, Montero J, Barile S. Triamcinolone and PDT to treat exudative age-related macular degeneration and submacular hemorrhage. Eur J Ophthalmol 2006; 16: 426-434.
Jonas JB, Degenring RF. Intravitreal injection of crystalline triamcinolone acetonide in the treatment of diffuse diabetic macular oedema. Klin Monatsbl Augenheilkd 2002; 219: 429-432.
Jonas JB, Kreissig I, Sofker A, Degenring RF. Intravitreal injection of triamcinolone for diffuse diabetic macular edema. Arch Ophthalmol 2003; 1: 57-61.
Degenring RF, Kreissig I, Jonas JB. Intraocular triamcinolone for diffuse diabetic macular oedema. Ophthalmologe 2004; 10: 113-120.
Kwak HW, D’Amico DJ. Evaluation of the retinal toxicity and pharmacokinetics of dexamethasone after intravitreal injection. Arch Ophthalmol 1992; 110: 259-266.
García-Arumí J, Boixadera A, Giralt J, Martínez-Castillo V, Gómez-Ulla F, Corcostegui B, García-Arumí E. Comparison of different techniques for purification of triamcinolone acetonide suspension for intravitreal use. Br J Ophthalmol 2005; 89: 1112-1114.
Ruiz-Moreno JM, Montero J, Barile S, Zarbin M. Photodynamic therapy and high doses intravitreal triamcinolone to treat exudative age-related macular degeneration: One year outcome. Retina 2006; 26: 602-612.
Moshfeghi DM, Kaiser PK, Bakri SJ, Kaiser RS, Maturi RK, Sears JE, Scott IU, Belmont J, Beer PM, Quiroz-Mercado H, Mieler WF. Presumed sterile endophthalmitis following intravitreal triamcinolone acetonide injection. Ophthalmic Surg Lasers Imaging 2005; 36: 24-29.
Roth DB, Chieh J, Spirn MJ, Green SN, Yarian DL, Chaudhry NA. Noninfectious endophthalmitis associated with intravitreal triamcinolone injection. Arch Ophthalmol 2003; 121: 1279-1282.
Jonas JB, Kreissig I, Degenring R. Intravitreal triamcinolone acetonide for treatment of intraocular proliferative, exudative, and neovascular diseases. Prog Retin Eye Res 2005; 24: 587-611.
Jonas JB, Spandau UH, Harder B, Vossmerbaeumer U, Kamppeter BA. Intereye difference in exudative age-related macular degeneration with minimally classic or occult subfoveal neovascularization after unilateral intravitreal injection of triamcinolone acetonide. Am J Ophthalmol 2005; 139: 1073-1079.
Ruiz-Moreno JM, Montero J, Barile S. Triamcinolone and PDT to treat exudative age-related macular degeneration and submacular hemorrhage. Eur J Ophthalmol 2006; 16: 426-434.
Rechtman E, Danis RP, Pratt LM, Harris A. Intravitreal triamcinolone with photodynamic therapy for subfoveal choroidal neovascularization in age related macular degeneration. Br J Ophthalmol 2004; 88: 344-347.
Degenring RF, Jonas JB. Intravitreal injection of triamcinolone acetonide as treatment for chronic uveítis. Br J Ophthalmol 2003; 87: 361.
Park CH, Jaffe GJ, Fekrat S. Intravitreal triamcinolone acetonide in eyes with cystoid macular edema associated with central retinal vein occlusion. Am J Ophthalmol 2003; 3: 419-425.
Avitabile T, Longo A, Reibaldi A. Intravitreal triamcinolone compared with macular laser grid photocoagulation for the treatment of cystoid macular edema. Am J Ophthalmol 2005; 140: 695-702.
Jonas JB, Degenring RF, Kamppeter BA, Kreissig I, Akkoyun I. Duration of the effect of intravitreal triamcinolone acetonide as treatment for diffuse diabetic macular edema. Am J Ophthalmol 2004; 138: 158-160.
Flynn HW Jr, Scott IU. Intravitreal triamcinolone acetonide for macular edema associated with diabetic retinopathy and venous occlusive disease: it's time for clinical trials. Arch Ophthalmol 2005; 123: 258-259.
Habib MS, Cannon PS, Steel DH. The combination of intravitreal triamcinolone and phacoemulsification surgery in patients with diabetic foveal oedema and cataract. BMC Ophthalmol. 2005; 5: 15.
Boscia F, Furino C, Dammacco R, Ferreri P, Sborgia L, Sborgia C. Intravitreal triamcinolone acetonide in refractory pseudophakic cystoid macular edema: functional and anatomic results. Eur J Ophthalmol 2005; 15: 89-95.
Munir WM, Pulido JS, Sharma MC, Buerk BM. Intravitreal triamcinolone for treatment of complicated proliferative diabetic retinopathy and proliferative vitreoretinopathy. Can J Ophthalmol. 2005; 40: 598-604.
Furino C, Micelli Ferrari T, Boscia F, Cardascia N, Recchimurzo N, Sborgia C. Triamcinolone-assisted pars plana vitrectomy for proliferative vitreoretinopathy. Retina. 2003; 23: 771-776.
Jonas JB. Intravitreal triamcinolone acetonide for the treatment of sympathetic ophthalmia. Am J Ophthalmol. 2004; 137: 367-368.
Benitez del Castillo Sanchez JM, Garcia Sanchez J. Inyección intravítrea de acetónido de triamcinolona en uveítis no infecciosas. Arch Soc Esp Oftalmol 2001; 76: 661-664.
Andrade RE, Muccioli C, Farah ME, Nussenblatt RB, Belfort R Jr. Intravitreal triamcinolone in the treatment of serous retinal detachment in Vogt-Koyanagi-Harada syndrome. Am J Ophthalmol. 2004 Mar; 137: 572-574.
Antcliff RJ, Spalton DJ, Stanford MR, Graham EM, Ffytche TJ, Marshall J. Intravitreal triamcinolone for uveitic cystoid macular edema: an optical coherence tomography study. Ophthalmology. 2001 Apr; 108: 765-772.
Tognetto D, Zenoni S, Sanguinetti G, Haritoglou C, Ravalico G. Staining of the internal limiting membrane with intravitreal triamcinolone acetonide. Retina. 2005; 25: 462-467.
Hirata F, Tamura H, Ogura Y. Visualization of residual perfluorocarbon liquid using intravitreal triamcinolone acetonide. Ophthalmic Surg Lasers Imaging. 2005; 36: 169-172.
Burk SE, Da Mata AP, Snyder ME, Schneider S, Osher RH, Cionni RJ. Visualizing vitreous using Kenalog suspension. J Cataract Refract Surg 2003; 29: 645-651.