
Fig. 1. Placentofagia. Vaca recién parida comiendo su placenta y membranas fetales.
HISTORIA Y HUMANIDADES
MURUBE J, RIVAS L, REBOLLEDA G, CANDELA I, MURUBE I, SALES-SANZ M, GARCÍA PÉREZ J, BARROSO E, CHENZHUO L
Hospital Ramón y Cajal.
Este trabajo ha sido desarrollado con la colaboración de la Fundación de
Investigación Médica Mutua Madrileña.
En el desarrollo filogenético de la vida animal, hace unos 220 millones de años surgimos los mamíferos placentarios. Cuando dábamos a luz, tras nuestra cría salía un cordón umbilical, y unida a él, una masa sanguinolenta que hoy llamamos placenta. La criatura despertaba un instinto de atención y cuidados en la madre mayor que en sus predecesores, porque algunas glándulas sudoríparas modificadas, las glándulas mamarias maternas, serían forzosamente las encargadas de suministrarle la nutrición necesaria. No sabemos si el instinto de que las hembras se coman la placenta de su cría surgió simultáneamente o a lo largo del tiempo, pero es el caso que actualmente lo tienen gran número de mamíferos, incluídos los herbívoros (fig. 1). Este fenómeno, conocido como placentofagia instintiva, actualmente perdido en la especie humana, es objeto de especulación científica. Se le han buscado diversas explicaciones, todas ellas hipotéticas: (1) para cortar el cordón umbilical, lo que inconscientemente se extiende a comer la placenta, e incluso ocasionalmente a comerse la cría recién nacida, (2) para no dejar restos que atraigan a insectos, predadores, y otros vivientes potencialmente peligrosos, (3) para mantener limpio el lugar del parto, especialmente si es una cueva, y (4) para no desperdiciar una comida calóricamente nutritiva. Con nuestros conocimientos actuales podemos añadir una quinta hipótesis, la ingestión de un producto cuya importancia no radica en el poder calórico, sino en su contenido en substancias estimulantes y protectoras. Sea cual sea la razón de la placentofagia instintiva, cualquiera de estas posibilidades no excluye a las otras. Lefebvre (192) cree que la placentofagia está inducida por el gen Mest/Pegl, en el cromosoma 7q32.

Fig. 1. Placentofagia. Vaca recién parida comiendo
su placenta y membranas fetales.
Placenta significa en latín torta o pastel, y recibió este nombre por el aspecto externo de las bolsa de las aguas al caer al suelo tras su expulsión. Corion es término derivado del griego córion, que significa piel, cuero, y que también se aplicó a todo el conjunto de la bolsa formada por las membranas fetales, aunque hoy, en el lenguaje anatómico científico el término corion sólo se aplica a la membrana fetal externa. Amnion es un término griego, amnion (amnion), diminutivo de amnóV (amnós), que significó cordero y que por extensión, el término amnion también se aplicó en la Grecia clásica a la vasija que servía para recoger la sangre en los sacrificios religiosos, y a la bolsa de las membranas fetales, pero que hoy sólo se aplica a la membrana fetal interna. En español se dijo amnion, pero actualmente es más frecuente expresarlo como amnios, y bien merece la pena dedicar unas líneas al tema de su terminación en «n» o en «s».
La primera vez que se cita este término en castellano lo hace en 1551 el catedrático de la Universidad de Alcalá Andrés Laguna (183,161). En 1766, el diccionario de Terreros (332) lo cita en castellano como amnion, y añade que en francés —la lengua de la cultura en aquella época— se dice amnios. En inglés —la lengua de la transmisión científica tras la segunda guerra mundial— The Oxford English Dictionary lo recoge desde 1667 como amnion, añadiendo que amnios es una forma erróneamente tomada del griego. Hemos consultado el tema con la Profa. M.ª Dolores Jiménez, de la Cátedra de Griego de la Universidad de Alcalá, quien explica que en griego clásico, del substantivo amnoV (amnós, cordero), se derivó el adjetivo amneioV (amneíos), con algunas variantes como amneiós (amneiós) e incluso amnioV (ámnios), que significó «corderil» o «relativo al cordero», y que con el uso el adjetivo ocasionalmente acabó substantivándose, pudiendo significar «cordero». Añade que si la palabra griega nos hubiese llegado a través del latín, diríamos «amnio» (como actualmente se expresa en italiano), pero que como se tomó directamente del griego en la Edad Moderna, amnion es un cultismo correctísimo, mientras que amnios es un galicismo, hoy aceptado por la Real Academia.
Amnion y corion son de origen fetal. El amnion limita por su superficie interna el líquido amniótico en el que flota el feto, y por su superficie externa reviste todo el corion y el cordón umbilical. El corion se adhiere por su superficie interna al amnion, y por su superficie externa a la decidua, que es de origen materno (fig. 2). En el momento del parto, el amnion tiene un espesor medio de 0,2-0,4 mm y el corion de aproximadamente el doble. El amnio-corion que reviste el plato placentario es un poco más grueso. La decidua, es de origen materno, y es la mucosa uterina de la madre, transformada durante la gestación para conectar el útero materno a la superficie externa del corion y del plato placentario.
Fig. 2. Membranas fetales humanas al término de una gestación normal. A. Amnion:
tiene 3 capas: 1. Epithelium amnioticum: Capa monocelular de células cuboideas,
que contienen muchos gránulos secretorios y vesículas pinocíticas. 2. Membrana
basis, formada por una lámina lúcida y una lámina densa. 3. Stroma, subdividido
en tres estratos: lámina compacta, lámina fiboblástica y lámina spongiosa.
Contiene fibroblastos, colágena y otros componentes acelulares. La lámina
compacta es la que da mayor resistencia física al amnion. El Amnion carece de
vasos sanguíneos, linfáticos y fibras nerviosas. B. Corion: 1. lámina
cellularis. 2. lámina reticularis. 3. membrana pseudobasis. C. Decidua: Es la
mucosa uterina, de origen materno, transformada durante la gestación. Tras el
parto algunos restos de ella quedan adheridos a la superficie externa del
corion.
PRIMEROS USOS DE LAS MEMBRANAS FETALES Y PLACENTA EN MEDICINA
Hasta hace menos de un siglo, la causa más frecuente de muerte por lesiones cutáneas extensas debidas a quemaduras, causticaciones químicas y escaldados fue la hipotensión producida por la pérdida de plasma a través de la superficie dañada. Una destrucción dérmica del 25% del cuerpo de una persona de 70 kilos de peso produce la pérdida de unos 5 litros de plasma al día. Se ensayaron diversos métodos para evitar esta pérdida: untado de las áreas dañadas con manteca o con aceite, covertura con goma latex o con parafina, etc. todo ello con mal resultado. En 1910 Davis (66) sugirió usar amnion placentario para cubrir estas lesiones cutáneas, y 3 años más tarde Stern (325) usó la membrana amniótica para cubrir la superficies cutánea en quemaduras corporales, y Sabella (286), quien trabajaba con Stern, empleó el amnion y la superficie del cordón umbilical en 5 casos de ulceraciones cutáneas extensas, obteniendo buenos resultados.
En las décadas siguientes, la placenta, con o sin membranas fetales, se usó para problemas diferentes, ya como recubrimiento tectónico para hacer una vagina artificial (38,41,42), ya como un estimulante biológico reconstructivo (91).
En la década de 1920, Filatov (fig. 3), tras observar que algunas enfermedades mejoran en mujeres preñadas durante los últimos meses de gestación pensó que la placenta y las membranas fetales contienen estimuladores biogénicos. También dirigió su atención a otros tejidos animales y a algunos extractos vegetales, como los del género Aloe (Aloe vera, etc.). En la década de 1930 usó placenta y cordón umbilical para estimular los tejidos degenerados, lo que utilizó inicialmente en pacientes con retinosis pigmentosa, chorioretinosis myopica y degeneracion retiniana macular, y después lo extendió a queratitis herpética, dermatosis, síndrome de Alzheimer, y muchas otras enfermedades. Tras la segunda guerra mundial los escritos e ideas de Filatov (92,93) atravesaron el telón de acero político-militar y penetraron en los hiperosmóticos países occidentales, donde su uso se extendió (71,117,241,19, 69). Algunos autores especificaron la importancia de incluir el amnion de la placenta (71). El optimismo inicial se hizo muy controvertido en los años siguientes, y prácticamente la tisuoterapia feto-placentaria dejó de usarse en los países de occidente, pero persistió en la URSS y países satélites (282,282,155), donde con diversas variantes (amnio-corion, amnion, placenta con o sin membranas fetales) persistió como estimulante tisular o como cobertura mecánica (26). Curiosamente, el origen del big bang del presente uso de la membrana amniótica en oftalmología apareció hace tan sólo 10 años, y no por su uso en quemaduras cutáneas y en cirugía ginecológica, sino por una conexión directa de Rusia a HispanoAmérica y después a NorteAmérica (fig. 4).

Fig. 3. Vladimir Petrovich Filatov (1875-1956). Se graduó como médico en la
Universidad de Moscú en 1897. En 1936 fundó en Odessa (Ucrania, antigua URSS) el
Instituto de Enfermedades Oculares y Terapia Tisular. Sus principales trabajos
se refirieron a tisuoterapia estimuladora con tejidos animales y vegetales, y a
transplantes corneales.
![]()
Fig. 4. Placentoterapia. 1. Incisión de la conjunctiva y cápsula de Tenon en el
cuadrante infero-lateral, a 10-12 mm del limbo. 2. Introducción de una pieza de
placenta del tamaño de un guisante (tomado de Arruga (10)).
Entretanto, durante el medio siglo transcurrido entre la segunda Guerra mundial y 1995, las membranes fetales se usaron en el mundo occidental más como una cobertura tectónica que como un estimulante biogénico, aunque a veces con la sospecha de que la cobertura o reconstrucción física se complementaba con algunas propiedades biológicas aditivas. En oftalmología, los primeros tejidos que se habían usado para reconstruir la conjuntiva de la superficie ocular fueron diversas membranas orgánicas, tales como la misma conjuntiva (32), mucosa oral (68), prepucio y labios menores de la vulva (58), mucosa vaginal (324) y peritoneo (39), pero su uso no se extendió debido a sus pobres resultados. Muchos años más tarde aparecieron reconstrucciones conjuntivales con otras membranas orgánicas, como pericardio (323,293) y pleura (252). El primer uso de membranas fetales en oftalmología se publicó en 1940 por de Rötth (68), quien usó membrana fetal de espesor total (amnion + corion) para reparar 8 casos de simbléfaron (7 por quemadura y 1 por pénfigo), y para agrandar y mantener el hueco orbitario en 2 casos. En los casos de simbléfaron hacía una perilimbotomía, y después cubría la córnea, la esclera y la superficie posterior de los párpados con membrana fetal total y la suturaba a los tendones musculares para reformar la superficie ocular y los fórnices. Ocasionalmente añadía una lente de contacto de cristal, que mantenía una semana. Obtuvo malos resultados por la retracción del implante, salvo en un caso que consideró un éxito. Puede ser, aunque no lo dejó claramente expresado, que De Rötth no solo pensó en una acción tectónica de cobertura sino que sospechó una estimulación biológica, pues en uno de sus casos de reconstrucción de la cavidad orbitaria intentó obtener la reepitelización de esta cavidad rellenándola con vernix caseosa, la capa sebácea que recubre la piel del feto.
En 1941, Brown (39) intentó reconstruir la superficie orbitaria con otras membranas animales, como peritoneo de conejo, pero fueron Sorsby et al (317,318) quienes volvieron a usar membrana amniótica en 1946 y 1947. Estos autores trataron con cobertura de membrana amniótica 58 casos de causticaciones oculares, 43 de ellas debidas a quemadura por cal, y el resto por otros cáusticos, pero sólo lo aplicaron para reparar la conjuntiva y evitar o reparar la retracción fornicial y simbléfaron. Utilizaban varias capas de amnion y suturaban la pieza resultante a la conjuntiva vecina. A las 4 horas el injerto se hacía transparente, y al tercer o cuarto día hacían la rafectomía o eliminación de suturas. No consideraban conveniente cubrir la superficie corneal porque pensaban que podía perjudicar la córnea y aumentar su nebulosidad (317), cosa ésta que no les ocurrió en todos los casos. Sorsby et al no escribieron apenas sobre el mecanismo de acción biológico, expresaron que la membrana amniótica no estimula el crecimiento, sino que actúa como un entablillado interno para la proliferación del tejido (318) y que aunque la separación mecánica de las superficies causticadas juega un papel, el rápido efecto del amnion sugería un efecto biológico que era más importante que el mecánico (317).
El mismo año 1946, Lavery (185) publicó otra aplicación reconstructiva de la superficie en un paciente que tuvo una salpicadura de cal en un ojo. Fue tratado con irrigación y atropina tópicas, y con una banda de «amnioplastina» que se le colocó 4 días después. A las 3 semanas la opacificación de la córnea se redujo marcadamente.
Diecinueve años después, en la discusión de una presentación de Roper-Hall (283), Sikka (308) manifestó que durante los dos últimos años había hecho implantes de membrana amniótica en pacientes con quemaduras de la superficie ocular, para prevenir la adhesión de estas superficies. Este cirujano adhería la membrana amniótica a un anillo de Flieringa el cual lo introducía en la cuenca lacrimal, de forma que el anillo quedaba expandiendo los fórnices conjuntivales y la membrana cubriendo toda la superficie. No tapaba el ojo durante los 3-4 días en que mantenía el anillo.
En 1985 Steinkogler et al (323) usaron membrana amniótica liofilizada para reconstruir defectos conjuntivales en conejos.
Tras la segunda Guerra Mundial, el inglés pasó a ser la lengua de la difusión científica, pero no se volvieron a hacer más publicaciones oftalmológicas en esta lengua hasta 30 años después, de manera que la reconstrucción física de la superficie ocular permaneció prácticamente desconocida para los oftalmólogos. Bruscamente, en 1995 se inició la gran explosión del uso de membrana amniótica en oftalmología. ¿Cómo ocurrió? ¿qué pasó para hoy cada año se publiquen más trabajos sobre membrana amniótica en oftalmología que en todas las otras especialidades médicas juntas?
Las cosas pasaron así. En 1989, Horacio Serrano, un oftalmólogo español nacionalizado en Venezuela, presidente de la Sociedad Venezolana de Oftalmología, visitó durante dos semanas la clínica del Dr. Ernst Muldasev, en Ufa (República de Bashkirskaia. 56º E, 55º N). Muldasev (228) era conocido por sus transplantes de tejidos orgánicos. Serrano pudo observar los pobres resultados que sus transplantes daban en pacientes con retinitis pigmentosa, pero los sorprendentes buenos efectos en los casos de reconstrucción de la superficie ocular. El tejido que Muldasev aplicaba lo denominaba «tejido conjuntival», pero rehusaba explicar qué clase de tejido conjuntivo era, aduciendo razones de patente. Serrano compró varias unidades, y en seguida de retornar a Venezuela las aplicó en el hospital Francisco Rísquez, de Caracas, cubriendo la superficie ocular en casos de pterygion, quemaduras por álcalis y simbléfaron, con resultados extraordinarios. Serrano y su discípulo Carlino González (297,298,115) dieron algunas conferencias en la República Dominicana, donde operaron varios casos con el Dr. Juan Batlle. Tras algunos análisis histológicos, descubrieron que el «tejido conjuntival» de Muldasev era membrana amniótica (23). Desde entonces, ellos prepararon sus propias membranas amnióticas conservándolas en alcohol absoluto. En 1992, Juan Batlle traspasó este conocimiento a Scheffer Tseng (24,188,232,78) quien trabajaba el Hospital Bascom Palmer (Miami FL), y en 1993 lo publicó (25). Tseng (fig. 5) inició la época actual de la membrana amniótica en oftalmología. Su interés, capacidad, habilidad y efectividad en la impulsión de equipos de trabajo atrajo la atención de los oftalmólogos e investigadores relacionados, y desde 1995 sus continuas investigaciones y publicaciones (162,163,349,351, 261-263,371,188,264,214,215,351,352,257,216, 217,353,251,49,40,218-220,258,354-356,313-315,6,7,22,140,57,221,357,358,127,128,340, 129,211,82,315,359,139) sacaron nuevos resultados en el tratamiento de la superficie ocular, y estimularon nuevos estudios en otras áreas de la oftalmología.
Fig. 5. El Dr. Scheffer Tseng con dos de los autores de este artículo, tras
operar un paciente con queratomalacia mediante cobertura con membrana amniótica,
en el verano de 1997, en el Hospital Ramón y Cajal, de Madrid.
USOS NO OFTALMOLÓGICOS DE LA MEMBRANA AMNIÓTICA HASTA 1995
Simultáneamente al escaso número de publicaciones sobre el uso de membrana amniótica en oftalmología, aparecieron algunas sobre sus usos en otras especialidades clínicas. El uso más frecuente hasta 1995 se dio en dermatología para proteger y curar las quemaduras, úlceras y heridas cutáneas (66,325,286,256,179, 346,255,60,369,34,30,86,269,2,266,307,373, 299,265,134,226,11,291,329,143,327,109). Ocasionalmente, estas lesiones cutáneas también se trataron con corion (73).
Otros usos se publicaron en oto-rino-laringología, para reconstrucciones de oreja (44), timpanoplastia en perforaciones (385) y en substitución de mucosa nasal (385,184). En ginecología, para tratar malformaciones congénitas, traumáticas u oncológicas de la vagina (38,41,42,210, 342,341,330,209,63,16,242,337,243,9), o para cubrir mastectomías (131). En estomatología, para reformar la cavidad bucal tras ablaciones de la mejilla (186), glosectomía total (175) o defectos vestibulares (133). En digestivo, para reconstruir la pared abdominal (309), reparar onfaloceles (111,336), cerrar fístulas entero-cutáneas (179), gastrosquisis (272), parcheos intestinales (18), substitución de peritoneo (342-344,112), prevención de adhesión a otros tejidos (345,15) y esplenorrafia experimental (81). En urología, para reconstruir la vejiga urinaria (245,94). En cardiología, para cierres pericárdicos (229). En neurología, para prevenir adhesiones meningo-cerebrales en accidente craneales (48), reparaciones de dura mater (42,48,269) o utilizándola como matriz para reinervaciones (67,65,43). En endocrinología, para crear una cámara de difusión para islotes de Langerhans en pacientes diabéticos (204) y en metabolopatías (5,2,292). Y en artrología, para artoplastias de la cadera (368).
USOS DE LA MEMBRANA AMNIÓTICA EN OFTALMOLOGÍA DESDE 1995
La reconstrucción conjuntival fue uno de los primeros y más importantes usos de membrana amniótica en casos de causticaciones, síndromes de Stevens-Johnson, penfigoides, extirpaciones conjuntivales tras melanosis, neoplasia, etc. (360,349,261,301,351,176,232,215,351,54, 180,51,362,114,104,288,75,219,220,77,295, 212,165,321,280,159,225,173,384,250,300, 157,27,72,296,365,315,253,35,146,160).
Para reconstrucción corneal, la membrana amniótica se usó primero experimentalmente (162,163), y después experimental y terapéuticamente en quemaduras, úlceras, perforaciones, queratomalacia, queratocono, etc. (360, 361, 214, 237, 164, 177, 14, 120, 363, 267, 257, 258,49, 52, 178, 165, 355, 220, 136, 103, 193, 79,173,174, 326, 322, 225, 300, 7, 166, 213, 365,121,122,169, 238-240, 17, 95, 211, 53, 33, 160,377,198) (fig. 6).
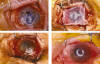
Fig. 6. A: Córnea que ha desarrollado una queratomalacia (corneal melting) tras
un proceso autoinmune con opacificación, vascularización y ulceración. No hay
perforación corneal, pues persiste la membrana de Descemet. B: Se rellenó el
área ulcerada con 4 capas de membrana amniótica y su cubrió todo ello y el resto
de la córnea con una monocapa de membrana amniótica con el epitelio hacia
arriba. C: Se hizo una perilimbotomía conjuntival. Se cortó toda la membrana
amniótica que sobrepasaba el limbo sobre la conjuntiva y sus bordes se
introdujeron bajo la conjuntiva de la perilimbotomía. Finalmente se suturó en
toda la circunferencia la membrana amniótica a la conjuntiva. D: Tres meses
después, la queratomalacia había desaparecido, aunque persistieron la opacidad y
vascularización corneal. Hay conjuntivalización corneal.
La expansión limbal sobre membrana amniótica fue introducida por Tsubota et al (360,361) y Tseng et al (350) como substrato para cultivar células estaminales limbales del epitelio corneal, o como substrato para auto- o alotransplantes en casos de quemaduras, síndromes de Stevens-Johnson, aniridia, penfigoides (262,351,302, 289,13,214,215,233,50,217,120,138,216,76, 149,347,273,258,6,12,171-174,357,334,221, 303,127,128,340,148,238-240,129,130,82,74, 211,335,253,83,359,276,196,197,139).
Otros usos oftalmológicos han sido en queratoplastias para cubrir la córnea y la conjuntiva bulbar (224), en cirugía refractiva, tras PRK y LASIK para reducir la inflamación, la nebulosidad corneal, y para facilitar la cicatrización (371, 372, 56,251,376), en pterygion (297, 261, 263, 302,1 04, 200, 190, 314, 224,304, 253, 35), en conjuntivochalasis (219,108,235), en aniridia (351,193,1221, 148,276), en perforación escleral (278,136), en glaucoma (fig. 7), para reparar o mantener las ampollas filtrantes antiglaucomatosas, así como para reparar la superficie ocular en tubos de drenaje expuestos (20, 21, 232, 100, 288, 22,258,40, 384,4), en cirugía palpebral para simbléfaron y entropion, mejorando los fórnices conjuntivales (349, 232, 31, 302, 178, 333), en oculoplástica (fig. 8) para rellenar subcutáneamente el surco orbito-palpebral en personas con él muy profundo (231), y en ojo seco, para parchear los puntos lacrimales en lugar de usar tapones plásticos (232,230,234,78) y para tratar temporalmente lesiones de keratoconjunctivitis sicca (320).
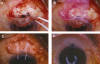
Fig. 7. Glaucoma crónico simple que había sido tratado con trabeculectomía y
mitomicina C, con buen resultado inmediato. Dos años después, la esclera se
fistulizó espontáneamente, bajando la presión intraocular a 0-3 mmHg y
apareciendo un edema macular. A: Se levantó la conjuntiva, se eliminó el iris
herniado (B), y se cubrió el área expuesta con una capa doble de membrana
amniótica (C), sobre la que se repuso la conjuntiva. D: La ampolla filtrante se
reformó, manteniéndose presiones intraoculares entre 9 y 14 mmHg.

Fig. 8. A: Surcos órbito-palpebrales superiores profundos. Marcado con lápiz
dermográfico del lugar de apertura de la piel y subcutáneo. B: Relleno del área
abierta con varias piezas de membrana amniótica de 3x3 cm plegada sobre sí
misma. C: Sutura de las piezas e membrana amniótica en el lugar deseado. D:
Aspecto meses después.
CARACTERÍSTICAS BIOLÓGICAS DEL AMNION
Simultáneamente a estas aplicaciones clínicas, ha habido una abundante investigación básica sobre anatomía (64,37,367) microscopía electrónica (260,78), citoesqueleto de las células epiteliales (247), filamentos intermediarios (28), fibronectina de la matriz extracelular (195), integrinas (316,203,36), histología de la membrana basal (381,45,78), tipos de colágena (222,223,8), etc. El amnion sirve como membrana semipermeable para estudiar el flujo de Mg en laboratorio (8), y para formar bolsas que contengan islotes de Langerhans (204,84) que permitan su transplante (110). La fuerza tensil de la membrana amniótica es muy alta, debido a su contenido en colágena (205), llegando a entre 0,05 y 0,45 kg/cm (259) y alcanzando presiones de ruptura de 393 a 900 mmHg (202).
La antigenicidad del amnion es escasa, y por ello no desencadena reyección inmunológica. El epitelio de la membrana amniótica expresa escasamente antígenos HLA y DR, o beta2-microglobulinas (73,116,85,5,2,375,150,135,181). El citoesqueleto y la matriz estromal también muestran una escasa antigenicidad (375). La antigenicidad de la córnea y del amnion tienen bastante similitud (59,294) y el epitelio limbal no reacciona contra la membrana amniótica (152). Esta escasa antigenicidad también es característica del amnion de otros animales, como los bóvidos (269), pero es preferible usar membranas amnióticas humanas porque son más fáciles de obtener en los hospitales mediante cesáreas programadas. En contraste con el amnion, el corion es bastante antigénico y provoca un fuerte rechazo en los transplantes alogénicos (73).
Los altos niveles de muchos factores de crecimiento y de mediadores mitogénicos de la membrane amniótica promueven la epitelización de la superficie corneal (151,270,152,328,147,375, 306,3,301,290,353,374,189,190,359,170,190, 178,311,57,27,378,340,359,139,191). Por el contrario, la membrana amniótica inhibe la neovascularización corneal y conjuntival (46,162,163,3,137,169,201,144).
Se ha estudiado la producción y acción del amnion en leucotrienos (271), prostaglandinas (158,113,284,312), interleukinas (284,90,282, 306,249,161,154,313), enzimas (29,2,254,118, 338,339,62,227,164,237,153,274), y su contenido vitamínico (246).
La acción antiinflamatoria del amnion ha sido reiteradamente evidenciada (60,343,237,137, 305,281). No obstante, se ha publicado un caso en el que repetidos recubrimientos corneales con membrana amniótica del mismo donante provocó hipopión que fue curado con corticosteroides (103), sugiriendo el autor el uso de diferentes donantes cuando haya que aplicar varios transplantes.
La cicatrización bajo el transplante de membrana amniótica es bien controlada, reduciéndose la proliferación fibroblástica, y la cicatriz exuberante (60,343,188,301,379). Se ha comprobado en conejos que la membrana amniótica reduce la nebulosidad tras keratectomía fototerapéutica (371,372).
La migración del epitelio corneal y conjuntival sobre la membrana amniótica es fácil (163,301, 188,380,47,101,172,221,238), siendo usada como anteriormente se citó, para inducir la expansión de células limbales estaminales. El amnion también se ha usado como substrato para cultivar y expandir diversos tipos de células, como pneumocitos (199), keratocitos (83) endotelio vascular (192) o células epiteliales de diversos tipos, como dérmicas, traqueales y bucales (60,343,331,244). La unión de estas células epiteliales a la membrana amniótica es firme (316), posiblemente por la similitud composicional en colágena tipo V de la membrana basal de estas células y de la membrana amniótica (222). El epitelio que migra y se extiende sobre la membrana basal amniótica mantiene sus caracteres diferenciales propios (182). La posibilidad de una transdiferenciación epitelial (es decir, la transmutación de las características propias del epitelio transplantado por las de otro epitelio), que se sospechó hace unos años, no ocurre (182,262,55).
Una acción antibacteriana no específica ha sido confirmada (132,370,106,268,277,343,329, 249,153,98,104,167,168,166) así como una cierta acción antiviral (88,89,141,142). La membrana contiene péptidos interferón, con propiedades antiviral, inmunomoduladora y antiproliferativa (88, 89,329,98,167).
CÓMO PREPARAR LA MEMBRANA AMNIÓTICA PARA SU IMPLANTACIÓN
Las técnicas de preparación y conservación de membrana amniótica para su implantación quirúrgica han variado ampliamente (99). La primera preparación de membrana amniótica para uso dermatológico fue hecha en 1913 por Sabella (286), quien separaba el amnion del corion, y mantenía la vitalidad del amnion en solución salina fisiológica durante 72 horas, usándola para tratar quemaduras y heridas cutáneas. La primera preparación para uso oftalmológico la publicó De Rötth en 1940 (68). Este autor tomó las membranas fetales de espesor total (amnion más corion) de mujeres Wassermann negativas que daban a luz por cesárea, y las conservó en en solución Locke templada durante 1 a 15 horas, hasta usarla en pacientes para reconstruir su superficie ocular. Durante la segunda Guerra mundial, Chao (48), aisló membrana amniótica, la sumergió en alcohol al 70%, la secó al calor de una estufa, y finalmente la almacenó en alcohol al 70%, usándola más tarde para cirugía craneal. A esta membrana así preparada la denominó «amnioplastina». Unos años después, el London Hospital preparó «amnioplastina» con un método diferente (185,317-319): la membrana amniótica era separada de la coriónica, lavada al agua corriente y sumergida en una solución saturada de sal común durante 12 horas. Después era lavada en agua destilada durante 10 a 30 minutos, y sumergida en solución de hidróxido potásico al 0,75% durante al menos 30 min hasta que la membrana quedase libre de álcali. Después era sumergida en agua destilada durante 12 horas. Finalmente la membrana era extendida sobre un marco de madera, secada a temperatura doméstica, esterilizada por calor seco a 150ºC durante una hora, y almacenada estéril en una envuelta de celofán, plegada en cuatro capas de 25x25 mm cada una.
La siguiente preparación que se conoce para uso oftalmológico es la de Muldasev en la década de los 1980, quien conservaba la membrana amniótica en una vial con etil-alcohol (297,298,78).
En la década siguiente, desde 1993-5, las primeras preparaciones del equipo de Tseng en Miami (162,163,188) tomaban la placenta y membranas fetales de partos por cesárea de madres que eran seronegativas para sífilis, SIDA, y hepatitis B y C. Inmediatamente, la introducían en una bolsa estéril y la transportaban al laboratorio, donde en condiciones de asepsia, preferentemente en una cámara de corriente lamelar estéril, la limpiaban de coágulos, vernix caseosa, meconio y cualquier otro resto fetal, hasta dejarla macroscópicamente limpia, usando para ello una solución salina conteniendo penicilina (50 µg/ml), estreptomicina (50 µg/ml), neomicina (100 µg/ml), y amfotericina B (2,5 µg/ml) (349), —otros autores usaron simplemente solución salina (343) o BSS con diversos antibióticos (51)—. El amnion es separado del corion por simple tracción manual en direcciones opuestas (fig. 9), lo que resulta fácil debido al espacio virtual que existe entre ambas membranas. El corion se desecha, y el amnion se extiende y aplana sobre una hoja de papel de filtro de nitroceluosa dejando su superficie epitelial hacia arriba y la matriz estromal, pegajosa e irregular, en contacto con el papel. El papel de filtro con el amnion adherido se corta en cuadrados o en discos de aproximadamente 3-4 mm de anchura, y cada fragmento se introduce en un vial conteniendo glicerol al 100% a 4ºC durante 1 semana. Este preservante se cambió poco después por una solución a partes iguales de glicerol y medio de Dulbecco-Eagle, y la temperatura de almacenamiento se cambió a -80ºC.
![]()
Fig. 9. A: Bolsa fetal, formada por la placenta, membranas fetales (amnion y
corion) y cordón umbilical. B: Separación manual del amnion y el corion,
empezando por la zona de ruptura espontánea de la membrana y continuando por la
zona placental.
La crio-conservación a -80ºC tiene la particularidad de que a esta temperatura la actividad mitocondrial es prácticamente nula. Se han usado diversas soluciones conservantes. Shimazaki et al (301) lavaban la membrana fetal completa con solución salina fisiológica complementada con antibióticos, separaban después el amnion, lo cortaban en piezas de 3x3 cm, que finalmente introducían en frasquitos de plástico que contienen dimetil sulfóxido, que después mantienen hasta su uso a –80ºC. Adds (1) introduce las piezas de membrana amniótica en una solución al 50% de glicerol/solución salina balanceada de Hank, que conserva después a -80ºC. Nosotros (234) hemos usado frecuentemente como medio de almacenaje K-Sol, DexSol u Optisol, habitualmente usados para córneas para transplante, y los hemos conservado a –80ºC.
La membrana amniótica humana tras estar un mes a -80ºC mantiene altos niveles de diversos factores de crecimiento (188,301,262,170).
La crio-conservacion a –20ºC es usada por muchos cirujanos porque es la temperatura de los congeladores de los frigoríficos comerciales más accesibles. A esta temperatura las células mantienen su vitalidad menos tiempo que a –80ºC porque la actividad de los enzimas mitocondriales no queda completamente bloqueada, y se desarrolla una progresiva destrucción enzimática de la membrana. Muchos cirujanos sólo utilizan esta membrana durante el primer mes de conservación porque durante él su acción bioquímica y su fuerza tectónica se mantienen casi intactos. Así, Kruse (178) puso membrana amniótica en un medio a partes iguales de glicerol y de Dulbecco-Eagle, y la crio-preservó a –20ºC, o en nitrógeno líquido (cuyas temperaturas suelen ser mucho más bajas, de hasta –195ºC), observando que las células de la membrana se desvitalizaban. La desvitalización a –20ºC, según algunos autores (380,178), hace que cuando la membrana se aplica a la superficie ocular como substrato de expansión para el epitelio limbal, éste se extienda rápidamente sobre la membrana amniótica.
La crio-conservación a +4ºC se utilizó por primera vez, a nuestro saber, por Dino et al (70) en 1966, para conservar membrana en un Banco de Amnion para uso en cirugía general. Estos autores introducían el amnion en solución salina isotónica a la que añadían un 0,25% de hipoclorito sódico y 200.000 unidades de penicilina, y la almacenaban a 4ºC. Este método se extendió bastante, pero no se usó en oftalmología. Se elige la temperatura de 4ºC, porque es a la que el H2O tiene su mínimo volumen (y por consiguiente su máximo peso en relación con un volumen dado. Ésta es la razón de que el hielo flote sobre el agua), y no altera apreciablemente la estructura histológica. Según algunos autores la membrana así conservada puede desencadenar mayor rechazo inmunológico debido a una mayor expresión antiigénica de la matrix.
La crio-conservación a 4ºC mantiene la vitalidad de las células epiteliales durante varios días, con un máximo de un mes (97), dependiendo este tiempo del medio de almacenamiento usado. Hoy día el líquido de conservación más usado es el de Dulbecco-Eagle con glicerol, a partes iguales, pero hay cirujanos que prefieren solución salina isotónica adicinada con polimixina, ampicilina, gentamicina y anfotericina B (343), solución de glicerol (206), o solución CPTES conteniendo 2,5% de condroitín sulfato (1) a 4ºC.
La conservación a temperatura doméstica (²23±7ºC) era la utilizada para la «amnioplastina» de Chao (48), Sorsby (317-319) y Lavery (185) y para el «alotransplante conjuntival» de Muldasev (297,298), y su forma de preparación cambia según los distintos gestores. Rao et al (269) tomaban el amnion de la superficie placentaria a corta distancia de donde emerge el cordón umbilical. Lo limpiaban con solución salina conteniendo algo de hipoclorito cálcico, lo extendían sobre una lámina de plástico y lo secaban al aire ambiente. Después lo introducían en una bolsita de politeno, cuya abertura sellaban a continuación. Las bolsitas eran esterilizadas con luz ultravioleta o con rayos gamma. La liofilización de las membranas (44,323,224) y la esterilización por radiación (269,364,207,224) se usan desde hace bastantes años para cirugías no oftalmológicas, y sólo raramente en oftalmología. Las membranas amnióticas comerciales son algo difíciles de distribuir congeladas, y por ello generalmente se preparan para mantenerse a temperatura ambiental normal, ya inmersas en alcohol etílico, ya deshidratas por liofilización. La experiencia ha mostrado que mantienen una buena capacidad física tectónica y muchas de sus propiedades biológicas.
Otras preparaciones de amnion son los extractos de membrana amniótica y el líquido amniótico. El extracto de membrana amniótica fresca mantiene una actividad enzimática alta. Se ha usado en forma de suspension homogeneizada de membrana amniótica conservada a –80ºC, aplicándola en pacientes con úlceras corneales neurotróficas, úlceras corneales tórpidas de más de 4 meses de duración, quemaduras corneales, queratotransplantes, y síndromes de Sjögren con manifestaciones clínicas graves, usándola a dosis de 2 gotas, sex in die, durante 2-4 semanas. A los 15-20 días de uso, las córneas suelen mejorar y hacerse fluoresceín-negativas (96, 292,237).
El líquido o fluido amniótico se ha usado también en enfermedades de la superficie ocular. Durante el embarazo el líquido de la bolsa de las aguas circula continuamente, con una renovación (turnover time) que al final del embarazo es de 14 1/2 horas (156). Cuando se usa tópicamente en colirio reduce la neovascularización corneal (144), estimula la re-epitelización (145) en ratones, y aumenta la regeneración nerviosa en las keratectomías con láser (187,287). También es bacteriostático (104,370).
Transmisión de enfermedades. Se ha documentado ocasionalmente la transmisión de enfermedades padecidas por la madre donante de la membrana amniótica (310). La serología materna debe analizarse antes del parto, especialmente para las enfermedades maternas transmisibles más frecuentes o peligrosas, como sífilis, SIDA y hepatitis A y B. Además, el parto es aconsejable que sea por cesárea para minimizar la posibilidad de infección de la bolsa de las aguas en un parto transvaginal.
Han sido muchos los transplantes de membrana amniótica de madres seronegativas que se han efectuado inmediatamente tras el parto con membranas no conservadas (26,107,248,212, 213,365). Sin embargo, existe la posibilidad de que alguna de estas madres sea seronegativa en el momento del parto, pero pueda haberse infectado algunas semanas antes y aún no sea analíticamente seropositiva pese a padecer ya una enfermedad transmisible. Por ello, debe conservarse la membrana por cualquiera de los métodos descritos durante 3-6 meses después, preferiblemente 6 (1); después, repetir la serología de la madre, y si sigue siendo negativa, efectuar entonces el transplante de la membrana. Por ello en consentimiento informado de la madre donante debe incluir que, si no cambia de opinión, deberá repetir el análisis de sangre unos meses después (87).
La actividad biológica del epitelio de la membrana preservada depende del método de conservación utilizado. El epitelio amniótico es el principal productor de líquido amniótico (367,135) y de la mayoría de los factores con acción biológica de la membrana, tales como estimuladores neurotróficos (366), mediadores de apoptosis (285), reguladores de prostaglandinas (284,161) factores de crecimiento varios (170,287,366), endotelina-1 y leukotrienos (46,271), enzimas (2,62,227), moléculas de adhesión intercelular (8,208) e inhibidores de las respuestas inmunes innata y adaptativa (194).
El epitelio de la membrana amniótica preservada, ya sea por crio-conservación a 80ºC (188, 178,78,1) ya por otro método, se considera que modifica y pierde las características biológicasdel epitelio normal y se hace no viable. Sin embargo, esta falta de viabilidad del epitelio no es esencial para su efectividad biológica (78) y de acuerdo a algunos autores, cuando la membrana amniótica ha sido denudada de sus células epiteliales, el epitelio corneal del receptor se extiende mejor sobre la membrana transplantada que cuando el epitelio amniótico aún persiste, como ha demostrado Koizumi (172) en el conejo.
Este artículo termina con la figura 10, que muestra el estado del epitelio amniótico, determinado por citología de impresión, después de la conservación a –80ºC. En un trasplante amniótico sobre la superficie ocular, suponemos que se suman tres causas para la pérdida de la capacidad mitótica e inviabilidad del epitelio: 1, una muerte celular apoptótica genéticamente programada hacia la fecha del parto para un epitelio cuyas funciones se terminan en esas fechas; 2, el daño inducido por el método de conservación, y 3, el ambiente agresivo de la cuenca lacrimal, que lo somete a un daño físico y a una película lacrimal impropia para el endotelio amniótico.
Fig. 10. Citología de impresión del epitelio de la
membrana amniótica. Tinción con hematoxilina-eosina. Aumento original x40. A.
Membrana introducida en glicerina y medio de Dulbecco-Eagle al 50/50% y
mantenida congelada a -80ºC (método de Lee-Tseng 188) durante dos años. Tras los
dos años la membrana fue descongelada, y el mismo día hecha la citología de
impresión de esta imagen. B. Después, la membrana volvió a ser introducida en un
nuevo medio de glicerol/Dulbecco-Eagle que se mantuvo a temperatura
habitacional, y que se revocó cada 7 días, durante dos meses. Esta imagen
muestra la citología de impresión a los 7 días de la descongelación. C. 14 días
tras la descongelación. D. 30 días tras la descongelación. E. 45 días tras la
descongelación. F. 60 días tras la descongelación.
Un nuevo uso del cordón umbilical es el de reservorio de células madres del feto para su posible uso en medicina regenerativa. La más reciente información sobre ello puede recogerse en Martínez Urionabarrenetxea K. Ética y bancos de cordón umbilical. JANO, 16-22 junio 2006; 1613: 76-78.
BIBLIOGRAFÍA
Adds PJ, Hunt CJ, Dart JKG. Amniotic membrane grafts, «fresh» or frozen? A clinical and in vitro comparison. Br J Ophthalmol 2001; 85: 905-907.
Adinolfi M, Akle CA, McColl I, et al. Expression of HLA antigens, b2-microglobulin and enzymes by human amniotic epithelial cells. Nature 1982; 295: 325-327.
Ahmed A, Li XF, Dunk C, et al. Colocalisation of vascular endothelial growth factor and its Flt-1 receptor in human placenta. Growth factors 1995; 12: 235-243.
Ainsworth G, Rotchford A, Dua HS, King AJ. A novel use of amniotic membrane in the management of tube exposure following glaucoma tube shunt surgery. Br J Ophthalmol 2006; 90: 417-419.
Akle CA, Adinolfi M, Welsh KI, et al. Immunogenicity of human amniotic epithelial cells after transplantation into volunteers. Lancet 1981; 1003-1005.
Anderson DF, Ellies P, Pires RTF, et al . Amniotic membrane transplantation for partial limbal stem cell deficiency : long term outcomes. Br J Ophthalmol 2001; 85: 567-575.
Anderson DF, Prabhasawat P, Alfonso E, Tseng SC. Amniotic membrane transplantation after the primary surgical management of band keratopathy. Cornea; 2001; 20: 354-361.
Applin JD, Campbell S, Allen TD. The extracellular matrix of human amniotic epithelium: ultrastructure, composition and deposition. J Cell Sci 1985; 79: 119-136.
Arora M, Jaroidi KA, Hamilton CJ, Dayel F. Controlled comparison of interceed and amniotic membrane graft in the prevention of postoperative adhesions in the rabbit uterine horn model. Eur J Obstet Gynecol Reprod Biol 1994; 55: 179-182.
Arruga H. Cirugía Ocular. Barcelona:Salvat 1950. pp 330-4.
Ashworth MF, Morton KE, Dewhurst J, et al. Vaginoplasty using amnion. Obstetr Gynecol 1986; 67: 443-446.
Avila M, Espana M, Moreno C, Peña C. Reconstruction of ocular surface with heterologous limbal epithelium and amniotic membrane in a rabbit model. Cornea 2001; 20: 414-420.
Azuara-Blanco A, Pillai CT, Sarhan A, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction. Invest Ophthalmol Vis Sci 1998; 39: S428.
Azuara-Blanco A, Pillai CT, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction. Br J Ophthalmol 1999; 83: 399-402.
Badawy SZA, Baggish MS, ElBakry MM, Baltoyannis P. Evaluation of tissue healing and adhesion formation after an intraabdominal amniotic membrane graft in the rat. J Reproductive Med 1989; 34: 198-202.
Balbi C, Balbi GC. Riepitelizzazione di ectropion con applicazione di una membrana amniotica a lunga conservazione. Minerva Ginecol 1989; 41: 145-148.
Barabino S, Rolando M, Bentivoglio G, et al. Role of amniotic membrane transplantation for conujunctival reconstruction in ocular-cicatricial pemphigoid. Ophthalmology 2003; 110: 474-480.
Barlas M, Gökçora H, Erekul S, et al. Human amniotic membrane as an intestinal patch for neomucosa growth in the rabbit model. J Pediatr Surg 1992; 27: 597-601.
Barraquer JI. Estado actual de la histioterapia en oftalmología. Comunicación solicitada. XXXI Cong Soc Oftalmol Hisp-Amer. Barcelona. 1951.
Barton K. Budenz D, Khaw, et al. Amniotic membrane transplantation in glaucoma surgery. Invest Ophthalmol Vis Sci 1997; 38: S473.
Barton K. In DuBosar R. Amniotic membrane finding. New use to repair failing blebs. Ocular Surg News 1997 8(12): 17.
Barton K, Budenz DL, Khaw PT, Tseng SC. Glaucoma filtration surgery using amniotic membrane transplantation. Inv Ophthalmol Vis Sci 2001; 42: 1762-1768.
Batlle JF, Perdomo FJ. Membranas placentarias como substitutivo conjuntival. Congr Anual de la Soc Dominc Oftalmol. Santo Domingo 1992. Citado por Dua et al (78) y Murube (236).
Batlle J. Annual Meeting for Resident and Alumni of the Bascom Palmer Eye Institute, 1992. Citado por Lee et al (188) y Prabhasawat et al (261).
Batlle JP, Perdomo FJ. Placental membranes as a conjunctival substitute. Ophthalmology 1993; 100: 107. Abstract 9a
Batmanov IE, Egorova KS, Kolesnikova LN. Use of fresh amnion in the treatment of corneal diseases. Vestn Oftalmol 1990; 106: 17-19.
Baum J. Amniotic membrane transplantation: Why is it effective? Cornea 2002; 21: 339-341.
Beham A, Denk H, Desoye G. The distribution of intermediate filament proteins, actin and desmoplakins in human placental tissue as revealed by polyclonal antibodies. Placenta 1988; 9: 479-482.
Benedetti WI, Sala MA, Alvarez H. Histochemical demonstration of enzymes in the umbilical cord and membranes of human term pregnancy. Eur J Obstetr Gynecol Reprod Biol 1973; 3: 185-189.
Bennet JP, Matthews R, Faulk WP. Treatment of chronic ulceration of the legs with human amnion. Lancet 1980; 1: 1153-1156.
Bissen-Miyajima H. In: Nataloni R. Reconstruction surgery aids severe ocular surface disease. Ocular Surg News 1997; 8(5): 57.
Blaskovics L, Kreiker A. Eingriffe am Auge. Stuttgart_F. Enke, 1938. p. 124.
Bonci P, Bonci P, Lia A.Suspension made with amniotic membrane: Clinical trial. Abstracts of the 8th congress of the International Society of Dacryology and Dry Eye. Madrid. Aprl 2005, p 18, y Eur J Ophthalmol 2005; 15: 441-445.
Bose B. Burn wound dressing with human amniotic membrane. Ann R Coll Surg Eng 1979; 61: 444-447.
Bouchard CS, John T. Amniotic membrane transplantation in the management of severe ocular surface disease: Indications and outcomes. The Ocular Surface 2004; 2: 201-211.
Boudreau N, Sympson CJ, Werb Z, Bissell MJ. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science 1995; 267: 891-893.
Bourne GL. The microscpìc anatomy ob the human amnion and chorion. Am J Obstet Gynecol 1960; 79: 1070-1073.
Brindeau A. Création d’un vagin artificiel a l’aide des membranes ovulaires d’un oeuf a term. Gynécol Obstétr 1934; 29: 385-392.
Brown AL. Lime burns of the eye: Use of rabbit peritoneum to prevent severe delayed effects. Arch Ophthalmol 1941; 26: 754-769.
Budenz DL, Barton K, Tseng SC. Amniotic membrane transplantation for repair of leaking glaucoma filtering blebs. Am J Ophthalmol 2000; 130: 580-588.
Burger K. Artificial vaginal reconstruction with the help of amnios. Zentralblatt für Gynäkol 1937; 2437-2440.
Burger K. Experimental and clinical studies on transplantation of the fetal membranes. Orvosi Hetilap 1938; 82: 800. Citado por de Rötth (68) y Trelford et al (343).
Burgers JK, Nelson RJ, Quinlan DM, Walsh PC. Nerve growth factor, nerve grafts and amniotic membrane grafts restore erectile function in rats. J Urol 1991; 146: 463-468.
Burgos H, Sergeant RJ. Lyophilized human amniotic membranes used in reconstruction of the ear (letter). J R Soc Med 1983; 76: 443.
Campbell S, Allen TD, Moser BB, et al. The translaminal fibrils of the human amnion basement membrane. J Cell Sci 1989; 94: 307-318.
Casey ML, Word RA, MacDonald OC. Endothelin-1 gene expression and regulation of endothelin mRNA and protein biosynthesis in avascular human amnion. Potential source of amniotic fluid endothelin. J Biol Chem 1991; 266: 5762-5768.
Champliaud MF, Lunstrum GP, Rouselle P. Human amnion contains a novel laminin variant, laminin 7, which like laminin 6, covalently associates with laminin 5 to promote stable epithelial-stromal attachment. J Cell Biol 1996; 132: 1189-1198.
Chao YC, Humphreys S, Penfield W. A new method of preventing adhesions. The use of amnioplastin after craniotomy. Br Med J 1940; 5: 517-519.
Chen HJ, Pires RT, Tseng SC. Amniotic membrane transplantation for severe neurotrophic corneal ulcer. Brit J Ophthalmol 2000; 84: 826-833.
ChenZhuo L, Murube J. Stem cells of eye surface and its application (review). Dacriology News 1998: 2: 3-6.
ChenZhuo L. Ocular surface reconstruction. In: Murube J, Rolando M (eds.): Dry eye. A systematic approach to therapy. Switzerland. Novartis-CibaVision. 1999; 161-168.
ChenZhuo L, Redondo C, Lin N, Murube J. Healing process in rabbit corneal perforation repaired with human amniotic membrane. Ophthalmic Research 2000; 32(S2): 75 (1216).
ChenZhuo L, Redondo C, Murube J. Structure remodeling of the penetrating corneal injuries treated by human amniotic membrane transplantation. Abstract of the 8th congress of the International Society of Dacryology and Dry Eye, Madrid April 2005. p 52.
Chiou AG, Florakis GJ, Kazim M. Management of conjunctival cicatrizing diseases and severe ocular surface dysfunction. Surv Ophthalmol 1998; 43: 19-46.
Cho BJ, Djalilian AR, Obritsch WF. Conjunctival epithelial cells cultured on human amniotic membrane fail to transdifferentiate into corneal epithelial type cells. Cornea 1999; 18: 216-224.
Choi YS, Kim JY, Wee WR, Lee JH. Effect of the application of human amniotic membrane on rabbit corneal wound healing after excimer laser photorefractive keratectomy. Cornea 1998; 17: 389-395.
Choi TH. Tseng SC. In vivo and in vitro demonstration of epithelial cell-induced myofibroblast differentiation of keratocytes and an inhibitory effect by amniotic membrane. Cornea 2001; 20: 197-204.
Clay GF, Baird JM. Restoration of the orbit and repair of conjunctival defects with grafts from the prepuce and labia minora. J.A.M.A. 1936; 107: 1122 [citado por De Rötth (68)].
Cleutjens, JP. Havenith MG, Vallinga M. Monoclonal antibodies to native basement membranes reveals heterogeneous immunoreactivity patterns. Histochemistry 1989; 92: 407-412.
Colocho G, Graham WP, Greene AE, et al. Human amniotic membrane as a physiologic wound dressing. Arch Surg 1974; 109: 370-373.
Corominas J, Pascual JA. Diccionario crítico etimológico castellano e hispánico. Madrid: Ed. Gredos. 1984, Vol 1, p 245.
Crescimanno C, Muhlhauser J, Castelluci M. Immunocytochemical patterns of carbonic anhydrase isoenzymes in human placenta, cord and membranes. Placenta 1993; 14: A11.
Dahll K. Amnion graft for treatment of congenital absence of the vagina. Brit J Obstet Gynecol 1984; 91: 279-282.
Danforth DN, Hull RW. The microscopic anatomy of the fetal membranes with particular reference to the detailed structure of the amnion. Am J Obstet Gynecol 1958; 75: 536-550.
Danielsen N, Muller H, Pettmann B, et al. Rat amnion membrane matrix as a substratum for regenerating axons from peripheral and central neurons: effects in a silicon chamber model. Brain Res 1988; 467: 39-50.
Davis JW. Skin transplantation with a review of 550 cases at the Johns Hopkins Hospital. Johns Hopkins Med J. Hosp Rep 1910; 15: 307-396.
Davis GE. Blaker SN, Engvall E, et al. Human amnion serves as a substratum for growing axons in vitro and in vivo. Science 1987; 236: 1106-1109.
de Rötth A. Plastic repair of conjunctival defects with fetal membranes. Arch Ophthalmol 1940; 23: 522-525.
Deodati F. Histiothérapie. In: Sédan et al (eds): Thérapeutique Médicale Oculaire. Paris:Masson. 1957; pp 414-418.
Dino BR, Eufemio GG, De Villa MS. Human amnion: The stablishment of an amnion bank and its practical application in surgery. J Philip Med Assoc 1966; 42: 357-366.
Dollfus MA, Barrois P, Du Plessis de Grénédan. La thérapeuthique tissulaire de Filatov apliquée a la rétinite pigmentaire at à la myopie forte. Ann Ocul 1947; 180: 681-687.
Dos Santos M, Fairbanks D, Pedro EA, et al. Ocular surface reconstruction with amniotic membrane transplantation in chemical burn. In:Sullivan DA et al. Lacrimal gland, tear film and dry eye syndromes 3. New York: Plenum Press 2002; 1259-1262.
Douglas B, Conway H, Stark RB, et al. The fate of homologous and heterologous chorionic transplants as observed by the transparent tissue chamber technique in th mouse. Plast Reconstr Surg 1954; 13: 125-129.
Du Y, Chen J, Funderburgh, et al. Tunctional rconstruction of rabbit corneal epithelium by human limbal cells cultured on amniotic membrane. Mol Vis 2003; 9: 635-643.
Dua HS, Azuara-Blanco A. Amniotic membrane transplantation. Brit J Ophthalmol 1999; 83: 748-752.
Dua HS, Azuara-Blanco A. Limbal stem cells of the corneal epithelium. Surv Ophthalmol 2000; 44: 415-425.
Dua HS, Azuara-Blanco A. Discussion on amniotic membrane transplantation for acute chemical or termal burns. Ophthalmology 2000; 107: 990.
Dua HS, Gomes JAP, King AJ, Maharajan VS. The amniotic membrane in ophthalmology. Surv Ophthalmol 2004; 49: 51-77.
Duchesne B, Tahi H, Galand A. Use of human fibrin glue and amniotic membrane transplant in corneal perforation. Cornea 2001; 20: 230-232.
Durlach J, Durlach V, Bara, M, Guiet-Bara A. A new method of in vitro prescreening evaluation of several Mg salts. Methods Find Exp Clin Pharmacol 1992; 14: 305-310.
Erdener A, Ulman I, Ilhan H, et al. Amniotic membrane wrapping: an alternative method to the splenorraphy in the injured spleen. Eur J Pediatr Surg 1992; 2: 26-28.
Espana EM, Grueterich M, Ti SE, Tseng SC. Phenotypic study of a case receiving a keratolimbal allograft and amniotic membrane for total limbal stem cell deficiency. Ophthalmology 2003; 110: 481-486.
Espana EM, He H, Kawakita T, et al. Human keratocytes cultured on amniotic mermbrane stroma preserve morphology and express keratocan. Invest Ophthalmol Vis Sci 2003; 44: 5136-5141.
Fattibene M, et al. Amniotic membrane diffusion chambers: a new possibility for pancreatic islet transplantation. Life Support Syst 1985; 3(suppl 1): 640-644.
Faulk WP, Temple A. Distribution of beta2-microglobulin and HLA in chorionic villi of human placentae. Nature 1976; 262: 799-802.
Faulk WP, Matthews R, Stevens PJ, et al. Human amnion as an adjunct in wound healing. Lancet 1980; 1: 1156-1158.
Feito Grande L. Problemas éticos de los trasplantes de tejidos fetales. Visión. Lucha contra la ceguera (Madrid) 1998; 14: 27-30.
Ferreira PC, Gonzaga C, Kroon EG, et al. Partial characterization of human amniotic membrana interferon. Braz J Med Biol Res 1991; 24: 21-27.
Ferreira PC, de la Roque L, Rumjanek VM, Golgher RR. Some biological properties of the human amniotic membrane interferon. Mem Inst Oswaldo Cruz 1992; 87: 149-154.
Fidel PL, Romero R, Ramirez M, et al. Interleukin-1 receptor antagonist (IL-1ra) production by human amnion, chorion, and decidua. Am J Reprod Immunol 1994; 32: 1-7.
Filatov VP (Tissue transplantation in intra-ocular diseases). Vestnik oftalmol 1938; 12: 107-59 (en ruso)
Filatov VP. Tissue therapy in ophthalmology. Amer Rev Soviet Med 1944; 2: 53-66.
Filatov VP, Verbitska EA. The implantation of preserved placenta in retinitis pigmentosa. Am Rev Soviet Med 1946; 3: 397-398.
Fishman IJ, Flores FN, Scout FB, et al. Use of fresh placental membrane for bladder reconstruction. J Urol 1987; 138: 1291-1293.
Fontenla JR, Vázquez X, Díaz P, et al. Membrana amniótica. Características, efectos y aplicaciones en oftalmología. JANO 2003; 64: 53-68.
Forgacs J (Effects of placental extracts on epithelization of the rabbit cornea). Ann Ocul (Paris) 1962; 195: 1-12 (en francés).
Franch A, Rama P, Lambiase A, et al. Human amniotic membrane transplantation, IOVS 1998; 39: S90.
Franco GR, de Carvalho AF, Kroon EG. Biological activities of a human amniotic membrane interferon. Placenta 1999; 20: 189-196.
Frank O, Descargues G, Menguy E. Technique of harvesting and preparation of amniotic membrane. J Fr Ophtalmol 2000; 23: 729-734.
Fujishima H, Shimazaki J, Shinozaki N, Tsubota K. Trabeculectomy with the use of amniotic membrane for uncontrollable glaucoma. Ophthalmic Surg Lasers 1998; 29: 428-431.
Fukuda K, Chikama TI, Nakamura M, et al. Differential distribution of subchains of the basement membrane components type IV collagen and laminin among the amniotic membrane, cornea and conjunctiva. Cornea;1999; 18: 73-79.
Furie MB, Cramer EB, Naprstek BL, Silverstein SC. Cultured endothelial cell monolayers that restrict the transendothelial passage of macromolecules and electrical current. J Cell Biol 1984; 98: 1033-1041.
Gabler B, Lohmann CP. Hypopion after repeted transplantation of human amniotic membrane onto the corneal surface. Ophthalmology 2000; 107: 1344-1346.
Gabric N, Maravicic I, Dekaris I. Human amniotic membrane in the reconstruction of the ocular surface. Doc Ophthalmol 1999; 98: 273-83.
Gage FH. Blaker SN, Davis GE.Human amnion membrane matrix as a substrate for axonal regeneration in the central nervous system. Exp Brain Res 1988; 72: 371-380.
Galask R, Snyder IS. Antimicrobial factors in amniotic fluid. Am J Obstetr Gynecol 1970; 106: 59-65.
Ganatra MA, Durrani KM. Method of obtaining and preparation of fresh human amniotic membrane for clinical use. J Pak Med Assoc 1996; 46: 126-128.
Georgiadis NS, Terzidou CD, Epiphora caused by conjunctivochalasis: treatment with transplantation of preserved human amniotic membrane. Cornea 2001; 20: 619-621.
Georgy MS, Aziz NL. Vaginoplasty using amnion graft: new surgical twechnique using the laparoscopic transillimination light. J Obstet Gynecol 1996; 16: 262-264.
Ghanavi S, Ashrafi A, Montzarelghaem A, et al. Islet cell implantation into the pouched amniotic membrane on the side of the portal vein in dogs. Transpl Proc 1995; 27: 26-44.
Gharib M. Repair of prenatally ruptured omphalocele and the paraumbilical abdominal wall defect with the infant’s own fetal membranes. Münch med Wochenschr 1975; 117: 1555.
Gharib M. Ure BM, Klose M. Use of amniotic grafts in the repair of gastroschisis. Pediatr Surg Int 1996; 11: 96-99.
Gibb W, Lavoie JC. Effects of glucocorticoids on prostaglandin formation by human amnion. Canad J Physiol Pharmacol 1990; 69: 671-676.
Gomes JAP, Komagome CM, Santos N. Membrana amniótica nas cirugias reconstrutivas da superficie ocular nas ceratoconjuntivites cicatriciais. Arq Bras Oftalmol 1999; 62: 562-576.
González, C. Allotransplante de conjuntiva. XIV Annual Meeting of the Soc Dominicana Oftalmol, 18-20 Apr 1991. Conference. Program page 3.
Goodfellow PN, Barnstable CJ, Bodmer WF, Snary D, Crumpton MJ. Expression of HLA system antigens in placenta. Transplantation 1976; 2: 595-603.
Gordon DM. The treatment of retinitis pigmentosa with special reference to the Filatov method. Am J Ophthalmol 1947; 30: 565-580.
Gossrau R, Graf R, Ruhnke M, Hanski C. Proteases in the human full-term placenta. Histochemistry 1987; 86: 405-413.
Gräfe MR, Benirschke. Ultrastructural study of the amniotic epithelium in a case of gastroschisis. Pediatr Pathol 1990; 10: 95-101.
Gris O, Güell JL, López-Navidad A,.et al. Application of the amniotic membrane in ocular surface pathology. Ann Transplant 1999; 4: 82-84.
Gris O, del Campo Z, Wolley-Dod C, et al. Amniotic membrane implantation as a therapeutic contact lens for the treatment of epithelial disorders. Cornea 2002; 21: 22-27.
Gris O, Wolley-Dod C, Güell JL, Tresserra F, Lerma E, Corcóstegui B, Adán A. Histologic findings after amniotic membrane graft in the human cornea. Ophthalmology. 2002; 109: 508-512.
Gris O, Del Campo Z, Wolley-Dod C, Güell JL, Velasco F, Adán A. Conjunctival healing after amniotic membrane graft over ischemic sclera. Cornea. 2003; 22: 675-678.
Gris O, Güell JL, Wolley-Dod C. Application of the amniotic membrane in ocular surface pathology. In: Agarwal S, Agarwal A, Apple DJ, Burato L, Alió JL, Pandey SK, Agarwal A. Textbook of Ophthalmology. New Delhi: Jaypee Brothers Medical Publishers, 2002. Vol 2.
Gris O, López-Navidad A, Caballero F, del Campo Z, Adán A. Amniotic membrane transplantation for ocular surface pathology: long-term results. Transplant Proc. 2003; 35: 2031-2035.
Gris O, Güell JL. Amniotic membrane transplantation. In: Agarwal A. Dry Eye. A practical guide to ocular surface disorders and stem cell surgery. New Jersey: SLACK Inc., 2006. Cap. 16.
Grueterich M, Tseng SC. Human limbal progenitor cells expanded on intact amniotic membrane ex vivo. Arch Ophthalmol 2002; 120: 783-790.
Grueterich M, Espana E, Tseng SC. Connexin 43 expression and proliferation of human limbal epithelium on intact and denuded amniotic membrane. Inv Ophthalmol Vis Sci 2002; 43: 63-71.
Grueterich M, Espana EM, Tseng CG. Ex vivo expansion of limbal epithelial stem cells: Amniotic membrane serving as a stem cell niche. Surv Ophthalmol 2003; 48: 631-646.
Grueterich M, Espana ERM, Tseng SC. Modulation of keratin and connexion expression in limbal epithelium expanded on denuded amniotic membrane with and without a aT3 fibroblast feeder layer. Inv Ophthalmol Vis Sci 2003; 44: 4230-4236.
Gruss JS, Jirsch DW.Human amniotic membrane: a versatile wound dressing. Canad Med Assoc J 1978; 118: 1237-1246.
Gudson J. A bactericidin for Bacillus subtilis in pregnancy. J Immunol 1962; 88: 494-499.
Guler R, Ercan MT, Ulutuncel N, et al. Measurement of blood flow by the 133Xe clearance technique to grafts of amnion used in vestibuloplasty. Br J Oral Maxillofac Surg 1997; 35: 280-283.
Haberal M, Oner Z, Bayraktar U, Bilgin N. The use of silver nitrate-incorporated amniotic membrane as a temporary dressing. Burns 1987; 13: 159-163.
Hammer A, Hutter H, Blaschitz A, et . Amnion epithelial cells, in contrast to trophoblast cells, express all classical HLA class I molecules together with HLA-G. Am J Reprod Immunol 1997; 37: 161-171.
Hanada K, Shimazaki J, shimmura S, Tsubota K. Multilayered amniotic membrane transplantation for severe ulceration of the cornea and sclera. Am J Ophthalmol 2001; 131: 324-331.
Hao Y, Ma DH, Hwang DG. Identification of antiangiogenic and anti-inflammatory proteins in human amniotic membrane. Cornea 2000; 19; 348-352.
He YG, Alizadeh H, Kinoshita K, McCulley JP. Experimental transplantation of cultured human limbal and amniotic epithelial cells on the corneal surface. Cornea 1999; 18: 570-579.
He H, Cho HT, Li W, et al. Signaling transduction pathways required for ex vivo expansion of human limbal explants on intact amniotic membrane. Invest Ophthalmol Vis Sci 2006; 47: 151-157.
Heiligenhaus A, Bauer D, Meller D, et al. Improvement of HSV-1 necrotizing keratitis with amniotic membrane transplantation. Invest Ophthalmol Vis Sci 2001; 42: 1969-1974.
Heiligenhaus A, Bauer D, Wasmuth S, Steuhl KP. Amniotic membrane transplantation improves herpetic keratitis by local and not by systemic effects Ophthalmologe 2003; 100: 209-215.
Heiligenhaus A, Li HF, Yang Y, et al. Transplantation of amniotic membrane in murine herpes stromal keratitis modulates matrix metalloproteinases in the cornera. Invest Ophthalmol Vis Sci 2005; 46: 4079-4085.
Hernández CM. Tratamiento de las úlceras vasculares con membranes amniocoriales. Angiologia 1993; 45: 112-116.
Herretes SP, Duh E, Sikder S, et al. Topical human amniotic fluid vs. potent antiangiogenesis protein in the inhibition of induced corneal neovascularization. Abstract program Am Acad Ophthalmol Annual Meeting. 2005. page 196.
Herretes SP, Suwanapichon O, Reyes JMG, et al. Use of topical human amniotic fuid in the treatment of acute alcali burns of the eye. Abstract program Am Acad Ophthalmol Annual Meeting. 2005. p 192.
Hincapié J, Bianciotto C, Méndez MC, et al. Amiotic membrane for ocular surface reconstruction after surgical escision of conjunctival tumors. Abstracs of the 8th Congres of the International Society of Dacryology and Dry Eye. Madrid. April 2005. p 24.
Hofmann GE, Abramowicz JS. Epidermal growth factor (EGF) concentrations in amniotic fluid and maternal urine during pregnancy. Acta Obstet Gynecol Scand 1990; 69: 217-221.
Holland EJ, Djalilian AR, Schwartz GS, Management of aniridic keratopathy with keratolimbal allograft: a limbal stem cell transplantation technique. Ophthalmology 2003; 110: 125-130.
Honovar SG, Bansal AK, Sangwan VS, Rao GN. Amniotic membrane transplantation for ocular surface reconstruction in Stevens-Johnson syndrome. Ophthalmology 2000; 107: 975-979.
Houlihan JM, Biro PA, Harper HM, et al. The human amnion is a site of MHL class Ib expression: evidence for the expression of HLA-E and HLA-G. J Immunol 1995; 154: 5665-5674.
Hsi BL, Yeh CJ, Faulk WP. Human amniochorion: tissuespecific markers, transferring receptors and histocompastibility antigens. Placenta 1982; 3: 1-12.
Hsi BL, Fredj-Reygrobellet D, Yeh CJ. Monoclonal antibodies to human amnion recognize different components of the rabbit eye. Invest Ophthalmol 1986; 27: 620-622.
Hsu CD, Meaddough E, Lu LC. Immunohistochemical localization of inducible nitric oxide synthase on human fetal amnion in intra-amniotic infection. Am J Obstet Gynecol 1998; 179: 1271-1274.
Ishihara O, Saitoh M, Kinoshita K. Friegen II improves the reliability of measurement of interleukin-1 related substances in amniotic fluid. Acta Obstet Gynecol Scand 1999; 78: 321-325.
Iumasheva AA, Belous VI, Lishchenko BM. (Scleroplasty results in progressive myopathy with the use of allogeneic amnion). Oftalmol Zh 1989; 6: 352-354 (en ruso).
Jeffcoate TNA, Scott JS. Polyhydramnios and oligohydramnios. Canad Med Assoc J. 1959; 80: 77-86.
John T, Foulks GN, John ME, et al. Amniotic membrane in the surgical management of acute toxic epidermal necrolysis. Ophthalmology 2002; 109: 351-360.
Jones SA, Challis JR. Local stimulation of prostaglandin production by corticotrophin-releasing hormone in human fetal membranes and placenta. Biochem Biophys Res Commun 1989; 159: 192-199.
Joseph A, Dua HS, King AJ. Failure of amniotic membrane transplantation in treatment of acute chemical burns. Brit J Ophthalmol 2001; 85: 1065-1069.
Kar D, Mehta H, Natarajan S. Amniotic membrane in ocular surface disorders. In: Garg A, et al (eds). Clinical diagnosis and management of dry eye and ocular surface disorders (Xero-dacryology). New-Delhi:Jaypee Bros. Med Publ. 2006. Chapt 27, pp 444-453.
Keelan JA, Sato TA, Hansen WR. Interleukin-4 differentially regulates prostaglandin production in amniotic-derived WISH cells stimulated with pro-inflammatory cytokines and epidermal growth factor. Prostaglandins Leukot Essent Fatty Acids 1999; 60: 255-262.
Kim J, Tseng SC. Transplantation of preserved human amniotic membrane for surface reconstruction in severely damaged rabbit corneas. Cornea 1995; 14: 473-484.
Kim JC, Tseng SC. The effects on inhibition of corneal neovascularization after human amniotic membrane transplantation in severely damaged rabbit corneas. Korean J Ophthalmol 1995; 9: 32-46.
Kim JS, Park SW, Kim SI, et al. Temporary amniotic membrane graft promotes healing and inhibits protease activity in corneal wound induced by alkali burn in rabbits. IOVS 1998; 39(4), S90.
Kim JS, Kim JC, Na BK, et al. Amniotic membrane patching promotes healing and inhibits proteinase activity on wound healing following acute corneal alkali burn. Exp Eye Res 2000; 70: 329-337.
Kim JS, Kim JC, Hahn TW, Park WC. Amniotic membrane transplantation in infectious corneal ulcer. Cornea 2001; 20: 720-726.
Kjaergaard N, Helmig RB, Schonheyder HC. Chorioamniotic membranes constitute a competent barrier to group B streptococcus in vitro. Eur J Obstet Gynecol Reprod Biol 1999; 83: 165-169.
Kjaergaard N, Hein N, Hyttel L. Antibacterial properties of human amnion and chorion in vitro. Eur J Obstet Gynecol Reprod Biol 2001; 94: 224-229.
Kobayashi N, Kabuyama Y. Sasaki S, et al. Supresion of corneal neovascularization by culture supernatant of human amniotic cells. Cornea 2002; 21: 62-67.
Koizumi NJ, Inatomi TJ, Sotozono C, et al. Growth factor mRNA and protein in preserved human amniotic membrane. Curr Eye Res 2000; 20: 173-177.
Koizumi N, Inatomi T, Quantock, et al. Amniotic membrane as a substrate for cultivating limbal corneal epithelial cells for autologous transplantation in rabbits. Cornea 2000; 19; 65-71.
Koizumi N, N, Fullwood NJ, Bairaktaris G. Cultivation of corneal epithelial cells on intact and denuded human amniotic membrane. Invest Ophthalmol Vis Sci 2000; 41: 2506-2513.
Koizumi N, Inatomi T, Suzuki T, et al. Cultivated corneal epithelial transplantation for ocular surface reconstruction in acute phase of Stevens Johnson syndrome. Arch Ophthalmol 2001; 119: 298-300.
Koizumi N, Inatomi T, Suzuki T, et al. Cultivated corneal epithelial stem cell transplantation in ocular surface disordders. Ophthalmology 2001; 108: 1569-1574.
Kothari P.Total glossectomy and repait with amniotic membrane (preliminary observations). Indian Med Assoc 1974; 62: 87-88.
Kruse FE, Rohrschneider K, Volcker HE. Transplantation of amniotic membrane for reconstruction of the eye surface. Ophthalmologe 1998; 95: 114-119.
Kruse FE, Rohrschneider K, Völcker HE.(Multilayer amniotic membrane transplantation for reconstruction of deep corneal ulcers). Ophthalmologe 1999; 106: 1504-1511 (en alemán).
Kruse FE, Joussen AM, Rohrschneider K, et al. Cryopreserved human amniotic membrane for ocular surface reconstruction. Graefes Arch Clin Exp Ophthalmol 2000; 238: 68-75.
Kubanyi A. Trapianto d’amnion sterile ottenuto dal teglio cesareo. Ann Ital Chir 1948; 25: 10.
Kubo M, Sonada Y, Muramatsu R, Usui M. Immunogenicity of human amniotic membrane for reconstruction of the eye surface. Ophthalmologe 1998; 95: 114-119.
Kubo M, Sonada Y, Muramatsu R, Usui M. Immunogenicity of human amniotic membrane in experimental xenotransplantation. Invest Ophthalmol Vis Sci 2001; 42: 1539-1546.
Kurpakus MA, Stock EL, Jones JCR. The role of the basement membrane in differential expression of keratin proteins in epithelial cells. Devel Biol 1992; 150: 243-255.
Laguna A (1494-1560). Citado por Corominas J, Pascual JA. Diccionario crítico etimológico castellano e hispánico. Madrid: Ed. Gredos. 1984, Vol 1, p 245.
Laurian N. Kalmanovitch M, Shimberg R. Amniotic graft in the management of severe epistaxis due to hereditary haemorrhagic telangiectasia. J Laryngol Otol 1979; 93: 589-595.
Lavery FS. Lime burn of conjunctiva and cornea treated with amnioplastin graft. Trans Ophthalmol Soc UK 1946; 66: 668.
Lawson VG. Oral cavity reconstruction using pectoralis major muscle and amnion. Arch Otolaryngol 1985; 111: 230-233.
Lee HS, Kim JC. Effect of amniotic fluid in corneal sensitivity and nerve regeneration after excimer laser ablation. Cornea 1996; 15: 517-524.
Lee SH, Tseng SCG. Amniotic membrane transplantation for persistent epithelial defects with ulceration. Am J Ophthalmol 1997; 123: 303-312.
Lee SB. Li DQ, Ma X. Suppression of transforming growth factor-beta isoforms, TGF-beta receptor type II, and myofibroblast differentiation in cultured human corneal and limbal fibroblasts by amniotic membrane matrix. J Cell Physiol 1999; 179: 325-335.
Lee SB, Li DQ, Tan DT. Suppression of TGF-beta signaling in both normal fibroblasts and pterygial body fibroblasts by amniotic membrane. Curr Eye Res 2000; 20: 325-334.
Lee JH, Ryu IH, Kim EK, et al. Induced expression of insulin-like growth factor-1 by amniotic membrane-conditioned medium in cultured human corneal epithelial cells. Invest ophthalmol Vis Sci 2006; 47: 864-872.
Lefebvre L, Viville S, Barton SC et al. Abnormal maternal behaviour and growth retardation associated with loss of the imprinted gene Mest. Nat Genet 1998; 20: 163-169.
Letko E, Stechschulte SU, Kenyon KR, et al. Amnion membrane inlay and overlay grafting for corneal epithelial defects and stromal ulcers. Arch Ophthalmol 2001; 119: 659-663.
Li H, Niederkorn JY, Neelam S, et al. Immunosuppressive factors secreted by human amniotic epithelial cells. Invest Ophthalmol Vis Sci 2006; 2005; 46: 900-907.
Linnala A, Balza E, Zardi L, Virtanen I. Human amnion epithelial cells assemble tenascins and three fibronectin isoforms in the extracellular matrix. FEBS lett 1993; 317: 74-78.
López García JS, Rivas L, García Lozano I. Tratamiento de la insuficiencia limbal grave mediante cirugía combinada de trasplante de limbo y trasplante de membrana amniótica. Arch Soc Españ Oftalmol 2005; 80: 405-412.
López García JS, Rivas L, García Lozano I. Trasplante de membrana amniótica en el tratamiento de la insuficiencia limbal moderada de pacientes com aniridia congénita. Arch Soc Españ Oftalmol 2005; 80: 517-524.
López-García JS, Rivas L, García-Lozano L, Murube J. Evolution of corneal surface after moderate alkaline burns using impression cytology. Cornea 2006 (en prensa).
Lwebuga-Mukasa JS, Thulin G, Madri JA, et al. An acellular human amniotic membrane model for in vitro culture of type pneumocytes. J Cell Physiol 1984; 121: 215-225.
Ma DHK, See LC, Liau SB, et al. Amniotic membrane graft for primary pterygium: comparison with conjunctival autograft and topical mitomycin C treatment. Brit J Ophthalmol 2000; 84: 973-978.
Ma DHK, Yao JY, Yeh LK, et al. In vitro antiangiogenic activity in ex vivo expanded human limbocorneal epithelial cells cultivated on human amniotic membrane. Inv Ophthalmol Vis Sci 2004; 45: 2586-2595.
MacLachlan TB. A method for the investigation of the strength of the fetal membranes. Am J Obstet Gynecol 1965; 91: 309.
Malak TM, Bell SC. Differential expression of the integrin subunits in human fetal membranes. J Reprod Fertil 1994; 102: 269-276.
Maldonato A, Lucisano A, Maniccia E, et al. Amniotic membrane diffusión chambers: a new possibility for pancreatic islet transplantation. Life Support System 1985;3 (suppl 1): 640-644.
Manabe Y, Himeno N, Fukumoto M. Tensile strength and collagen content of amniotic membrane do not change after the second trimester or during delivery. Obstet Gynecol 1991; 78: 24-27.
Maral T, Borman H, Arslan H. Effectiveness of human amnion preserved long-term in glycerol as a temporary biological dressing. Burns 1999; 25: 625-635.
Martínez Pardo ME, Reyes Frías ML, Ramos Duran LE. Clinical application of amniotic membranes on a patient with epidermolysis bullosa. Ann Transplant 1999; 4: 68-73.
Marvin KW, Hansen WR, Miller HC. Amnion-derived cells express intercellular adhesion molecule-1: regulation by cytokines. J Mol Endocrinol 1999; 22: 193-205.
Matthews RN, Faulk WP, Bennett JP. A review of the role of amniotic membranes in surgical practice. Obstet Gynecol Ann 1982; 11: 31-58.
McIndoe AH, Bright Banister, J. An operation for the cure of congenital absence of the vagina. J Obstet Gynaecol Br Emp1 1938; 45: 490-494.
Meallet MA, Espana EM, Grueterich M, et al: Amniotic membrane transplantation with conjunctival limbal autograft for total limbal stem cell deficiency. Ophthalmology 2003; 110: 1585-1592.
Mejía LF, Acosta C, Santamaría JP. Use of nonpreserved human amniotic membrana for the reconstruction of the ocular surface. Cornea 2000; 19: 288-291.
Mejia LF, Santamaría JP, Acosta C. Symptomatic management of postoperative bullous keratopathy with nonpreserved human amniotic membrana. Cornea 2002; 21: 342-345.
Meller D, Tseng SC. In vivo conjunctival epithelial differentiation on preserved human amniotic membrane. Invest Ophthalmol Vis Sci 1998; 39: S428.
Meller D, Tseng SC. Reconstruction of the conjunctival and corneal surface. Transplantation of amniotic membrane. Ophthalmologe 1998; 95: 805-813.
Meller D, Pires RTF, Tseng SCG. Ex vivo preservation and expansion of human limbal epithelial cells by amniotic membrane. Invest ophthalmol Vis Sci 1999; 40: 329.
1999-B Meller D, Tseng SC. Conjunctival epithelial cell differentiation on amniotic membrane. Invest Ophthalmol Vis Sci 1999; 40: 878-886.
Meller D, Tseng SC. Amniotic membrane transplantation with or without limbal allografts in corneal surface reconstruction in limbal deficiency. Ophthalmologe 2000; 97: 100-107.
Meller D, Maskin SL, Pires RT, Tseng SC.Amniotic membrane transplantation for symptomatic conjunctivochalasis refractory to medical treatments. Cornea 2000; 19: 796-803.
Meller D, Pires RT, John T, et al. Amniotic membrane transplantation for acute chemical or thermal burns. Ophthalmology 2000; 107: 980-989.
Meller D, Pires RTF, Tseng SCG. Ex vivo preservation and expansion of human limbal epithelial stem cells on amniotic membrane cultures. Brit J Ophthalmol 2002; 86: 463-471.
Modesti A, Kalebic T, Scarpa S, et al. Type V collagen in human amnion is a 12 nm fibrillar component of the pericellular interstitium. Eur J Cell Biology 1984; 35: 246-255.
Modesti A, Scarpa S, D’Orazi G, et al. Localization of types IV and V collagens in the stroma of human amnion. Progr Clin Biol Res 1989; 296: 459-463.
Momose A. Lyophilized human amniotic membrane «patching» for ocular surface disorders. Ocular Surg News 2000; October: 144-146.
Moore JE, Dua HS, Page AB, et al. Ocular surface reconstruction in LOGIC syndrome by amniotic membrane transplantation. Cornea 2001; 20: 753-756.
Morton KE, Dewhurst CJ. Human amnion in the treatment of vaginal malformations. Brit J Obstet Gynecol 1986; 93: 50-54.
Muhlhauser J, Crescimanno C, Rajaniemi H. Immunohistochemistry of carbonic anhydrase in human placenta and fetal membranes. Histochemistry 1994; 101: 91-98.
Muldasev. Citado por Serrano (297,298), Dua et al (7) y Murube (236).
Muralidharan S, Gu J, Laub GW. A new biological membrane for pericardial closure. J Biomed Mater Res 1991; 25: 1201-1209.
Murube J, Olivares C, Murube E. Treatment of dry eye by punctum patch. Orbit 1995; 14: 1-7.
Murube J. Ojo seco-dry eye. Mesa Redonda del 73 congr de la Soc Españ Oftalmol, Granada 1977. Publicado por la S.E.O., Madrid 1997.
Murube J. The contribution of amniotic membrane in ocular surgery. Highlights of Ophthalmology (International English Edition) 1998; 26(6): 62-63.
Murube del Castillo J. Can surgery assist in the treatment of mucus deficient KCS?. Dacryology News (Milan). 1998; 1: 3-4.
Murube J. In Boyd B (ed). Amniotic membrane transplantation: A major contribution to ocular surface disease. Highlights of Ophthalmology 2000; 28 (2): 3-10.
Murube J, Morum M, Murube E, Arnalich F. Conjunctival Z-plasty. New method for correcting conjunctivochalasis. Arch Soc Canar Oftalmol 2004; 15: 61-66.
Murube J. Early clinical use of amniotic membrane in medicine and ophthalmology. The Ocular Surface 2006; 4(3): 7-12.
Na BK, Hwang JH, Shin, et al. Analysis of human amniotic membrane components as proteinase inhibitors for development of therapeutic agent of recalcitrant keratitis. Invest Ophthalmol Vis Sci 1998; 39: S90.
Nakamura T, Endo KI, Cooper LJ, et al. The successful culture and autologous transplantation of rabbit oral mucosa epithelial cells on amniotic membrane. Invest Ophthalmol Vis Sci 2003; 44: 106-116.
Nakamura T, Kinoshita S. Ocular surface reconstruction using cultivated mucosal epithelial stem cells. Cornea 2003; 22(suppl 1): S75-S80.
Nakamura T, Koizumi N, Tsuzuki M, et al. Successful regrafting of cultivated corneal epithelium using amniotic membrane as a carrier in severe ocular surface disease. Cornea 2003; 22: 70-71.
Neuenschwander M. Placentatherapie der Retinitis pigmentosa. Ophthalmologica 1948; 116: 262-272.
Nguyen-Dinh-Mac. A technic of vaginoplasty by inferior approach in the treatment of Rokitansky-Kuster-Hauser syndrome. Mac’s method. Rev Fr Gynecol Obstet 1988; 83: 91-96.
Nisolle M, Donnez J. Vaginoplasty using amniotic membranes in cases of vaginal agenesis or after vaginectomy. J Gynecol Surg 1992; 8: 25-30.
Noguchi Y, Uchida Y, Endo T, et al. The induction of cell differentiation and polarity of tracheal epithelium cultured on the amniotic membrane. Biochem biophys res Commun 1995; 210: 302-309.
Norris MA, Cohen MS, Warren MM, et al. Bladder reconstruction in rabbits with glutaraldehyde-stabilized amniotic membrane. Urology 1982; 19: 631-635.
Nozaki M, Kawahara J, Muramatsu R, Usui M. Quantitative determination of vitamin A levels in frozen preserved human amniotic membrane. Nippon Ganka Gakkai Zasshi 2005; 109: 727-735.
Ocklesford CD, Malak T, Hubbard A. Human amniochorion cytoskeletons at term. Placenta 1993; 14: A56.
Panda A. Amniotic membrane transplantation in ophthalmology (fresh vs preserved tissue). Brit J Ophthalmol 1999; 83: 1410-1411.
Paradowska E, Blach-Olszewska Z, Gejdel E. Constitutive and induced cytokine production by human placenta and amniotic membrane at term. Placenta 1997; 18: 441-446.
Paridaens D, Beekhuis H, van den Bosch W. Amniotic membrane transplantation in the management of conjunctival malignant melanoma and primary acquired melanosis with atypia. Brit J Ophthalmol 2001; 85: 658-661.
Park WC, Tseng SC. Modulation of acute inflammation and keratocyte death by suturing, blood, and amniotic membrana in PRK. Invest Ophthalmol Vis Sci 2000; 41: 2906-2914.
Pérez Márquez M. Serrano H, Parthe G, Pineda K. Estudio experimental del uso de pleura parietal humana en quemaduras corneales por alcali en conejos. Rev Oftalmol Venezol. 2003; 59: 48-55.
Peris Martínez C. Transplante de membrana amniótica en la reconstrucción de la superficie ocular. Thesis doctoralis. Universidad de Valencia. Schola medicinae. Dirs.: Profs. Menezo y Díaz Llopis. 2003
Pery J, Tsur H, Horowitz A, et al. Enzymatic chemical modification of human amniotic membrane and skin as a means for the preparation of biological dressing. N Burns Incl Therm Inj 1982; 8: 207-209.
Pigeon J. Treatment of second-degree burns with amniotic membranes. Canad Med Assoc J 1960: 83: 844-845.
Pikin KI. (Therapy of fresh wounds by transplantation of chemically treated tissues). Sov Med 1942; 6(9):15 (Russian).
Pires RTF, Tseng SCG, Prabhasawat P, et al. Amniotic membrane transplantation for symptomatic bullous keratopathy. Arch Ophthalmol 1999; 117: 1291-1297.
Pires RTF, Chokshi A, Tseng SCG. Amniotic membrane transplantation or conjunctival limbal autograft for stem cell deficiency induced by 5-fluorouracil in glaucoma surgeries. Cornea 2000; 19: 284-287.
Polishuk WZ, Kohane S, Hadar A. Fetal weight and membrane tensile strength. Am J Obstet Gynecol 1964; 88: 247.
Pollard SM, Aye NN, Symonds EM. Scanning electron microscope appearances of normal human amnion and umbilical cord a term. Brit J Obstet Gynecol 1976; 83: 470-477.
Prabhasawat P, Barton K, Burkett G, Tseng SCG. Comparison of conjunctival autografts, amniotic membrane grafts, and primary closure for pterygium excision. Ophthalmology 1997; 104: 974-985.
Prabhasawat P, Tseng SCG. Impression cytology study of epithelial phenotype of ocular surface reconstructed by preserved human amniotic membrane. Arch Ophthalmol 1997; 115: 1360-1367.
Prabhasawat P, Barton K, Burkett G, Tseng SC. Comparison of conjunctival autografts, amniotic membrane grafts and primary closure of pterygium excision. Ophthalmology 1997; 104: 974-985.
Prabhasawat P, Tseng SCG. Estudio de citología de impresión del fenotipo epitelial de la superficie ocular reconstruida mediante membrana amniótica conservada. Arch Ophthalmol (Sp. ed.) 1998; 9: 68-76.
Prasad JK, Feller I, Thomson PD. Use of amnion for the treatment of Stevens-Johnson syndrome. J Trauma 1986; 26: 945-946.
Quinby WC, Hoover HC, Schefian M. Clinical trials of amniotic membranes in burn wound care. Plast Reconstr Surg 1982; 70: 711-716.
Rakowska E, Zagorski Z, Kardaszewska A, Durakiewicz. Application of amniotic membrane transplantation in severe corneal diseases. Klin Oczna 1999; 101: 417-421.
Rao TV, Chandrasekharam V. Use of dry human and bovine amnion as a biological dressing. Surg Gynecol Obstet 1973; 136: 904-906.
Rao TV, Chandrasekharam V. Use of dry human and bovine amnion as a biological dressing. Arch Surg 1981; 116: 891-896.
Rao CV, Carman FR, Chegini N, Schultz GS. Binding sites for epidermal growth factor in human fetal membranes. J Clin Endocrinol Metab 1984; 58: 1034-1042.
Rees MC Di Marzo,V, López Bernal A, et al. Leukotriene release by human fetal membranes, placenta and decidua in relation to parturition. J Endocrinol 1988; 118: 497-500.
Rennekampff HO, Dohrmann P, Fory R, Fandrich F. Evaluation of amniotic membrane as adhesion prophylaxis in a novel surgical gastroschisis model. J Invest Surg 1994; 7: 187-193.
Rigal-Sastourne JC, Legeais JM, Texier JM, et al. In vitro rabbit and human corneal epithelium growth on amniotic membrane. Ophthalmic Research 2000; 32: 75(1217).
Riley SC, Leask R, Denison FC, et al. Secretion of tissue inhibitors of matrix metalloproteinase by human fetal membrane, decidua, and placenta at parturition. J Endocrinol 1999; 162: 351-359.
Riley SC, Leask R, Balfour C, et al. Production of inhibin forms by the fetal membranes, deciduas, placenta and fetus at parturition. Hum Reprod 2000; 15: 578-583.
Rivas L, López-García S, Corredera E. Transplantation of amniotic membrana combined with limbal allograft in patients with aniridia. Abstracts of the 8th Congress of the Int’l Soc Dakryol & Dry Eye. Madrid 2005. p 35-6.
Robson MC, Krizek TJ. The effect of human amniotic membranes on the bacterial population of infected rat burns. Ann Surg 1973; 177: 144-149.
Rodríguez-Ares MT, Touriño R, Capeans C, Sánchez Salorio M. Scleral perforation with preserved scleral and amniotic membrane in Marfan’s syndrome. Ophhalmic Surg Lasers 1999; 30: 485-487.
Rodríguez-Ares MT. Membrana amniótica en enfermedades de la superficie ocular. Arch Soc Esp Oftalmol 2002; 77: 471-472.
Rodríguez Martín J, de Bonis E, Rodríguez Santana A, Gonzalez de la Rosa MA. Amniotic membrane transplantation in ocular surface pathology. Arch Soc Canar Oftalmol 2001; 12: 101-107.
Rolando M, Barabino S, Bentivoglio G, Mingari C, Calabria G. Treatment of ocular surface inflammation in keratoconjunctivitis sicca by means of a silicon-hydrogel bandage contact lens dressed with amniotic membrane. The Ocular Surface 2005; 3 (suppl): S107.
Romero R, Gomez R, Galasso M, et al. The natural interleukin-1 receptor antagonist in the fetal, maternal, and amniotic fluid compartments: the effect of gestational age, fetal gender, and intrauterine infection. Am J Obstet Gynecol 1994; 171: 912-921.
Roper-Hall MJ. Thermal and chemical burns. Trans Ophthalmol Soc UK 1965; 85: 631-653.
Rote NS, Menon R, Swan KF, Lynden TW. Expression of IL-1 and IL-6 protein and mRNA in amniochorionic membranes. Placenta 1993; 14: A63.
Runic R, Lockwood CJ, LaChapelle L. Apoptosis and Fas expression in human fetal membranes. J Clin Endocrinol Metab 1998; 83: 660-666.
Sabella N. Use of the fetal membranes in skin grafting. Medical Records NY 1913; 83: 478-480.
Sakuragawa N, Elwan MA, Uchida S. Non-neuronal neurotransmitters and neurotrophic factors in amniotic epithelial cells: expression and function in humans and monkey. Jap J Pharmacol 2001; 85: 20-23.
Sánchez-Salorio M. Sobre el redescubrimiento de la placenta humana como agente terapéutico ocular. Studium Ophthalmologicum 1999; 18: 95-98.
Sanz AI, Rivas L, Murube J. Nuevas técnicas de transplante para restaurar la superficie corneal: importancia de las células stem. Studium Ophthalmologicum 1998; 17: 181-187.
Sato H, Shimazaki J, Shinozaki N. Role of growth factors for ocular surface reconstruction after amniotic membrane transplantation. Invest Ophthalmol Vis Sci 1998; 39: S428.
Sawhney CP. Amniotic membrane as a biological dressing in the management of burns. Burns 1989; 15: 339-342.
Scaggiante B, Pineschi A, Sustersich M, et al. Successful therapy of Nieman-Pick disease by implantation of human amniotic membrane. Tranplantation 1987; 44: 59-61.
Schein OD. The use of processed pericardial tissue in anterior ocular segment reconstruction. Am J Ophthalmol 1998; 125: 549-552.
Schofield OM, McDonald JN, Fredj-Reygrobeller D. Common antigen expression between human periderm and other tissues identified by GB1-monoclonal antibody. Arch Dermatol Res 1990; 282: 143-148.
Schwab IR, Reyes M, Isseroff RR. Successful transplantation of bioengineered tissue replacements in patients with ocular surface disease. Cornea 2000; 19: 421-426.
Schwam BL. Human amniotic membrane transplantation for the treatment of ocular surface disease. Northern Florida Medical J 2002.
Serrano H. Uso clínico quirúrgico con tejido amniótico en pacientes con pterigiones, y en simblefaron y traumas. Conf Annual Congr Soc Dominic Oftalmol. 1990.
Serrano H. Injerto de conjuntiva en cirugía plástica ocular. XXIV Annual Meeting of the Soc Dominc Oftalmol. 18-20 Apr 1991. Conference. Program page 4.
Sharma SC, Bagree MM, Bhat AL, et al. Amniotic membrane is an effective burn dressing material. Jap J Surg 1985; 15: 140-143.
Shields CL, Shields JA, Armstrong T. Management of conjunctiva and corneal melanoma with surgical excision, amniotic membrane allograft, and topical chemotherapy. Am J Ophthalmol 2001; 132: 576-578.
Shimazaki J, Yang HY, Tsubota K. Amniotic membrane transplantation for ocular surface reconstruction in patients with chemical and thermal burns. Ophthalmology 1997; 104: 2068-2076.
Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon. Br J Ophthalmol 1998; 82: 235-240.
Shimazaki J, Alba M, Goto E, et al. Transplantation of human limbal epithelium cultivated on amniotic membrane for the treatment of severe ocular surface disorders. Ophthalmology 2002; 109: 1285-1290.
Shimazaki J. Kosaka K, Shimmura S, Tsubota K. Amniotic membrane transplantation with conjunctival autograft for recurrent pterygium. Ophthalmology 2003; 110: 119-124.
Shimmura S, Shimazaki J, Onashi Y, Tsubota K. Antiinflammatory effects of amniotic membrane transplantation in ocular surface disorders. Cornea 2001; 408-413.
Shinozaki N, Shoda A, Shimazaki J, et al. Detection of basic fibroblast growth factor (b-FGF) from amniotic membrane. Invest Ophthalmol Vis Sci 1995; 36(Suppl.): 131.
Shun A, Ramsey SG. Human amnion in the treatment of chronic ulceration of the legs. Med J Austr 1983; 17: 279-283.
Sikka OP. Discusión en la presentación de Ropper-Hall (283).
Silverton JS, Trelford JD, Roussere JT. The use of amniotic membrane in acute massive full-thickness loss of the abdominal wall from clostridial myonecrosis. Ann Plast Surg 1979; 3: 558-566.
Simmonds RJ, Holmberg SD, Hurwitz RL. Transmission of human immunodeficiency virus type 1 from a seronegative organ and tissue donor. New Eng J Med 1992; 326: 726-732.
Sipple KC, Ma J, Foster CS. Amniotic membrane surgery. Curr Opin Ophthalmol 2001; 12: 269-281.
Smieja Z, Zakar T, Walton JC, Olson DM. Prostaglandin endoperoxide synthase kinetics in human amnion before and after labor at term and following preterm labor. Placenta 1993; 14: 163-175.
Solomon A, Rosenblatt M, Monroy D, et al Suppression of interleukin 1-alpha and interleukin 1-beta in human limbal epithelial cells cultured on the amniotic membrane stromal matrix. Brit J Ophthalmol 2001; 85: 444-449.
Solomon A, Pires RT, TsengSC. Amniotic membrane transplantation after extensive removal of primary and recurrent pterygia. Ophthalmology 2001; 108: 449-460.
Solomon A, Espana EM, Tseng SC. Amniotic membrana transplantation for reconstruction of conjuntival fornices. Ophthalmology 2003; 110: 93-100.
Sonnenberg A, Calafat J, Janssen H et al. Integrin a6/b4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. J. Cell Biol 1991; 113: 907-917.
Sorsby A, Symons HM. Amniotic membrane grafts in caustic burns of the eye. Br J Ophthalmol 1946; 30: 337-341.
Sorsby A, Haythorne J, Reed H. Further experience with amniotic membrane grafts in caustic burns of the eye. Br J Ophthalmol 1947; 31: 409-418.
Sorsby A, Haythorne J, Reed H. Amniotic membrane grafts in caustic soda burns. Brit J Ophthalmol 1947; 31: 401-404.
Spinelli D, Gambaro S. Amniotic membrane transplantation in ocular surface reconstruction. Abstracts del 8º congreso de la International Society of Dacryology & Dry Eye. 2005, p 40 y 76.
Sridhar MS, Bansal AK, Sangwan VS, et al. Amniotic membrane transplantation in acute chemical and thermal injury. Am J Ophthalmol 2000; 130: 134-137.
Sridhar MS, Sangwan VA, Bansal AK, Rao GN. Amniotic membrane transplantation in the management of shield ulcers of vernal keratoconjunctivitis. Ophthalmology 2001; 108: 1218-1222.
Steinkogler FJ, Haddad R.Bindehautersatz-vergleichende, tierexperimentelle Studie. (Conjunctival reconstruction – A comparative experimental study). Klin Monatsbl Augenheilk 1985; 187: 359-360 (en alemán).
Stellwag von Carion C. (1823-1904). Citado por De Rötth, p 523 (68).
Stern M. The grafting of preserved amniotic membrane to burned and ulcerated surfaces, substituting skin grafts. J Am Med Assoc 1913; 60: 973-974.
Su CY. Lin CP. Combined use of an amniotic membrane and tissue adhesive in treating corneal perforation: a case report. Ophthalmic Surgg Lasers 2000; 31: 151-154.
Subrahmanyam M, Amniotic membrane as a cover for microskin grafts. Brit J plast Surg 1995; 48: 477-478.
Sutton L, Gadd M, Masson DY, Redman CW. Cells bearing class II MHC antigens in the human placenta and amniochorion. Immunology 1986; 58: 23-29.
Talmi YP, Sigler L, Inge E, Finkelstein Y, Zohar Y. Antibacterial properties of human amniotic membranes. Placenta 1991; 12: 285-288.
Tancer ML, Katz M, Verdiano NP. Vaginal epithelization with human amnion. Obstet Gynecol 1979; 54: 345-349.
Terranova VP, Lyall RM. Chemotaxis of human gingival epithelial cells to laminin: a mechanism for epithelial cell apical migration. J Periodontol 1986; 57: 311-317.
Terreros y Pando, E de. Diccionario Castellano con las voces de ciencias y artes. Madril:Impr. Vda. de Ibarra, 1786. Tomo I. p. 95.
Ti SE, Tow SLC, Chee SP. Amniotic membrane transplntation in entropion surgery. Ophthalmology 2001; 108: 1209-1217.
Ti SE, Anderson D, Touhami A, et al.. Factors affecting the outcome following transplantation of ex vivo expanded limbal epithelium on amniotic membrane for total limbal deficiency in rabbits. Invest Ophthalmol Vis Sci 2002; 43: 2584-2592.
Ti SE, Grueterich M, Espana EM, et al. Correlation of long term phenotypic and clinical outcomes following limbal epithelial transplantation cultivated on amniotic membrane in rabbits. Br J Ophthalmol 2003; 88: 422-427.
Tokomori K, Ohkura M, Kitano Y, Hori T, Nakajo T. Advantages and pitfalls of amnion inversion repair for the treatment of large unruptured omphalocele: results of 22 cases. J Pediatr Surg 1992; 27: 882-884.
Tolhurst DE, van der Helm TW. The treatment of vaginal atresia. Surg Gynecol Obstet 1991; 172: 407-414.
Toth P, Rao CV. Direct novel regulation of cyclooxygenase (COX) and prostacyclin synthase (PGI2-S) by hCG in human amnion. Placenta 1992; 13: A63.
Toth P, Li X, Rao CV. Expression of hCG/LH receptor gene and its functional coupling to the regulation of cyclooxygenase-1 and -2 enzymes in human fetal membranes. Placenta 1993; 14: A78.
Touhami A, Grueterich M, Tseng SC. The role of NGF signaling in human limbal epithelium expanded by amniotic membrane culture. Invest Ophthalmol Vis Sci 2002; 43: 987-994.
Tözüm R. Homotransplantation of the amniotic membrane for the treatment of congenital absence of vagina. Int J Gynarcol Obstet 1976; 14: 553-556.
Trelford JD, Hanson FW, Anderson DG. Amniotic membranes as a living surgical dressing in human patients. Oncology 1973; 28: 358-364.
Trelford JD, Trelford-Sauder M. The amnion in surgery, past and present. Am J Obstet Gynecol 1979; 134: 833-845.
Trelford-Sauder M. Trelford JD. Replacement of the peritoneum with amnion following pelvic exenteration. Surg Gynecol Obstet 1977; 145: 699-671.
Trelford-Sauder M, Dawe EJ, Trelford JD. Use of allograft amniotic membrane for control of intra-abdominal adhesions. J Med 1978; 9: 273-284.
Troensagaard-Hansen E, Amniotic grafts in chronic skin ulcerations. Lancet 1950; 1: 859-860.
Tsai RJF, Li LM, Chen JK. Reconstruction of damaged corneas by transplantation of autologous limbal epithelial cells. N Engl J Med 2000; 343: 86-93.
Tseng SCG, Prabhasawat P, Lee SH. Amniotic membrane transplantation for conjunctival surface reconstruction. Am J Ophthalmol 1997; 124: 765-774.
Tseng SCG, Tsubota K. Important concepts for treating ocular surface and tear disorders. Am J Ophthalmol 1997; 124: 825-835.
Tseng SCG, Prabhasawat P, Barton K, et al.. Amniotic membrane transplantation with or without limbal allografts for corneal surface reconstruction in patients with limbal stem cell deficiency. Arch Ophthalmol 1998; 116: 431-441.
Tseng SCG, Li DQ, Ma X. Down-regulation of TGF-b1, b2, b3, and TGF- b receptor II expression in human corneal fibroblasts by amniotic membrane. Inv Ophthalmol Vis Sci 1998; 15: 39:S428.
Tseng SC, Li DQ, Ma X. Suppression of transforming growth factor-beta isoform, TGF-beta receptors type II, and myofibroblast by amniotic membrane matrix. J Cell Physiol 1999; 179: 325-335.
Tseng SCG, Prabhasawat P, Barton K, et al. Amniotic membrane transplantation of autologous limbal epithelial cells. N England J Med 2000; 343: 86-93.
Tseng SCG. Amniotic membrane transplantation found effective in managing acute ocular burns Ocular Surg News Int’l 2000; 11(9): 17-18.
Tseng SC. Amniotic membrane transplantation for ocular surface reconstruction. Biosci Rep 2001; 21: 481-489.
Tseng SC, Meller D, Anderson DF, et al. Ex vivo preservation and expansion of human limbal epithelial stem cells on amniotic membrane for treating corneal diseases with total limbal stem cell deficiency. Adv Exp Med Biol 2002; 506: 1323-1334.
Tseng SC, Tsubota K. Amniotic membrane transplantation for for ocular surface reconstruction. I: Holland EJ, Mannis MJ (eds.). Ovcular surface disease: Medical and surgical management. New York.: Springer. 2002; 226-231.
Tseng SC, Espana EM, Kawakita T, et al. How does amniotic membrane work? The Ocular Surface: 2004; 2: 177-187.
Tsubota K, Satake Y, Ohyama M, et al. Surgical reconstruction of the ocular surface in advanced ocular cicatricial pemphigoid and Stevens-Johnson syndrome. Am J Ophthalmol 1996; 122: 38-52.
Tsubota K, Satake Y, Shimazaki J. Treatment of severe dry eye. Lancet 1996; 348: 123.
Tsubota K, Shimazaki J. Surgical treatment of children blinded by Stevens-Johnson syndrome. Am J Ophthalmol 1999; 128: 573-581.
Tsubota K,Satake Y, Kaido M, et al.. Treatment of severe ocular surface disorders with corneal epithelial stem cell transplantation. N Engl J Med 1999; 22: 1697-1703.
Tyszkiewicz JT, Uhrynowska-Tyszkiewicz IA, Kaminski A, Dziedzic-Goclawska A. Amnion allografts prepared in the central tissue bank in Warsaw. Ann Transplant 1999; 4: 85-90.
Ucakhan OO, Koklu G, Firat E. Nonpreserved human amniotic membrane transplantation in acute and chronic chemical eye injuries. Cornra 2002; 21: 169-172.
Uchida S, Inanaza Y, Robayashi M. Neurotrophic function of conditioned medium from human amniotic epithelial cells. J Neurosci Res 2000; 65: 585-590.
van Herendael BJ, Oberti C. Brosens I. Microanatomy of the human amniotic membranes. A light microscopic, transmission, and scanning electron microscopic study. Am J Obstet Gynecol 1978; 131: 872-880.
Vishwakarms GK, Khare AK. Amniotic arthroplasty for tuberculosis in the hip. J Boin Joint Surg 1986; 68-B: 68.
Walker A, Cooney DR, Allen JE. Use of fresh amnion as a burn dressing. J Pediatr Surg 1977; 12: 391-395.
Walsh H, Hildebrandt RJ, Prystowsky H. Growth inhibition factors in amniotic fluid. Am J Obstet Gyneco 1965; 93: 590-591.
Wang M, Gray T, Prabhasawat P, et al. Corneal haze is reduced by amniotic membrane matrix in excimer laser photoablation in rabbits. Invest Ophthalmol Vis Sci 1997; 38: S405.
Wang MX. Gray TB, Parks WC, et al. Reduction in corneal haze and apoptosis by amniotic membrane matrix in excimer laser photoablation in rabbits. J Cataract Refract Surg 2001; 27: 310-319.
Ward DJ, Bennet JP, Burgos H, Fabre J. The healing of chronic venous leg ulcers with prepared human amnion. Brit J Plast Surg 1989; 42: 463-467.
Wilson SE, Chen L, Mohan RR, et al. Expression of HGH, KGF, EGF and receptor messenger RNA following corneal epithelial wounding. Exp Eye Res 1999; 68: 377-397.
Wolff HJ, Schmidt W, Drenckhahn D. Immunocytochemical analysis of the cytoskeleton of the human amniotic epithelium. Cell Tissue Res 1991; 266: 385-389.
Woo HM, Kim MS Kweon OK et al. Effect of amniotic membrane of epithelial wound healing and stromal remodeling after excimer laser keratectomy in rabbit cornea. Br J Ophthalmol 2001; 85: 345-349.
Wylegala E, Tarnawska D. Amniotic membrane transplantation with cauterization for keratoconus complicated by persisten hydrops in mentally retarded patients. Ophthalmology 2006; 113: 561-564.
Yam HF, Pang CP, Fan DS. Et al. Growth factor changes in ex vivo expansion of human limbal epithelial cells on human amniotic membrane. Cornea 2002; 21: 101-105.
Yeh LK, Chen WL, Li W, et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Invest Ophthalmol Vis Sci 2005; 46: 479-486.
You L, Kruse FE, Rohrschneider K. Use of amniotic membrane for autologous transplantation of corneal epithelium. Ophthalmologe 1998; 95: 130.
Yurchenco PD, Ruben GC. Basement membrane structure in situ: evidence for lateral association in the type IV collagen network. J Cell Biol 1987; 105: 2559-2568.
Zaikova MV, Lialin AN. (Use of alloamnion in high progressive myopia). Vestn Oftalmol 1983; 99: 32-35 (en ruso).
Zaikova MV. Molokova NF. Umbilical tissue transplantation in progressive myopia. Vestn Oftalmol 1991; 107: 18-21 (en ruso).
Zapata C, Coria de la Hoz M. Reconstrucción de la superficie ocular con membrana amniótica. Arch Chil Oftalmol 2001; 58: 51-55.
Zohar Y, Talmi YP, Finkelstein Y, et al. Use of human amniotic membrane in otolaryngologyc practice. Laryngoscope 1987; 97: 978-980.