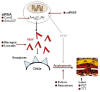
Fig. 1: Mecanismos básicos de acción de las nuevas terapias antiangiogénicas.
REVISIÓN ACTUALIZADA
S. FIGUEROA M1, NOVAL S2, CONTRERAS I3
(1) Doctor en Medicina y Cirugía. Hospital
Ramón y Cajal. Madrid.
(2) Licenciado en Medicina. Hospital La Paz. Madrid.
(3)
Licenciado en Medicina. Hospital Ramón y Cajal. Madrid.
La angiogénesis consiste en la formación de nuevos vasos sanguíneos a partir de vasos ya existentes. Se trata de un proceso esencial para una serie de funciones biológicas (1-3). Requiere de la interacción de múltiples factores de crecimiento y de moléculas de adhesión, desarrollándose principalmente en respuesta a la hipoxia. Pero la angiogénesis también está implicada en múltiples procesos patológicos, incluyendo la degeneración macular asociada a la edad (DMAE), las retinopatías proliferativas y el cáncer (4,5).
La angiogénesis se inicia con la liberación de citoquinas, que conducen a la vasodilatación de los vasos existentes y al aumento de su permeabilidad. Además, desencadenan la degradación de la matriz extracelular circundante, lo que facilita la migración y proliferación de células endoteliales. Tras el frente de avance de las células endoteliales en proliferación se encuentra una zona en la que las células dejan de proliferar y se organizan para formar el nuevo capilar. Finalmente, estos vasos se fusionan y generan una red vascular. Esta red posteriormente experimenta un proceso de maduración y remodelación para constituir un sistema vascular estable (4).
El proceso descrito depende del balance entre factores que promueven la angiogénesis y factores que la inhiben. Existen diversos activadores de la angiogénesis, siendo quizás la hipoxia el principal de ellos. Los factores angiogénicos liberados localmente por los tejidos activan a las células endoteliales y promueven la migración, proliferación y diferenciación celular. Los factores antiangiogénicos, por el contrario, inhiben estas señales. Entre estos últimos se encuentran la tromboespondina, la angioestatina, la endostatina y el factor derivado de epitelio pigmentario (PEDF, del inglés «pigment epithelium-derived factor») (2). Entre los factores angiogénicos identificados se encuentran el factor de crecimiento endotelial vascular (VEGF, del inglés «vascular endotelial growth factor»), las distintas familias del factor de crecimiento fibroblástico (FGF, «fibroblast growth factor»), el factor de crecimiento transformante (TGF, «transforming growth factor») y las angiopoyetinas 1 y 2 (1,2,6). De entre todos los factores conocidos que regulan la angiogénesis, la evidencia apunta a que el VEGF-A es uno de los principales. El VEGF-A es una glucoproteína homodimérica que actúa como factor de crecimiento específico para células endoteliales (6). Puede inducir angiogénesis, aumento de la permeabilidad vascular y linfangiogénesis; además, previene la apoptosis en células endoteliales (7). Los neovasos tienen una dependencia marcada del VEGF que no se presenta en los vasos ya estabilizados (8). Existen múltiples isoformas de VEGF-A en humanos. Entre ellas, de especial relevancia son las isoformas VEGF121, VEGF165, VEGF189 y VEGF206 (9). La isoforma VEGF165 es la más abundante. Todas las isoformas pueden ser procesadas por la plasmina, dando lugar a una forma más pequeña, bioactiva, con mayor capacidad de difusión: la forma VEGF110 (10). Estudios recientes demuestran que también la metaloproteasa de la matriz (MMP) 3 puede procesar VEGF165 para generar fragmentos bioactivos (11).
Los receptores del VEGF pertenecen al grupo de las tirosin-quinasas (12). La activación de los receptores VEGFR1 o VEGFR2 conduce a la activación de cascadas de transducción de señales intracelulares. El VEGFR2 es el principal mediador de los efectos mitogénicos, angiogénicos y de aumento de permeabilidad vascular del VEGF (7).
El VEGF-A ha sido implicado en la patogénesis de enfermedades como la DMAE y la retinopatía diabética. En humanos, la expresión de VEGF-A aumenta en las células del epitelio pigmentario de la retina (EPR) durante las fases precoces de la DMAE, lo que hace pensar que desempeña un papel en el inicio de la neovascularización (13). Además, se han encontrado concentraciones elevadas de VEGF-A en membranas neovasculares coroideas extirpadas de pacientes con DMAE (14) y en el humor vítreo de pacientes con neovascularización coroidea (NVC) (15). También se ha encontrado una correlación positiva entre niveles intraoculares de VEGF-A y la formación de vasos sanguíneos en pacientes con retinopatía diabética (16). Se ha descrito la presencia de niveles aumentados de VEGF-A vítreos e intrarretinianos tanto en animales como en personas con retinopatías isquémicas inducidas por daño oxidativo o por hipoxia (16-19). Trabajos recientes sugieren que los niveles oculares de VEGF están asociados tanto con el crecimiento como con la permeabilidad de los neovasos (20-22).
El reconocimiento del papel que desempeña el VEGF en la regulación de la angiogénesis ha conducido al desarrollo de nuevas estrategias terapéuticas en las enfermedades caracterizadas por neovascularización o por exudación vascular (fig. 1) (23,24).

Fig. 1: Mecanismos básicos de acción de las nuevas terapias
antiangiogénicas.
PEGABTANIB SÓDICO (Macugen®, Pfizer Opthalmics)
En diciembre de 2004, la Food and Drug Administration (FDA) aprobó el pegabtanib sódico como tratamiento para la DMAE exudativa. El pegabtanib es un oligonucleótido de ARN de 28 bases unido a dos cadenas de polietilenglicol (PEG) ramificadas. Funciona como un aptámero, uniéndose al VEGF165 de tal forma que previene su interacción con los receptores de superficie del VEGF de las células endoteliales (25). Para prolongar su actividad en el lugar de acción, se modificó la base glucídica del pegabtanib y se añadieron las cadenas de polietilenglicol para aumentar la vida media del fármaco en el vítreo (26,27).
Tras los estudios preclínicos (28), en 2003 se publicaron los resultados de un estudio de fase II con 21 pacientes con NVC en el contexto de DMAE con agudeza visual (AV) menor o igual a 0,2 en el ojo de estudio tratados con inyecciones intravítreas de pegabtanib de 3 mg aisladas o combinadas con terapia fotodinámica (TFD) (29). La visión se estabilizó o mejoró en 87,5% de los pacientes que recibieron pegabtanib comparado con el 60% en pacientes tratados con pegabtanib y TFD. El pegabtanib fue bien tolerado en combinación con la TFD sin inactivar su efecto (29).
En 2002 se pusieron en marcha dos ensayos clínicos multicéntricos prospectivos, aleatorizados, doble-ciego, conocidos en conjunto como estudio VISION («VEGF Inhibition Study in Ocular Neovascularization») (30). Se enrolaron 1.208 pacientes en 177 centros, con amplios criterios de inclusión. Eran elegibles los pacientes con AV de 0,1 a 0,5, incluyéndose membranas tanto ocultas como mínima y predominantemente clásicas. Los pacientes fueron randomizados para distribuirse en cuatro brazos: placebo (n=304), o bien inyecciones intravítreas de pegabtanib (n=904), a dosis de 0,3 mg, 1 mg o 3 mg. Las inyecciones se repetían cada 6 semanas durante un periodo de 48 semanas. La variable principal del estudio fue el porcentaje de pacientes con pérdida de AV menor de 15 letras a las 54 semanas de la inclusión en el estudio.
Todos los grupos que recibieron pegabtanib presentaban un porcentaje de pacientes con pérdida de AV menor de 15 líneas significativamente mayor que el grupo placebo. De ahora en adelante, se comentaran sólo los resultados obtenidos con la dosis de 0,3 mg, ya que ésta es la aprobada por la FDA para el uso clínico del pegabtanib. Un 70% de los pacientes tratados con 0,3 mg de pegabtanib perdió menos de 15 letras a las 54 semanas, comparado con un 55% entre los controles (p<0,001). Además, un mayor porcentaje de pacientes tratados con pegabtanib conservó o mejoró su AV comparado con el grupo control (33% versus 23%, p=0,003) (30). La media de letras perdidas fue del doble en el grupo control frente al pegabtanib y más del doble de pacientes experimentaron una pérdida severa de visión de 6 líneas (22% versus 10%). El tratamiento fue efectivo tanto en membranas clásicas como ocultas.
Recientemente se han publicado los datos del segundo año de estudio (31). Se encontró que en los pacientes tratados durante el primer año con 0,3 mg de pegabtanib y que continuaron con el tratamiento, la AV permaneció estable durante el segundo año. Por el contrario, los pacientes en los que se interrumpió el tratamiento experimentaron una pérdida de AV. Los pacientes del grupo control fueron los que presentaron un peor resultado visual (31). La interrupción del tratamiento con pegabtanib no produjo un efecto rebote de pérdida acelerada de AV.
La NVC conduce a un daño progresivo del EPR y de los fotorreceptores. La interrupción de la angiogénesis en una fase precoz del proceso podría conducir a una recuperación de la función visual al existir un menor daño estructural de la retina (32,33). Para evaluar esta hipótesis, se realizó un análisis exploratorio de los datos de los estudios VISION (34). Se estudiaron los resultados obtenidos en sujetos con enfermedad precoz incluidos en el estudio, encontrándose que el porcentaje de pacientes con una pérdida de visión menor de 15 letras era del 78%, frente a un 53% en el grupo control (34). Aunque al tratarse de un análisis de un subgrupo con pocos pacientes los resultados deben ser valorados con precaución, apuntan a la posibilidad de un mayor beneficio del tratamiento precoz.
En cuanto a la presencia de efectos adversos, en el ensayo VISION la mayoría de los efectos adversos fueron leves, transitorios y atribuibles al procedimiento de inyección intravítrea (30); los más frecuentes fueron dolor ocular, miodesopsias, queratitis punteada y elevación transitoria de la PIO. En cuanto al desarrollo de cataratas en ojos fáquicos, en el grupo tratado con 0,3 mg de pegabtanib fue del 27%, similar al grupo control. Dentro de los efectos adversos graves, destacan la presencia de endoftalmitis en 1,3%, de desprendimiento de retina en 0,6% y la catarata traumática en un 0,6%. En el segundo año de estudio, la incidencia de endoftalmitis fue de 0,10% por inyección, de desprendimiento de retina de 0,17% y de hemorragia vítrea de 0,27% (35). No se detectó la presencia de elevaciones sostenidas de la presión intraocular (PIO). Un estudio retrospectivo presenta resultados similares en cuanto a los cambios de PIO (36).
Es importante tener en cuenta que la mayor parte de las endoftalmitis ocurrieron en pacientes en los que no se siguió el protocolo de inyección, como por ejemplo el no emplear un blefarostato durante la inyección intravítrea. La observación estricta de un protocolo de asepsia puede reducir el riesgo de endoftalmitis (35).
No se detectó la presencia de efectos adversos sistémicos. La tasa de muerte fue del 2% tanto en el grupo de tratamiento como en el control, una tasa similar a la esperada dada la edad de los pacientes. El pegabtanib intravítreo no se asoció con los posibles efectos adversos inducidos por la inhibición sistémica de VEGF: hipertensión arterial, eventos tromboembólicos o episodios hemorrágicos (35).
Posteriormente, se han publicado dos artículos en los que se comunica el desarrollo de roturas del EPR tras la inyección de pegabtanib, con deterioro visual importante (37,38). Todavía no está claro si existe una relación causal ya que éste es un fenómeno que puede ocurrir como parte de la historia natural de la NVC.
Además de en la NVC que se desarrolla en el contexto de una DMAE, el pegabtanib puede ser útil en el tratamiento de otras enfermedades en cuya patogénesis intervienen la angiogénesis y el incremento de la permeabilidad vascular mediados por el VEGF. Un estudio en fase II ha estudiado la utilidad del pegabtanib en el tratamiento del edema macular (EM) en pacientes diabéticos (39). En este estudio, se incluyeron 172 pacientes randomizados a recibir una inyección intravítrea de pegabtanib (0,3 mg, 1 mg o 3 mg) o falsas inyecciones cada 6 semanas, hasta un máximo de 6 inyecciones. Los resultados de AV y grosor retiniano medido por tomografía de coherencia óptica (OCT) se evaluaron 36 semanas tras la inclusión en el estudio. Estaba permitido realizar fotocoagulación láser después de la semana 13 si se consideraba indicado. Todos los grupos que recibieron pegabtanib presentaron mejores resultados de AV que el grupo control: a las 36 semanas, el porcentaje de pacientes con mejoría de 3 o más líneas de AV era de 18% con 0,3 mg de pegabtanib, comparado con un 7% del grupo control. El cambio medio de grosor retiniano fue de –68,0 y +3,7 µm respectivamente para pegabtanib 0,3 mg y controles. Sólo un 25% de los pacientes tratados con pegabtanib 0,3 mg precisaron tratamiento con láser comparado con un 48% del grupo control (p=0,042). Todo esto sugiere que el pegabtanib puede ser eficaz en el tratamiento del EM diabético, aunque serían precisos estudios a más largo plazo para saber si los efectos beneficiosos persisten en el tiempo al menos 3 años (como ha demostrado la fotocoagulación focal).
Posteriormente, se realizó un análisis retrospectivo del ensayo clínico descrito para determinar si el pegabtanib tenía algún efecto en aquellos pacientes que además de EM, presentaban neovasos en el seno de su retinopatía diabética (40). Dieciséis pacientes con neovascularización retiniana en el examen basal previo a la inclusión en el ensayo fueron evaluados. Al final del seguimiento, 8 de los 13 (62%) pacientes que recibieron pegabtanib demostraron una regresión o ausencia de neovasos, comparados con 0 de 3 pacientes del grupo control (40). Basándose en el mecanismo de acción del pegabtanib, así como en estos resultados y en algún otro caso aislado, hacen pensar que el pegabtanib se podría emplear como terapia aislada o combinada con el tratamiento láser en pacientes con retinopatía diabética proliferativa (41,42).
RANIBIZUMAB (Lucentis®, Genetech, Inc, South San Francisco, CA)
Se trata del fragmento Fab del anticuerpo recombinante anti-VEGF-A, con un tercio del tamaño del anticuerpo completo y con capacidad para penetrar en todas las capas de la retina. Inactiva todas las formas activas del VEGF-A, no solo la isoforma VEGF165. Se administra por medio de inyección intravítrea en dosis de 0,3 ó 0,5 mg en 0,05 ml.
Se han diseñado múltiples ensayos clínicos multicéntricos que tratan de evaluar la eficacia de las inyecciones intravítreas de ranibizumab en las MNV por DMAE (43-45). En el denominado estudio MARINA, multicéntrico, randomizado y doble ciego, se comparan los resultados visuales entre tres grupos de tratamiento: 0,3 mg, 0,5 mg y placebo, para MNV mínimamente clásicas u ocultas. Las inyecciones se aplican mensualmente durante dos años. Al cabo de un año, existían diferencias estadísticamente significativas de los grupos tratados respecto a los pacientes que reciben placebo en todas las variables que evalúan los cambios de AV (p<0,001 en todos las comparaciones) (43). El grupo ANCHOR comparó mediante un estudio multicéntrico, randomizado y doble ciego, la eficacia de ambas dosis respecto a la TFD en MNV predominantemente clásicas. De nuevo las diferencias eran estadísticamente significativas a favor del ranibizumab (p<0,001) (45). En ambos estudios, el porcentaje de pacientes en los que la AV disminuía menos de 15 letras, alcanza aproximadamente el 95% con ambas dosis, frente al 60% de los pacientes tratados con placebo o TFD. Más alentadores son los incrementos de AV superiores a 15 letras que se obtuvieron en entre un 25% y un 40% de los casos tratados con ranibizumab, muy por encima del 5% conseguido con el placebo o la TFD. La tasa de endoftalmitis en los dos estudios varía entre un 1% y un 1,4% y la de uveítis severa entre el 0,7% y el 1,3% (43,45). En la actualidad otros estudios tratan de averiguar si ampliar el intervalo entre inyecciones permite mantener estos resultados visuales o si asociar el ranibizumab a la TFD aporta beneficios adicionales (44).
Como la inflamación es el principal efecto adverso asociado a las inyecciones intravítreas de ranibizumab y en estudios con animales se vio que se podía reducir si se alcanzaban dosis máximas de manera escalonada, se diseñó un estudio para confirmar esta teoría en humanos y valorar la diferencia en alcanzar dosis de hasta 2 mg en comparación con las dosis repetidas de 0,3 ó 0,5 mg (46). La AV mejoró en un 40% de los pacientes en el regimen escalonado, lo que no superó los resultados preliminares del estudio multicéntrico, observandose además reacciones inflamatorias en algunos pacientes que obligaban a reducir las dosis.
El principal efecto secundario asociado a la inyección intravítrea de ranibizumab es la aparición frecuente, hasta un 80% de los pacientes, de una reacción inflamatoria en la cámara anterior, pero en la mayor parte de los casos es leve, resolviéndose en dos semanas sin tratamiento (46-48). Entre un 20% y un 30% de los pacientes sufren incrementos transitorios de la presión intraocular superiores a 10 mmHg que se resuelven de forma inmediata sin tratamiento (46,47). En el estudio de Heier et al, 3 de 62 pacientes tratados con ranibizumab sufrieron efectos secundarios severos: un caso de iridociclitis severa recurrente resuelta con tratamiento tópico, un caso de obstrucción de vena central de la retina y otro de endoftalmitis estafilocócica; esto representa una tasa de 0,002 casos por inyección o del 2% por ojo tratado (47). Otros efectos secundarios poco frecuentes que se han registrado son la aparición de hemorragias vítreas o desgarros en la retina. En la serie de Rosenfeld un paciente sufrió un episodio de AIT (46). La tasa de eventos isquémicos es similar en los pacientes tratados con 0,3 mg de ranibizumab y con placebo en los dos estudio multicéntricos sobre DMAE, aproximadamente del 1,5%, pero ligeramente superior en el subgrupo tratado con la dosis de 0,5 mg (2,9%) (43-45). No se ha detectado la aparición de anticuerpos anti- ranibizumab en suero (46,47).
Al igual que sucede con el pegabtanib, se ha estudiado la utilidad del ranibizumab en el tratamiento del EM. Un estudio preliminar valoró la utilidad de dosis repetidas de 0,5 mg de ranibizumab a intervalos crecientes en 10 pacientes con EM diabético crónico refractario. Éste produjo una reducción significativa en el grosor macular medido por OCT a la semana de la primera inyección, que llegó al 85% a los 7 meses de seguimiento. El grosor macular sufrió fluctuaciones sobre todo entre las inyecciones administradas mensualmente, pero estos cambios no parecían afectar al incremento progresivo y más lento de la AV, que presentó una mejoría media de dos líneas (49). Chun et al han publicado un estudio similar con una mejoría de al menos 2 líneas de AV en 5 de los 10 pacientes participantes. Aunque no se pueden sacar conclusiones de un estudio tan pequeño, parece que existe una tendencia a mejores resultados visuales con la dosis de 0,3 mg mientras que la mayor reducción del grosor macular se obtiene en el grupo tratado con 0,5 mg que partía de niveles basales más altos (48).
BEVACIZUMAB (Avastin®, Genetech, Inc., South San Francisco, CA)
En el desarrollo tumoral la generación de nuevos vasos es fundamental. El bevacizumab es un anticuerpo anti-VEGF aprobado para el tratamiento del cancer de colon y recto metastático, lo que permite que se encuentre disponible en los centros hospitalarios aunque haya que solicitarlo como uso compasivo para sus aplicaciones oculares (fig. 2).

Fig. 2: Preparado comercial disponible de bevacizumab.
Se trata de un anticuerpo monoclonal completo con dos sitios de unión para el VEGF y capaz de inhibir, al igual que el ranibizumab, todas sus formas activas. Su alto peso molecular y su tamaño se consideraron impedimentos para su actuación a nivel intraocular por una supuesta incapacidad para penetrar a través de las capas internas de la retina, pero lo cierto es que logra reducir los niveles de VEGF lo suficiente para disminuir la exudación vascular de forma clínicamente significativa (50,51).
En un estudio retrospectivo de 266 ojos con MNV secundaria a DMAE refractarias a otras terapias o de mal pronóstico inicial, como las ocultas extensas o las mínimamente clásicas, se evaluó el efecto de 3 inyecciones intravítreas de 1,25 mg, administradas mensualmente; se planteó retratar los casos en los que persistía o recidivaba la exudación. Entre un 30-40% de los pacientes mejoraron su AV desde el primer mes, tanto los casos tratados por primera vez como los refractarios a otros tratamientos. La proporción de pacientes en los que se redujo el grosor macular medido por OCT fue aun mayor, pero no se encontró correlación con los resultados funcionales. Aunque los resultados son esperanzadores, se trata de un estudio retrospectivo, no controlado y con un período de seguimiento muy corto (50).
En otro estudio retrospectivo se incluyeron 53 ojos con DMAE exudativa con engrosamiento macular central medido por OCT, la mayoría de ellos tratados previamente con otras terapias; las reinyecciones se indicaban si se confirmaba la presencia de maculopatía quística o líquido subretiniano en las revisiones mensuales. El número medio de inyecciones fue de 2,3 de las 4 máximas establecidas. Si empleamos como criterio de mal resultado visual las pérdidas mayores o iguales a tres líneas, tras tres meses de seguimiento la tasa de fracaso terapéutico es de tan solo el 8%, con un 26% de ojos en los que la visión no cambia y un 59% de casos en los que la AV mejora. No cambian los resultados en el subgrupo de ojos tratados previamente. Se produce una reducción en el grosor medio central y aparecen cambios fibrosos en los ojos en los que la visión continúa empeorando. De nuevo los resultados son prometedores, pero limitados por el diseño del estudio y el corto periodo de seguimiento (51).
Los pacientes con retinopatía miópica también pueden complicarse con la aparición de membranas neovasculares. Yamamoto et al han estudiado la utilidad del bevacizumab intravítreo en 11 ojos con MNV subfoveales clásicas miópicas, obteniendo mejoría de la AV en 10 de los casos tras 5 meses de seguimiento y con necesidad de retratamiento en sólo 3 de los casos (52). Sakaguchi et al obtienen resultados similares en una serie prospectiva de 8 casos con MNV miópicas subfoveales y yuxtafoveales (53).
Los efectos secundarios del bevacizumab administrado por vía intravenosa son bien conocidos y se sabe que duplica el riesgo de fenómenos tromboembólicos en los pacientes en tratamiento quimioterápico y que induce aumentos en la tensión arterial. Las dosis sistémicas son cuatrocientas veces más altas que las que se inyectan a nivel intraocular; además no se introduce directamente al torrente vascular. Es difícil discernir si los escasos casos de muerte que aparecen en las series publicadas se relacionan directamente con el uso intravítreo del bevacizumab o bien se deben a la patología de base de una población con una edad media avanzada (50). Algunas series optan por excluir a los pacientes con antecedentes de hipertensión arterial no controlada o fenómenos tromboembólicos recientes y por monitorizar la tensión arterial (51,54,55). En las series publicadas más amplias no se ha registrado ningún caso de desprendimiento de retina, catarata iatrogénica ni endoftalmitis (50-57). La presencia del fragmento Fc del anticuerpo en el bevacizumab no parece provocar los efectos proinflamatorios que se le atribuyen, encontrando incluso menos reacciones inflamatorias intraoculares que con el uso de ranibizumab (50,51). Abrahám-Marin et al registran una respuesta inflamatoria leve en la cámara anterior en el 20% de sus pacientes que se resuelve espontáneamente, sin embargo Pieramici et al han publicado un caso de uveítis anterior moderada tras inyecciones repetidas que sí requirió tratamiento tópico (55,58). Pendiente de confirmar su seguridad a nivel sistémico, el bevacizumab intravítreo presenta escasos efectos tóxicos a nivel local (54,57,59).
El estímulo isquémico para incrementar la producción del VEGF puede proceder de múltiples patologías oculares, por lo que la terapia con bevacizumab podría tener un amplio abanico de indicaciones (56,60-62). Iturralde et al han publicados los primeros resultados a corto plazo de un estudio retrospectivo con 16 ojos con EM quístico por obstrucción de vena central de la retina (OVCR). La AV media aumenta de forma significativa de 20/600 a 20/138 a los 3 meses de seguimiento con inyecciones repetidas, con reducción del grosor macular medido por OCT. Los pacientes que no habían sido controlados previamente con triamcinolona responden de manera similar (56). Varios autores han estudiado la utilidad del bevacizumab en la retinopatía diabética de tipo proliferativo (RDP). En un estudio con 32 pacientes con RDP iridiana o retiniana, en su mayoría ya panfotocoagulados, se resuelve la neovascularización en un 60% de los casos. El seguimiento medio de cinco semanas es demasiado corto para conocer la tasa de recurrencias, que se pueden observar desde tiempos muy precoces. Al menos de momento, se puede considerar un tratamiento útil en los casos con opacidad de medios en los que no se pueda realizar de forma inmediata la panfotocoagulación, en los que exista EM que pueda empeorar con la terapia con láser o en los que la neovascularización progrese a pesar de ésta (54,57,63,64). También parece que puede ser útil para prevenir el sangrado intraquirúrgico inyectado días antes de la vitrectomía en casos de RDP complicados o de implantación de sistemas de drenaje en glaucomas neovasculares (54,65,66). La capacidad del bevacizumab intravítreo para inducir la regresión de la neovascularización en el polo anterior, parece ser útil para el control de los glaucomas neovasculares (66,67).
ACETATO ANECORTAVE (Retaane® 15 mg Alcon Research, Forth Worth, TX)
El acetato de anecortave es un agente angiostático derivado sintéticamente del cortisol en el que se reemplaza un grupo 11b-OH por un doble enlace en las posiciones 9,11 con lo que se logra eliminar su actividad glucocorticoide (fig. 3). Se trata de un inhibibidor de la angiogénesis independiente del estímulo inicial que actúa mediante la inhibición de proteasas como el activador de plasminógeno similar a la urokinasa y la metaloproteinasa-3 necesarias para permitir la migración de las células endoteliales a través de la matriz extracelular.
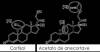
Fig. 3: Acetato de anecortave, agente angiostático derivado
sintéticamente del cortisol.
Se inyecta a nivel superotemporal por vía subtenoniana con una cánula especialmente diseñada hasta depositarlo yuxtaescleral posterior a nivel de la mácula. Se trata de un preparado depot que consigue mantener niveles terapéuticos a nivel retinocoroideo durante seis meses, por lo que éste es el intervalo medio que hay que esperar entre inyecciones repetidas.
Existen dos estudios multicéntricos que han evaluado la utilidad del anecortave en NVC asociada a DMAE (68,69). El primero compara su eficacia frente a placebo en membranas subfoveales sobretodo de tipo clásico. Tras una sola dosis de 15 mg, los resultados en cuanto a AV son superiores significativamente en el grupo tratado con anecortave frente a placebo, mientras que en los grupos con dosis de 3 y 30 mg las diferencias no son estadísticamente significativas. Sólo en el grupo de MNV predominantemente clásicas se obtiene un porcentaje de respondedores (pérdida de AV inferior a 3 líneas) significativamente superior con15 mg de anecortave que con placebo. Hasta un 18% del grupo tratado con 15 mg de anercortave presenta una mejoría de AV de al menos 2 líneas, frente a ningún paciente del grupo placebo (69). La superioridad del anecortave en dosis de 15 mg frente al placebo persiste a los 12 meses de tratamiento, con un porcentaje de pacientes con AV estable (pérdidas inferiores a 3 líneas) del 79% frente al 53% y un menor porcentaje de pacientes con pérdidas de visión severa, 3% frente al 23% respectivamente (68). Sin embargo, estos resultados deben ser interpretados con precaución por el porcentaje tan alto de pacientes que abandona el estudio por progresión de la enfermedad.
El segundo ensayo multicéntrico es un estudio prospectivo randomizado con 530 pacientes que compara la eficacia del anecortave frente a la terapia fotodinámica (TFD) con verteporfin (Visudyne®, Novartis AG, Bülach, Switzerland) en el tratamiento de las membranas neovasculares subfoveales predominantemente clásicas. El anecortave se administra cada 6 meses y la TFD cada 3 meses si persiste la actividad angiográfica, durante un año. La tasa de pacientes respondedores a los 12 meses, es decir con pérdidas de AV inferiores a 3 líneas, fue similar en ambos grupos de tratamiento, 45% y 49% respectivamente, con diferencias no clínicamente significativas en la AV a favor del anecortave. Por lo tanto, no se pudo demostrar una ventaja terapeútica en el uso del anecortave frente a la TFD. La respuesta al tratamiento esteroideo mejora en los casos en los que no se observa reflujo en el momento de la inyección así como cuando los retratamientos no se retrasan más de 6 meses (69). Otra forma de DMAE exudativa de mal pronóstico como es la proliferación retiniana angiomatosa no parece responder a la terapia con anecortave, pues aunque logra reducir la permeabilidad capilar no frena la progresión de la neovascularización ni la consiguiente pérdida visual (70).
En este momento se están llevando a cabo dos ensayos clìnicos con acetato de anecortave. El primero tiene como objetivo evaluar su utilidad en terapia combinada con antiangiogénicos intravítreos, en un intento de reducir el número de reinyecciones (Bridge Trial) y el segundo evaluará su utilidad como tratamiento preventivo de la forma exudativa de la DMAE en ojos de alto riesgo (AART).
Al eliminar sintéticamente sus propiedades glucocorticoides se evitan los efectos adversos locales típicos de estos, como son los incrementos de la presión intraocular o el desarrollo acelerado de cataratas. Los efectos secundarios más frecuentes están relacionados con el proceso de inyección, todos ellos de carácter leve y transitorio (68,69). Cuadros visualmente más severos como la obstrucción de arteria central de la retina se han registrado de forma aislada (71). No se han descrito efectos sistémicos hasta el momento (68-73).
Sus efectos angiostáticos pueden tener aplicación en otros procesos exudativos o neovasculares. Eandi et al han publicado los resultados preliminares de una serie de casos de telangiectasias idiopáticas perifoveales, con buena respuesta visual tanto en fases exudativas como proliferativas, en las que el anecortave administrado periódicamente parece frenar e incluso es capaz de inducir la regresión de la neovascularización (72). A nivel experimental la aplicación de anecortave al 1% en gotas ha demostrado ser capaz de interferir con los fenómenos de neovascularización corneal e incluso de inhibir el crecimiento de tumores intraoculares de tipo melanótico (74,75). Aplicado de forma intravítrea en modelos animales de retinopatía de la prematuridad también parece ofrecer buenas expectativas terapeúticas (76).
TRIAMCINOLONA (Trigon Depot®, Bristol-Myers Squibb)
La utilización de la triamcinolona como tratamiento de la vitreoretinopatía proliferativa fue propuesta ya en 1980 (77). Existe evidencia de que los corticoesteroides tienen propiedades anti-inflamatorias, anti-edematosas y anti-angiogénicas (78,79). Inhiben la vía de la fosfolipasa A, que conduce a la formación de prostaglandinas y leucotrienos. Interfieren con la liberación de mediadores de inflamación celular e inhiben la quimiotaxis leucocitaria (80). La TA también reduce la expresión de metaloproteasas (80). La TA intravítrea (TAiv) ha demostrado ser un potente inhibidor de la neovascularización corneal, coroidea y preretiniana en modelos animales (77,81-85). En humanos, la TAiv ha demostrado reducir la rotura de la barrera hematoacuosa tras fotocoagulación con láser, disminuir la inflamación tras la vitrectomía e inducir la regresión de neovasos (fig. 4) (86-88).
Fig. 4: Triamcionolona depositada en la cavidad vítrea.
En base a estos efectos, la TAiv se ha estudiado como tratamiento aislado o combinado con TFD en la DMAE con NVC (89). Gillies et al realizaron un estudio prospectivo randomizado de tratamiento de NVC clásica subfoveal con una inyección única de 4 mg de TA (90). Ésta produjo un menor crecimiento de la lesión a los 3 meses de tratamiento, que sin embargo no se tradujo en un mejor resultado visual comparado con el grupo placebo. Se han publicado otros estudios sobre TAiv como monoterapia que demuestran mejorías significativas pero transitorias en el grado de exudación y en AV (91-96). En una serie de 187 pacientes tratados con 25 mg de TAiv, se detectó una mejoría significativa de AV 1 y 3 meses tras la inyección, pero a los 6 meses de seguimiento la AV era menor que la basal (97).
Dado que la TAiv en monoterapia no parece obtener una eficacia mantenida en el tiempo, se ha estudiado su utilidad en combinación con la TFD. Esta combinación está justificada dado que la TFD produce una reacción inicial inflamatoria y exudativa, con un incremento en la producción local de VEGF, lo que contribuye a la reaparición de la NVC (98,99). Dicha reacción podría ser restringida por la TA (80,100). En un estudio piloto, Spaide et al obtuvieron una mejoría media de AV de 2,5 líneas en lesiones no tratadas previamente, con una tasa de retratamientos de 1,24 (101). Una serie de 184 pacientes describió resultados similares, con un incremento medio de 1,22 líneas de AV y una media de 1,21 retratamientos con un seguimiento de 43 semanas (102); la respuesta fue positiva independientemente del tipo de lesión angiográfica. Las membranas extra y yuxtafoveales también podrían beneficiarse del uso de la TA tras la TFD; en una serie (103) la AV mejoró de 0,35 a 0,5 al cabo de un año con una media de 1,9 tratamientos.
Ruiz Moreno et al han publicado 2 series prospectivas de casos. En una serie de 10 pacientes con NVC y hemorragia submacular plana, la combinación de TFD con la inyección de 20 mg de TAiv condujo a la estabilización o mejoría de AV en 8 ojos tras 6 meses de seguimiento; la sangre se había reabsorbido en todos los casos (104). En una segunda serie de 30 pacientes con NVC secundaria a DMAE, la combinación de TFD y TAiv condujo a una estabilización de la AV frente a un deterioro de ésta en un grupo control de 15 pacientes a los 12 meses de seguimiento (p=0,004), con un cambio medio de AV de –2,2 líneas en el grupo control frente a +0,7 líneas en 15 pacientes no tratados previamente (105). Otras series presentan resultados similares (106,107), con eficacia incluso en el tratamiento de proliferaciones angiomatosas retinianas (108).
Todos esto sugiere que la terapia combinada puede mejorar los resultados de la TFD aislada, ya que en los estudios VIP y TAP de TFD los pacientes experimentaron un cambio medio de AV de –2,2 y –3,1 líneas al año de seguimiento respectivamente, con una media de 3 tratamientos (109,110).
Existen asimismo diversos estudios que apuntan a que la terapia combinada TFD y TAiv también puede resultar eficaz en el tratamiento de NVC en el seno de la retinopatía miópica (111-113). Marticorena et al encontraron que la exudación desaparecía por completo en 10 de 12 ojos con NVC miópica a los 3 meses de tratamiento (112).
La triamcinolona intravítrea ha demostrado también eficacia en el tratamiento del EM de origen diabético, posquirúrgico, inflamatorio y tras obstrucciones vasculares (114-116).
En cuanto a los efectos secundarios de la TAiv son bien conocidos (114,115,117). Se desarrolla un incremento de tensión ocular en un 40% de los pacientes, que habitualmente puede ser controlado con terapia tópica, aunque puede en ocasiones precisar de la realización de cirugía antiglaucomatosa (1-2%) (118). Se acelera el desarrollo de cataratas en un 15-20%, con una mayor incidencia en jóvenes (119). La incidencia de endoftalmitis séptica (1:1000) y aséptica es relativamente baja (118).
OTRAS TERAPIAS
El VEGF Trap (Secuestrador de VEGF) es un receptor de VEGF protéico recombinante soluble en el que los dominios ligadores de los receptores VEGF 1 y 2 están combinados con la porción Fc de la inmunoglobulina G. La porción receptora de la proteína tiene una alta afinidad por todas las isoformas de VEGF-A, así como por otros miembros de la familia VEGF (120). Tanto la administración sistémica como la intravítrea de VEGF Trap suprimió la NVC inducida por láser en ratones (121). En un estudio de pacientes oncológicos en el que los pacientes recibían múltiples inyecciones subcutáneas de VEGF Trap, solamente se indentificaron la hipertensión arterial y la proteinuria como efectos secundarios del fármaco. En base a estos resultados, se puso en marcha un ensayo para determinar la seguridad, farmacocinética y actividad biológica del VEGF Trap administrado de forma intravenosa en pacientes con NVC en el seno de DMAE. Un total de 26 pacientes fueron incluidos y randomizados a recibir distintas dosis de este tratamiento o placebo. Los efectos adversos detectados fueron cefaleas, hipertensión arterial, proteinuria y ronquera. La frecuencia de aparición fue mayor en los pacientes que recibieron 1,0 y 3,0 mg/kg. Debido a la aparición de un caso grave de hipertensión arterial y otro de proteinuria en el grupo de 3,0 mg/kg, se consideró que la dosis máxima tolerada era de 1,0 mg/kg (122).
En cuanto a la eficacia, 8 días tras la infusión inicial, todos los pacientes que recibieron VEGF Trap demostraron un descenso en el grosor foveal medido por OCT, aunque el efecto de 0,3 mg/kg era marginal y se perdía posteriormente. En pacientes tratados con 1,0 mg/kg, el grosor foveal por encima de la media se veía reducido en un 70% a las 2 semanas, aunque este porcentaje descendía al 40% 1 mes tras la inyección. Tras infusiones repetidas, el grosor foveal respondía de nuevo. La infusión de 1 mg/kg también condujo a la reducción del volumen macular, de la exudación por parte de la NVC y a un incremento no significativo de AV (122).
También se está investigando la inhibición de la actividad de los receptores celulares tipo tirosin-kinasa de los distintos factores de crecimiento, incluido el VEGF. Así, estudios in vitro han demostrado un efecto antiangiogénico del bloqueo de receptores tipo tirosín kinasas (123-125). La administración oral de un inhibidor del receptor 2 de VEGF redujo la exudación de NVC inducida experimentalmente en ratones (126), mientras que un inhibidor selectivo de tirosin kinasas redujo la neovascularización retiniana en un modelo animal de retinopatía de la prematuridad (127). Aunque queda un largo camino por recorrer, todo sugiere que la inhibición de los receptores podría ser útil en el tratamiento de la neovascularización coroidea y retiniana.
Por último, se están desarrollando los denominados siRNA (small interfering RNA, pequeños ácidos ribonucléicos interferidores). Se trata de ácidos nucléicos de doble cadena, capaces de ensamblarse intracelularmente con un complejo multiprotéico, el llamado «complejo silenciador inducido por RNA» (RNA induced silencing complex, RISC). Este complejo bloquea la producción protéica del gen objetivo (fig. 5) (128,129). Estudios in vitro han demostrado que el siRNA es capaz de reducir la expresión de VEGF en células del EPR y de disminuir la angiogénesis en modelos de neovascularización inducida por suturas en heridas corneales (85), así como la inhibición de la angiogénesis inducida por herpes o en lesiones de queratitis estromal (130). Estudios en ratones con retinopatía isquémica han demostrado una reducción de la neovascularización retiniana (131,132). En esta línea, los siRNA también han demostrado ser efectivos para bloquear la expresión tanto in vivo como in vitro de TGF-beta (133).

Fig. 5: Mecanismo de acción del siRNA.
De este modo, la tecnología genética abre nuevas perspectivas en el tratamiento de las enfermedades oculares neovasculares (134).
BIBLIOGRAFÍA
Ferrara N, Chen N, Davis-Smyth T, et al. Vascular endothelial growth factor is essential for corpus luteum angiogenesis. Nat Med 1998; 4: 336-340.
Ferrara N. Role of vascular endothelial growth factor in physiologic and pathologic angiogenesis: therapeutic implications. Semin Oncol 2002; 29: 10-14.
Amano S, Rohan R, Kuroki M, Tolentino M, Adamis AP. Requirement for vascular endothelial growth factor in wound- and inflammation-related corneal neovascularization. Invest Opthalmol Vis Sci 1998; 39: 18-22.
Hanahan D, Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis. Cell 1996; 86: 353-364.
Kaiser PK. Antivascular endothelial growth factor agents and their development: therapeutic implications in ocular diseases. Am J Opthalmol 2006; 142: 660.e1-660.e10.
Leung DW, Cachianes G, Kuang WJ, et al. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science 1989; 246: 1306-1309.
Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev 2004; 25: 581-611.
Benjamin LE, Golijanin D, Itin A, et al. Selective ablation of inmature blood vessels in established human tumors follows vascular endothelial growth factor withdrawal. J Clin Invest 1999; 103: 159-165.
Houck KA, Ferrara N, Winer J, et al. The vascular endothelial growth factor family: identification of a fourth molecular species and characterization of alternative splicing of RNA. Mol Endocrinol 1991; 5: 1806-1814.
Keyt BA, Berlau LT, Nguyen HV, et al. The carboxyl-terminal domain (111-165) of vascular endothelial growth factor is critical for its mitogenic potency. J Biol Chem 1996; 271: 7788-7795.
Lee S, Jilani SM, Nikolova GV, et al. Processing of VEGF-A by matrix metalloproteinases regulates bioavailability and vascular patterning in tumors. J Cell Biol 2005; 169: 681-691.
Robinson CJ, Stringer SE. The slice variants of VEGF and their receptors. J Cell Sci 2001; 114: 853-865.
Kliffen M, Sharma HS, Mooy CM, et al. Increased expression of angiogenic growth factors in age-related maculopathy. Br J Opthalmol 1997; 81: 154-162.
Kvanta A, Algvere PV, Berglin L, Seregard S. Subfoveal fibrovascular membranes in age-related macular degeneration express vascular endothelial growth factor. Invest Opthalmol Vis Sci 1996; 37: 1929-1934.
Wells JA, Murthy R, Chibber R, et al. Levels of vascular endothelial growth factor are elevated in the vitreous of patients with subretinal neovascularisation. Br J Opthalmol 1996; 80: 363-366.
Aiello LP, Avery RL, Arrigg PG, et al. Vascular endothelial growth factor in ocular fluid of patients with diabetic retinopathy and other retinal disorders. N Engl J Med 1994; 331: 1480-1487.
Pe'er J, Shweiki D, Itin A, et al. Hypoxia-induced expression of vascular endothelial growth factor by retinal cells is a common factor in neovascularizing ocular diseases. Lab Invest 1995; 72: 638-645.
Adamis AP, Miller JW, Bernai MT, et al. Increased vascular endothelial growth factor levels in the vitreous of eyes with proliferative diabetic retinopathy. Am J Opthalmol 1994; 118: 445-450.
Malecaze F, Clamens S, Simorre-Pinatel V, et al. Detection of vascular endothelial growth factor messenger RNA and vascular endothelial growth factor-like activity in proliferative diabetic retinopathy. Arch Opthalmol 1994; 112: 1476-1482.
Witmer AN, Vrensen GF, Van Noorden CJ, Schlingemann RO. Vacular endothelial growth factors and angiogenesis in eye disease. Prog Retin Eye Res 2003; 22: 1-29.
Matsuoka M, Ogata N, Otsuji T, Nishimura T, Takahashi K, Matsamura M. Expression of pigment epithelium derived factor and vascular endothelial growth factor in choroidal neovascular membranes and polypoidal choroidal vasculopathy. Br J Opthalmol 2004; 88: 809-815.
Duh EJ, Yang HS, Haller JA, et al. Vitreous levels of pigment epithelium-derived factor and vascular endothelial growth factor: implications for ocular angiogenesis. Am J Opthalmol 2004; 137: 668-674.
Kerbel L, Folkman J. Clinical translation of angiogenesis inhibitors. Nat Rev Cancer 2002; 2: 727-739.
Barouch FC, Miller JW. Anti-vascular endothelial growth factor strategies for the treatment of choroidal neovascularization from age-related macular degeneration. Int Opthalmol Clin 2004; 44: 23-32.
Waheed NK, Miller JW. Aptamers, intramers and vascular endothelial growth factor. Int Opthalmol Clin 2004; 44: 11-22.
Ruckman J GLBJWSGWHDC-WLJN. 2'-fluoropyrimidine RNA-based aptamers to the 165-amino acid form of VEGF. Inhibition of receptor binding and VEGF-induced vascular permeability through interactions requiring the exon 7-encoded domain. J Biol Chem 1998; 273: 20556-20567.
Schachat AP. New treatments of age-related macular degeneration. Ophthalmology 2005; 112: 531-532.
Eyetech Study Group. Preclinical and phase IA clinical evaluation of an anti-VEGF pegylated aptamer (EYE001) for the treatment of exudative age-related macular degeneration. Retina 2002; 22: 143-152.
Eyetech Study Group. Antivascular endothelial growth factor therapy for subfoveal choroidal neovascularization secondary to age-related macular degeneration: phase II study results. Ophthalmology 2003; 110: 979-986.
Gragoudas ES, Adamis AP, Cunningham Jr ET, Feinsod M, Guyer DR. Pegabtanib for neovascular age-related macular degeneration. N Engl J Med 2004; 351: 2805-2816.
The VEGF inhibition study in ocular neovascularization (V.I.S.I.O.N.) clinical trial group. Year 2 efficacy results of 2 randomized controlled clinical trials of pegabtanib for neovascular age-related macular degeneration. Ophthalmology 2006; 113: 1508-1521.
Macular Photocoagulation Study Group. Visual outcome after laser photocoagulation for subfoveal choroidal neovascularisation secondary to age-related macular degeneration. The influence of lesion size and initial visual acuity. Arch Opthalmol 1994; 112: 480-488.
Ambati J, Ambati BK, Yoo SH, Inachulev S, Adamis AP. Age-related macular degeneration: etiology, pathogenesis and therapeutic strategies. Surv Opthalmol 2003; 48: 257-293.
The VEGF inhibition study in ocular neovascularization (V.I.S.I.O.N.) clinical trial group. Enhanced efficacy associated with early treatment of neovascular age-related macular degeneration with pegabtanib sodium: an exploratory analysis. Retina 2005; 25: 815-827.
The VEGF inhibition study in ocular neovascularization (V.I.S.I.O.N.) clinical trial group. Pegabtanib sodium for neovascular age-related macular degeneration. Two-year safety results of the two prospective, multicenter, controlled clinical trials. Ophthalmology 2006; 113: 992-1001.
Hariprasad SM, Shah GK, Blinder KJ. Short-term intraocular pressure trends following intravitreal pegabtanib (Macugen) injection. Am J Opthalmol 2006; 141: 200-201.
Dhalla MS, Blinder KJ, Tewari A, Hariprasad SM, Apte RS. Retinal pigment epithelial tear following intravitreal pegabtanib sodium. Am J Opthalmol 2006; 141: 752-754.
Singh RP, Sears JE. Retinal pigment epithelial tears after pegabtanib injection for exudative age-related macular degeneration. Am J Opthalmol 2006; 142: 160-162.
Macugen Diabetic Retinopathy Study Group. A phase II randomized double-masked trial of pegabtanib, an anti-vascular endothelial growth factor aptamer, for diabetic macular edema. Ophthalmology 2005; 112: 1747-1757.
Macugen Diabetic Retinopathy Study Group. Changes in retinal neovascularization after pegabtanib (Macugen) therapy in diabetic individuals. Ophthalmology 2006; 113: 23-28.
Krzystolik M, Filippopoulos T, Ducharme JF, Loewenstein JI. Pegabtanib as an adjunctive treatment for complicated neovascular diabetic retinopathy. Arch Opthalmol 2006; 124: 920-921.
Zhou B, Wang B. Pegabtanib for the treatment of age-related macular degeneration. Exp Eye Res 2006; 83: 615-619.
Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006; 355: 1419-1431.
Rosenfeld PJ, Rich RM, Lalwani GA. Ranibizumab: Phase III clinical trial results. Ophtalmol Clin North Am 2006; 19: 361-372.
Brown DM, Kaiser PK, Michels S, et al. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med 2006; 355: 1431-1444.
Rosenfeld PJ, Heier JS, Hantsbarger G, Shams N. Tolerability and efficacy of multiple esaclating doses of ranibizumab (Lucentis) for neovascular age-related macular degeneration. Ophthalmology 2006; 113: 623-632.
Heier JS, Antoszyk A, Pavan PR, et al. Ranibizumab for treatment of neovascular age-related macular degeneration. A phase I/II multicenter, controlled, multidose study. Ophthalmology 2006; 113: 633-642.
Chun DW, Heier JS, Topping TM, et al. A pilot study of multiple intravitreal injections of ranibizumab in patients with center-involving clinically significant diabetic macular edema. Ophthalmology 2006; 113: 1706-1712.
Nguyen QD, Tatlipinar S, Shah SM, et al. Vascular endotelial growth factor is a critical stimulus for diabetic macular edema. Am J Opthalmol 2006.
Spaide RF, Laud K, Fine HF, et al. Intravitreal bevacizumab treatment of choroidal neovascularization secondary to age-related macular degeneration. Retina 2006; 26: 383-390.
Rich RM, Rosenfeld PJ, Puliafito CA, et al. Short-term safety and efficacy of intravitreal bevacizumab (Avastin) for neovascular age-related macular degeneration. Retina 2006; 26: 495-511.
Yamamoto I, Rogers AH, Reichel E, et al. Intravitreal bevacizumab (Avastin) as treatment for subfoveal choroidal neovascularization secondary to pathological myopia. Br J Opthalmol 2006; 26.
Sakaguchi H, Ikuno Y, Gomi F, et al. Intravitreal injection of bevacizumab for choroidal neovascularization caused by pathological myopia. Br J Opthalmol 2006; 16.
Avery RL, Pearlman J, Pieramici DJ, et al. Intravitreal bevacizumab (Avastin) in the treatment of proliferative diabetic retinopathy. Ophthalmology 2006; 113: 1695.e1-1695.e15.
Abrahám-Marin ML, Cortés-Luna CF, Álvarez-Rivera G, et al. Intravitreal bevacizumab therapy for neovascular age-related macular degeneration: a pilot study. Graefe's Arch Clin Exp Opthalmol 2006.
Iturralde D, Spaide RF, Meyerle CB, et al. Intravitreal bevacizumab (Avastin) treatment of macular edema in central retinal vein occlusion. Retina 2006; 26: 279-284.
Spaide RF, Fisher YL. Intravitrealbevacizumab (Avastin) treatment of proliferative diabetic retinopathy complicated by vitreous hemorrhage. Retina 2006; 26: 275-278.
Pieramici DJ, Avery RL, Castellarin AA, et al. Case of anterior uveitis after intravitreal injection of bevacizumab. Retina 2006; 26: 841-842.
Luthra S, Narayanan R, Marques LEA, et al. Evaluation of in vitro effects of bevacizumab (Avastin) on retinal pigment epithelial, neurosensory retinal, and microvascular endothelial cells. Retina 2006; 26: 512-518.
Spandau UH, Ihloff AK, Jonas JB. Intravitreal bevacizumab treatment of macular oedema due to central retinal vein occlusion. Acta Opthalmol Scand 2006.
Soliman W, Lund-Andersen H, Larsen M. Resolution of subretinal haemorrhage and fluid after intravitreal bevacizumab in aggressive peripapillary subretinal neovascularization. Acta Opthalmol Scand 2006; 84: 707-708.
Aggio FB, Farah ME, Melo GB. Intravitreal bevacizumab for occult choroidal neovascularization with pigment epithelium detachment in age-related macular degeneration. Acta Opthalmol Scand 2006.
Friedlander SM, Welch RM. Vanishing disc neovascularization following intravitreal bevacizumab (Avastin) injection. Arch Opthalmol 2006; 124: 1365.
Mason JO, Nixon PA, White MF. Intravitreal injection of bevacizumab (Avastin) as adjuntive treatment of proliferative diabetic retinopathy. Am J Opthalmol 2006; 142: 685-688.
Chen E, Park CH. Use of intravitreal bevacizumab as a preoperative adjunt for tractional retinal detachment repair in severe proliferative diabetic retinopathy. Retina 2006; 26: 699-700.
Mason JO, Albert MA, Mays A, Vail R. Regression of neovascular iris vessels by intravitreal injection of bevacizumab. Retina 2006; 26: 839-841.
Oshima Y, Sakaguchi H, Gomi F, Tano Y. Regression of iris neovascularization after intravitreal injection of bevacizumab in patients with proliferative diabetic retinopathy. Am J Opthalmol 2006; 142: 155-157.
The Anecortave Acetate Clinical Study Group. Anecortave acetate as monotherapy for treatment of subfoveal neovascularization in age-related macular degeneration. Ophthalmology 2003; 110: 2372-2385.
Slakter JS, Bochow T, D´Amico DJ, et al. Anecortave acetate (15 milligrams) versus photodynamic therapy for treatment of subfoveal neovascularization in age-related macular degeneration. Ophthalmology 2006; 113: 3-13.
Klais CM, Eandi CM, Ober MD, et al. Anecortave acetate treatment for retinal angiomatous proliferation. Retina 2006; 26: 773-779.
The Anecortave Acetate Clinical Study Group. Anecortave acetate as monotherapy for the treatment of subfoveal lesions in patients with exudative age-related macular degeneration (AMD). Retina 2003; 23: 14-23.
Eandi CM, Ober MD, Freund KB, et al. Anecortave acetate for the treatment of idiopathic perifoveal telangiectasia. Retina 2006; 26: 780-785.
Augustin AJ, D´Amico DJ, Mieler WF, et al. Safety of posterior juxtascleral depot administration of the angiostatic cortisene anecortave acetate for treatment of subfoveal choroidal neovascularization in patients with age-related macular degeneration. Graefe's Arch Clin Exp Opthalmol 2005; 243: 9-12.
BenEzra D, Griffin BW, Maftzir G, et al. Topical formulations of novel angiostatic steroids inhibit rabbit corneal neovascularization. Invest Opthalmol Vis Sci 1997; 38: 1954-1962.
Clark AF, Mellon J, Li XY, et al. Inhibition of intraocular tumor growth by topical application of the angiostatic steroid anecortave acetate. Invest Opthalmol Vis Sci 1999; 40: 2158-2162.
Penn JS, Rajaratnam VS, Collier RJ, Clark AF. The effect of an angiostactic steroid on neovascularization in a rat model of retinopathy of prematurity. Invest Opthalmol Vis Sci 2001; 42: 283-290.
Tano Y, Chandler D, Machemer R. Treatment of intracoular proliferation with intravitreal injection of triamcinolone acetonide. Am J Opthalmol 1980; 90: 810-816.
Penfold PL, Wen L, Madigan MC, et al. Triamcinolone modulates permeability and intercellular adhesion molecule 1 (ICAM-1) expression of the ECV304 cell line: implications for molecular degeneration. Clin Exp Inmunol 2000; 121: 458-465.
Brooks HL Jr, Caballero S Jr, Newell CK, et al. Vitreous levels of vascular endothelial growth factor and stromal-derived factor 1 in patients with diabetic retinopathy and cystoid macular edema before and after intraocular injection of triamcinolone. Arch Opthalmol 2004; 122: 1801-1807.
Wang YS, Friedrichs U, Eichler W, et al. Inhibitory effects of triamcinolone acetonide on bFGF-induced migration and tube formation in choroidal microvascular endothelial cells. Graefe's Arch Clin Exp Opthalmol 2002; 240: 42-48.
Tano Y, Sugita G, Abrams G, Machemer R. Inhibition of intraocular proliferation with intravitreal corticosteroids. Am J Opthalmol 1980; 89: 131-136.
Chandler DB, Rozakis G, de Juan E, Machemer R. The effect of triamcinolone acetonide on a refined experimental model of proliferative vitreoretinopathy. Am J Opthalmol 1985; 99: 686-690.
Ishibashi T, Miki T, Sorgente N, et al. Effects of intravitreal administration of steroids on experimental subretinal neovascularization in the subhuman primate. Arch Opthalmol 1985; 103: 708-711.
Antoszyk A, Gottlieb JL, Machemer R, Hatchell DL. The effects of intravitreal triamcinolone acetonide on experimental pre-retinal neovascularization. Graefe's Arch Clin Exp Opthalmol 1993; 231: 34-40.
Murata M, Shimizu S, Horiuchi S, Taira M. Inhibitory effect of triamcinolone acetonide on corneal neovascularization. Graefe's Arch Clin Exp Opthalmol 2006; 244: 205-209.
Wilson CA, Berkowitz BA, Sato Y, et al. Treatment with intravitreal steroid reduces blood-retinal barrier breakdown due to photocoagulation. Arch Opthalmol 1992; 110: 1155-1159.
Sakamoto T, Miyazaki M, Hisatomi T, et al. Triamcinolone-assisted pars plana vitrectomy improves surgical procedures and decreases the postoperative blood-ocular barrier breakdown. Graefe's Arch Clin Exp Opthalmol 2002; 240: 423-429.
Karacorlu M, Ozdemir H, Karacorlu S, Alacali N. Regression of optic nerve head neovascularization in proliferative diabetic retinopathy after intravitreal triamcinolone. Regression of diabetic neovascularization after intravitreal triamcinolone. Int Opthalmol 2004; 25: 113-116.
Kijlstra A, La Heij E, Hendrikse F. Immunological factors in the pathogenesis and treatment of age-related macular degeneration. Ocul Immunol Inflamm 2005; 13: 3-11.
Gillies MC, Simpson JM, Luo W, et al. A randomized clinical trial of a single dose of triamcinolone acetonide for neovascular age-related macular degeneration. Arch Opthalmol 2003; 121: 667-673.
Jonas JB, Akkoyun I, Budde WM, et al. Intravitreal re-injection of triamcinolone for exudative age-related macular degeneration. Arch Opthalmol 2004; 122: 218-222.
Jonas JB, Spandau UH, Harder B, et al. Inter-eye difference in exudative age-related macular degeneration with minimally classic or occult subfoveal neovascularization after unilateral intravitreal injection of triamcinolone acetonide. Am J Opthalmol 2005; 139: 1073-1079.
Danis RP, Ciulla TA, Pratt LM, Anliker W. Intravitreal triamciniolone in exudative age-related macular degeneration. Retina 2000; 20: 244-250.
Ito M, Okubo A, Sonada Y, Yamakiri K, Sakamoto T. Intravitreal triamcinolone acetonide for exudative age-related macular degeneration among Japanese patients. Ophthalmologica 2006; 220: 118-124.
Jonas JB, Spandau UH, Kamppeter BA, Harder B. Follow-up after intravitreal triamcinolone acetonide for exudative age-related macular degeneration. Eye 2006.
Jonas JB, Spandau UH, Kamppeter BA, et al. Duration of the effect of intravitreal triamcinolone acetonide in eyes with exudative age-related macular degeneration. J Ocul Pharmacol Ther 2006; 22: 194-199.
Jonas JB, Degenring RF, Kreissig I, et al. Exudative age-related macular degeneration treated by intravitreal triamcinolone acetonide: a prospective, comparative nonrandomized study. Eye 2005; 19: 163-170.
Schmidt-Erfurth U, Schlotzer-Schrehard U, Cursiefen C, et al. Influence of photodynamic therapy on expression of vascular endothelial growth factor (VEGF), VEGF receptor 3 and pigment epitheluim derived growth factor. Invest Opthalmol Vis Sci 2003; 44: 4473-4480.
Schmidt-Erfurth U, Michels S, Barbazetto I, Laqua H. Photodynamic effects on choroidal neovascularization and physiological choroids. Invest Opthalmol Vis Sci 2002; 43: 830-841.
Matsuda S, Gomi F, Oshima Y, Tohyama M, Tano Y. Vascular endothelial growth factor reduced and connective tissue growth factor induced by triamcinolone in ARPE19 cells under oxidative stress. Invest Opthalmol Vis Sci 2005; 46: 1062-1068.
Spaide RF, Sorenson J, Maranan L. Photodymanic therapy with verteporfin combined with intravitreal injection of triamcinolone acetonide for choroidal neovascularization. Ophthalmology 2005; 112: 301-304.
Augustin AJ, Schmidt-Erfurth U. Verteporfin therapy combined with intravitreal triamcinolone in all types of choroidal neovascularization due to age-related macular degeneration. Ophthalmology 2006; 113: 14-22.
Spaide RF, Sorenson J, Maranan L. Combined photodynamic therapy and intravitreal triamcinolone for nonsubfoveal choroidal neovascularization. Retina 2005; 25: 685-690.
Ruiz-Moreno JM, Montero JA, Barile S. Triamcinolone and PDT to treat exudative age-related macular degeneration and submacular hemorrhage. Eur J Ophthalmol 2006; 16: 426-434.
Ruiz-Moreno JM, Montero JA, Barile S, Zarbin MA. Photodynamic therapy and high-dose intravitreal triamcinolone to treat exudative age-related macular degeneration. Retina 2006; 26: 602-612.
Nicolo M, Ghiglione D, Lai S, Nasciuti F, Cicinelli S, Calabria G. Occult with no classic choroidal neovascularization secondary to age-related macular degeneration treated by intravitreal triamcinolone and photodynamic therapy with verteporfin. Retina 2006; 26: 58-64.
Nicolo M, Ghiglione D, Lai S, Calabria G. Intravitreal triamcinolone in the treatment of serous pigment epithelial detachment and occult choroidal neovascuarization secondary to age-related macular degeneration. Eur J Ophthalmol 2005; 15: 415-419.
Freund KB, Klais CM, Eandi CM, et al. Sequenced combined intravitreal triamcinolone and indocyanine green angiography guided photodynamic therapy for retinal angiomatous proliferation. Arch Opthalmol 2006; 124: 487-492.
Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: one year results of 2 randomized clinical trials-TAP report 1. Arch Opthalmol 1999; 117: 1329-1345.
Verteporfin in Photodynamic Therapy Study Group. Verteporfin therapy of subfoveal choroidal neovascularization in age-related macular degeneration: two year results of a randomizaed clinical trial including lesions with occult with no classic choroidal neovascularization- Verteporfin in Photodynamic Therapy Report 2. Am J Opthalmol 2001; 131: 541-560.
Degenring RF, Jonas JB. Photodynamic therapy in combination with intravitreal triamcinolone for myopic choroidal neovascularization. Acta Opthalmol Scand 2005; 83: 621.
Marticorena J, Gomez-Ulla F, Fernandez M, Pazos B, Rodriguez-Cid, MJ, Sánchez-Salorio M. Combined photodynamic therapy and intravitreal triamcinolone acetonide for the treatment of myopic subfoveal choroidal neovascularization. Am J Opthalmol 2006; 142: 335-337.
Potter MJ, Szabo SM, Ho T. Combined photodynamic therapy and intravitreal triamcinolone for the treatment of myopic choroidal neovascularization in a 13-year-old girl. Graefe's Arch Clin Exp Opthalmol 2006; 244: 639-641.
Jonas JB. Intravitreal triamcinolone acetonide for treatment of intraocular oedematous and neovascular diseases. Acta Opthalmol Scand 2005; 83: 645-663.
Jonas JB, Kreissig I, Degenring RF. Intravitreal triamcinolone acetonide for treatment of intraocular proliferative, exudative and neovascular diseases. Prog Retin Eye Res 2005; 24: 587-611.
Conti SM, Kertes PJ. The use of intravitreal corticosteroids, evidence-based and otherwise. Curr Opin Opthalmol 2006; 17: 235-244.
Gillies MC, Simpson JM, Billson FA, et al. Safety of an intravitreal injection of triamcinolone: results from a randomized clinical trial. Arch Opthalmol 2004; 122: 336-340.
Jonas JB. Intravitreal triamcinolone acetonide: a change in a paradigm. Ophtalmic Res 2006; 38: 218-245.
Suárez-Figueroa M, Contreras I, Noval S. Efectos secundarios de la triamcinolona en pacientes jóvenes. Arch Soc Esp Oftalmol 2006; 81: 405-408.
Holash J, Davis S, Papadoupoulos N, et al. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proc Natl Acad Sci U S A 2002; 99: 11393-11398.
Saishin Y, Saishin Y, Takahashi K, et al. VEGF-TRAP R1R2 suppresses choroidal neovascularization and VEGF-induced breakdown of the blood-retinal barrier. J Cell Physiol 2003; 195: 241-248.
Nguyen QD, Shah SM, Hafiz G, et al. A phase I trial of an iv-administered vascular endothelial growth factor trap for treatment in patients with choroidal neovascularization due to age-related macular degeneration. Ophthalmology 2006; 113: 1522-1532.
Chen J, Hicks D, Brantley-Sieders D, et al. Inhibition of retinal neovascularization by soluble EphA2 receptor. Exp Eye Res 2006; 82: 664-673.
Unsoeld AS, Junker B, Mazitschek R, et al. Local injection of receptor tyrosine kinase inhibitor MAE 87 reduces retinal neovascularization in mice. Mol Vis 2004; 10: 468-475.
Watanabe D, Takagi H, Suzuma K, et al. Transcription factor Ets-1 mediates ischemia- and vascular endothelial growth factor-dependent retinal neovascularization. Am J Pathol 2004; 164: 1827-1835.
Takahashi H, Obata R, Tamaki Y. A novel vascular endothelial growth factor receptor 2 inhibitor, SU11248, suppresses choroidal neovascularization in vivo. J Ocul Pharmacol Ther 2006; 22: 213-218.
McCollum GW, Rajaratnam VS, Bullard LE, et al. Herbimycin A inhibits angiogenic activity in endothelial cells and reduces neovascularization in a rat model retinopathy of prematurity. Exp Eye Res 2004; 78: 987-995.
Tolentino M. Interference RNA tecnology in the treatment of CNV. Ophthalmol Clin North Am 2006; 19: 393-399.
Schiffelers RM, Mixson AJ, Ansari AM, et al. Transporting silence: design of carriers for siRNA to angiogenic endothelium. J Control Release 2005; 109: 5-14.
Kim B, Tang Q, Biswas PS, et al. Inhibition of ocular angiogenesis by siRNA targeting vascular endothelial growth factor pathway genes: therapeutic strategy for herpetic stromal keratitis. Am J Pathol 2004; 164: 2177-2185.
Shen J, Samul R, Silva RL, et al. Suppression of ocular neovascularization with siRNA targeting VEGF receptor 1. Gene Ther 2006; 13: 225-234.
Reich SJ, Fosnot J, Kuroki A, et al. Small interfering RNA (siRNA) targeting VEGF effectively inhibits ocular neovascularization in a mouse model. Mol Vis 2003; 9: 210-216.
Nakamura H, Siddiqui SS, Shen X, et al. RNA interference targeting transforming growth factor-beta type II receptor supresses ocular inflamation and fibrosis. Mol Vis 2006; 10: 703-711.
Campochiaro PA. Potencial applications for RNAsi to probe pathogenesis and develop new treatments for ocular disorders. Gene Ther 2006; 13: 559-562.