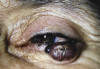
Fig. 1: Carcinoma basocelular tipo nodular.
REVISIÓN ACTUALIZADA
ZARAGOZA CASARES P1, LLANES MENÉNDEZ F2, GÓMEZ FERNÁNDEZ T3
, ZATO GÓMEZ DE LIAÑO MA4, ZARAGOZA GARCÍA P51
Doctor en Medicina. Médico oftalmólogo. Instituto de Ciencias Visuales INCIVI.RESUMEN
El carcinoma basocelular es el tumor maligno más frecuente del párpado (entre el 80 y 90% de todas las neoplasias epiteliales malignas de los párpados). El 45% tiene localización palpebral inferior, el 38% superior y el 17% interna.
En esta revisión recogemos los aspectos más relevantes de esta patología con la finalidad de mejorar nuestro conocimiento sobre ella.
INTRODUCCIÓN
Aproximadamente el 70% de todas las enfermedades malignas de la piel son carcinomas basocelulares. Éstos, exceden a los carcinomas escamosos en frecuencia con un porcentaje de aproximadamente 5:1 aunque este porcentaje varia de 3:1 y de 7:1 en diferentes latitudes (1).
ASPECTOS CLÍNICOS
Clínicamente la mayoría de los carcinomas basocelulares de los párpados son de tres tipos: nodular (fig. 1), ulcerativo y esclerosante (forma morfea).

Fig. 1: Carcinoma basocelular tipo nodular.
La forma nodular se presenta clínicamente como un nódulo perlado firme con pequeños vasos telangiectásicos en su superficie. A menudo como el nódulo aumenta de tamaño despacio, sufre una ulceración central convirtiéndose en un carcinoma de tipo ulcerativo (fig. 2).
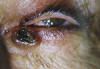
Fig. 2: Carcinoma basocelular tipo ulcerativo.
El de tipo morfeo o esclerosante aparece como pálido, bien definido, indurado en placa. Es el tipo más agresivo de carcinoma basocelular, típicamente tiene extensiones cutáneas que no son clínicamente visibles.
Dependiendo del patrón de crecimiento, los carcinomas basocelulares se clasifican anatomopatológicamente como: multicéntricos, nodulares, ulcerativos, infiltrativos y mixtos. Estos tipos pueden ser subclasificados en sólido (fig. 3), adenoide y metatípico.
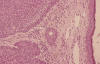
Fig. 3: Carcinoma basocelular sólido en el que es patente la
disposición celular periférica en empalizadas (HE x 144).
Los carcinomas basocelulares se localizan predominantemente en áreas de la piel expuestas al sol, particularmente en individuos de tez blanca. Raramente ocurren en individuos de raza negra.
Más del 80% de todas las lesiones aparecen en la cabeza y cuello (2) mientras que aproximadamente un 15% se desarrollan en hombros, espalda y pecho (3).
Los carcinomas basocelulares son más comunes en varones, presumiblemente en relación con la exposición ocupacional y recreacional a la luz ultravioleta. Tienden a ocurrir en personas mayores, aunque también han sido documentados en niños (4) y jóvenes adultos (5). En niños existe frecuentemente una asociación clínica con el síndrome névico basocelular de Gorlin, síndrome de Bazex, xeroderma pigmentoso o un nevus verrugoso (4).
La presentación clínica de un carcinoma basocelular puede ser bastante variable, puede ser una lesión papulonodular con un borde perlado translúcido, una lesión destructiva ulcerada (ulcera rodens), una placa pálida con induración variable, una placa eritematosa con telangiectasias variables, o un nódulo quístico.
Aproximadamente entre 2-5% de las lesiones son pigmentadas; los carcinomas basocelulares en personas de raza negra y en japoneses son frecuentemente pigmentados (6,7).
Las metástasis son muy raras, ocurren en aproximadamente el 0,005% de las lesiones (8,9). Esta baja incidencia está relacionada probablemente con la dependencia estromal de los carcinomas basocelulares, lo cual presupone que solo un émbolo tumoral grande con adhesión al estroma tendría éxito en la implantación (10).
El 5% de los carcinomas basocelulares recidivan a los 5 años, aunque esto varía con el tipo de tratamiento (11). La cifra aumenta hasta el 9% cuando el seguimiento se realiza a largo plazo (12).
Las recidivas son más comunes en lesiones en el apéndice nasal y pliegues labiales, pero esto puede ser en parte debido a la dificultad en lograr adecuados márgenes quirúrgicos en estos sitios (13,14). Los tipos Infiltrativo, Micronodular y Multifocal de carcinomas basocelulares tienen más propensión a la recurrencia que los tipos nodulares (15,13). Las variantes metatípicas y esclerosantes pueden también estar asociadas con comportamientos más agresivos.
ETIOLOGÍA
Aunque el factor primordial etiológico en el desarrollo del carcinoma basocelular es la exposición a la luz ultravioleta, particularmente a las longitudes de onda UV-B, los estudios de dosimetría solar demuestran una correlación pobre entre la densidad tumoral y la dosis ultravioleta (16). Efectivamente la susceptibilidad a UV-B induce la inhibición de la hipersensibilidad de contacto que parece ser un indicador mejor del riesgo cancerígeno que la acumulación a la exposición solar (17).
La radiación UV-B produce daño al ADN y mutación en los «hot spots» del gen supresor tumoral p53. Aproximadamente el 50% de todos los carcinomas basocelulares estudiados presentan mutaciones en este gen (18,19).
ASPECTOS GENÉTICOS
Existe una cierta evidencia de que factores genéticos juegan un papel importante en la susceptibilidad de algunos individuos al carcinoma basocelular (20). Mutaciones en el gen PATCHED (ptc, PTCH), el cual es conocido por ser el responsable del síndrome névico basocelular, han sido documentados en casos esporádicos de carcinomas basocelulares.
Hay también una asociación con HLA-DR7 y HLA-DR4 en algunas poblaciones (21).
HISTOPATOLOGÍA
Varios subtipos morfológicos han sido definidos. Estos incluyen sólido (nodular), micronodular, quístico, superficial multifocal, pigmentado, adenoide, infiltrante, esclerosante, queratótico, infundibuloquístico (fig. 4), basocelular compuesto, basoescamoso y fibroepiteliomatoso (22).
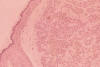
Fig. 4: Carcinoma basocelular infundibuloquístico, obsérvese
su crecimiento periférico circunscrito (HE x 144).
SÍNDROME NÉVICO BASOCELULAR DE GORLING
El síndrome névico basocelular es un desorden multisistémico caracterizado por carcinomas basocelulares múltiples con una edad temprana de aparición. Queratoquistes odontogénicos, depresiones cutáneas en las palmas de las manos y las plantas de los pies, quistes cutáneos, anomalías esqueléticas, neurológicas y calcificaciones ectópicas. A menudo hay unas facies características con hipertelorismo y una calvicie precoz. Manifestaciones menos comunes incluyen lipomas y fibromas de varios órganos, rabdiomiosarcoma fetal, meduloblastomas y quistes ováricos.
El gen responsable el gen PATCHED (ptc) está en el cromosoma 9q 22.3-q31 (23). Múltiples carcinomas basocelulares pueden ocurrir en familias sin otras manifestaciones de síndromes sistémicos. Estudios genéticos han proyectado el defecto en el cromosoma 9q22.3 flanqueando el gen ptc (24).
A nivel histopatológico el espectro total de variantes histológicas del carcinoma basocelular se encuentra en el síndrome névico basocelular (25).
EPIDEMIOLOGÍA
La incidencia del carcinoma basocelular de párpado aumenta con la edad, presentando la mayoría de los pacientes afectados entre los 60 y 70 años, siendo raro antes de los 40 años y más allá de los 80 años; en los niños y jóvenes adultos es extremadamente raro. Una aproximación a la distribución por edades es la siguiente: antes de los 40 años 5,5%, 41 a 50 años 15%, 51 a 60 años 25%, 71 a 80 años 20%, más de 80 años 4,5% (26).
Los factores de riesgo para el desarrollo de un carcinoma basocelular en la región palpebral incluyen:
Exposición prolongada al sol.
Raza blanca.
Piel poco pigmentada, con imposibilidad de ponerse moreno y con pecas, así como ojos y pelo claro.
Edad avanzada.
Hombre.
Exposición a radiación ionizante y contaminantes ambientales.
Predisposición genética, como defectos de la replicación o reparación del ADN.
Pacientes inmunocomprometidos.
DIAGNÓSTICO
Una primera aproximación diagnóstica la obtenemos por el aspecto macroscópico de la lesión, así como por su lenta evolución. El diagnostico diferencial debe incluir:
Nevus pigmentados y no pigmentados.
Melanoma.
Papiloma.
Queratosis seborreica.
Queratoacantoma. Se caracteriza por ser una lesión papilar pequeña, umbilicada, con queratinización en su centro, que crece rápidamente en 4 u 8 semanas hasta su máximo tamaño de 1 ó 2 cm.
Chalazión.
Carcinoma de glándulas sebáceas.
Carcinoma de células escamosas.
Diagnóstico por imagen
El diagnóstico por imagen TC y RMN es necesario en todas las lesiones ante la sospecha de invasión orbitaria, para descubrir si existen lesiones óseas (erosión y destrucción).
La tomografía axial computarizada y la resonancia magnética nuclear nos informan sobre los límites de la neoplasia y la extensión retroocular. Es frecuente que la tumoración se límite a envolver el ojo o que se extienda irregularmente como una masa relativamente homogénea hacia el vértice de la órbita sin destruir el hueso. La RMN muestra áreas tumorales que no pueden visualizarse con otros medios diagnósticos. Estas áreas suelen infiltrar las paredes orbitarias e incluso extenderse al etmoides, fosa nasal y cavidad intracraneal. La información con TC es imprescindible en el preoperatorio con el fin de planificar la intervención y los límites quirúrgicos.
Para obtener un diagnóstico definitivo del carcinoma basocelular de párpado, se requiere confirmación histológica, que obtendremos tras la biopsia o extirpación tumoral, de modo que toda lesión sospechosa de ser un carcinoma basocelular debería ser biopsiada, pero si la lesión tiene un tamaño que no precise reconstrucción palpebral, podemos extirparla directamente.
TRATAMIENTO
Varios son los aspectos a tener en cuenta en la extirpación quirúrgica de un carcinoma basocelular de párpado:
Extirpación amplia que asegure una total eliminación del tumor.
Preservar en lo posible los delicados tejidos perioculares.
No dañar el sistema lagrimal.
Prevenir la infiltración de estructuras profundas en la órbita.
Resultados estéticos aceptables.
Conservar la funcionalidad del sistema palpebral, definitivo en la prevención de complicaciones sobre la superficie ocular.
Detección temprana de las recidivas tumorales.
Los resultados en cuanto a recurrencia de la extirpación quirúrgica del tumor difieren según las series publicadas. Parece clara la menor recurrencia en los casos en los que los bordes de la lesión extirpada están libres de tumor. Cuando tras la extirpación de la lesión los márgenes están infiltrados las recurrencias son relativamente frecuentes, aunque aquí los autores difieren en sus resultados, desde un 10-40% (27,28).
La extirpación quirúrgica con la técnica de Mohs es una técnica que consiste en el control microscópico intraquirúrgico de los límites de resección, con lo que en la mayoría de las lesiones el carcinoma se extirpa con los bordes de resección libres, y esto supone una menor tasa de recidiva tumoral. Esta técnica podría estar indicada en los siguientes casos:
Tumores cuya localización suponga una mayor recurrencia con técnicas quirúrgicas convencionales, por ejemplo en canto interno.
Tumores con bordes clínicamente poco definidos.
Tumores mayores de 2 centímetros.
Tumores de tipo histológico esclerodermiforme, en los que las recurrencias son más habituales.
Tumores localizados en áreas en las que es especialmente necesario preservar el tejido.
Técnicas generales de reconstrucción palpebral
Un párpado reconstruido suele requerir como mínimo dos elementos principales: una capa externa de piel y una capa interna de mucosa. Además, es de gran importancia la construcción de un borde palpebral estable, que pueda prevenir de modo permanente cualquier tendencia a la inversión o la eversión.
La reconstrucción palpebral fundamentalmente se realiza mediante el uso de colgajos o injertos.
Defectos de espesor parcial
Si el defecto no afecta al espesor total del párpado. Podemos utilizar:
Cierre directo.
Injerto de piel (palpebral, retroauricular, preauricular, etc.).
Colgajos. Aportan mayor viabilidad por poseer aporte vascular propio. Ideales para reconstruir la hoja anterior palpebral. Tipos de colgajos: Deslizante, De avance, De traslación y de Rotación.
Defectos del párpado inferior
Defectos de hasta el 25-30% de la longitud palpebral horizontal. Cierre directo.
Defectos entre el 30% hasta el 60% de la longitud palpebral horizontal. Cierre directo con cantolisis. Si a pesar de la cantolisis sigue existiendo tensión excesiva a lo largo de la longitud horizontal procederemos a utilizar además de lo descrito un colgajo semicircular rotatorio (colgajo de Tenzel).
Defectos de más del 60% de la longitud palpebral horizontal:
Colgajo tarso-conjuntival puente desde el párpado superior (Técnica de Hughes).
Colgajo de avance semi-rotacional de la mejilla sobre un injerto cóndro-mucoso o tarso-conjuntival (Técnica de Mustardé).
Colgajo de torsión (Técnica de Fricke) debe limitarse a los casos en los que por alguna circunstancia no pueda realizarse la técnica de Mustardé (irradiación de la mejilla, situación del paciente que desaconseje una anestesia prolongada, etc.), ya que la piel frontal difiere en grosor, textura y color de la piel del párpado; la ventaja es que es un procedimiento rápido, relativamente atraumático, y puede ser realizado bajo anestesia local si es necesario.
Defectos del párpado superior
— Defectos de hasta el 25-30% del tamaño total del párpado superior. Cierre directo.
— Defectos de entre el 30% hasta el 60% del tamaño total del párpado superior. Cierre directo con cantolisis (tendón cantal lateral). Alternativamente podemos utilizar:
Injerto tarsoconjuntival libre tomado del párpado superior contralateral y cubierto por un injerto de piel de espesor completo.
— Defectos marginales. Colgajo pediculado del margen del párpado inferior. Se utiliza un cuarto del párpado inferior para reconstruir el superior; este colgajo se basa en la utilización de la arteria marginal.
— Defectos de más del 60% del tamaño total del párpado superior:
Colgajo de avance del párpado inferior; aporta piel, músculo y conjuntiva del párpado inferior (Técnica de Cutler-Beard).
Injertos compuestos. Se obtiene una porción de 6 mm del párpado superior contralateral al cual se le retira la piel y el músculo orbicular dejando el tarso, la conjuntiva y el margen palpebral; el injerto compuesto tarsoconjuntival reconstruye la lámina posterior y el colgajo miocutáneo se transforma en la lámina anterior del nuevo párpado.
Reconstrucción del canto externo
Defectos pequeños. Cierre Directo.
Reconstrucción área cantal. Colgajo de rotación de mejilla o colgajo romboide.
Defecto que compromete canto externo, y párpado superior e inferior. Colgajo de Fricke (frontal).
Reconstrucción del canto interno
Colgajo glabelar. Tomado de la línea media y con base en un lado de la nariz.
Colgajo digital partido. Tomado de la región frontoglabelar.
Cuando las estructuras canaliculares se extirpan junto al tumor, se deben reconstruir con tubos de silicona, que actúan como tutores durante la fase de cicatrización.
Radioterapia
En la actualidad, con la mejora en las técnicas quirúrgicas empleadas, es una opción reservada a pacientes con:
Recurrencias tumorales.
Tumores muy extensos en los que la extirpación quirúrgica no sea viable.
Entre las reacciones adversas que produce la radioterapia encontramos dermatitis, queratinización de la conjuntiva, y queratitis crónica. La radioterapia está contraindicada en pacientes con xeroderma pigmentoso y síndrome de nevus basocelular (en este caso la radioterapia podría inducir a la aparición de más tumores).
Quimioterapia
El uso del agente como el 5-fluoracilo o el cisplatino, aunque no es curativo, sí puede servir de tratamiento adyuvante en pacientes con tumores extensos en el canto medial, recurrencias y en los que la opción quirúrgica supone una amplia deformidad.
Terapia fotodinámica
Consiste en el uso de sustancias fotosensibles, y puede ser útil en el tratamiento de tumores superficiales extensos.
Electrodisección y curetaje
Es una técnica muy usada para eliminar estos tumores. Tiene el inconveniente de que el cirujano no puede determinar visualmente la profundidad del tumor y la extensión de la infiltración. La recidiva de los tumores de diámetros de 2-5 mm. extirpados con este método es de un 15%, mientras que si el tumor es de 3 o más cm, la recidiva alcanza el 50%.
Criocirugía
La extirpación quirúrgica utilizando frío, puede ser útil para tumores de pequeño tamaño y de límites clínicos bien definidos. Es una alternativa razonable para tumores del canto interno, con lo que se intenta minimizar la lesión del sistema lagrimal, estaría contraindicada esta técnica en pacientes con intolerancia al frío, criobulinemia, y no esta recomendada en tumores que incluyan el borde libre palpebral.
Otros
Se ha descrito el uso de retinoides sistémicos y tópicos, así como el interferón alfa.
BIBLIOGRAFÍA
Yiannias JA, Goldberg LH, Carter-Campbell S et al. The ratio of basal cell carcinoma to squamous cell carcinoma in Houston, Texas. J Dermatol Surg Oncol 1988; 14: 886-889.
Scotto J, Kopf AW, Urbach F. Non-melanoma skin cancer among Caucasians in four areas of the United States. Cancer 1974; 34: 1333-1338.
Maafs E, De la Barreda F, Delgado R et al. Basal cell carcinoma of trunk and extremities. Int J Dermatol 1997; 36: 622-628.
Rahbari H, Mehregan AH. Basal cell epithelioma (carcinoma) in children and teenagers. Cancer 1982; 49: 350-353.
Cox NH. Basal cell carcinoma in young adults. Br J Dermatol 1992; 127: 26-29.
Altman A, Rosen T, Tschen JA et al. Basal cell epithelioma in black patients. J Am Acad Dermatol 1987; 17: 741-745.
Kikuchi A, Shimizu H, Nishikawa T. Clinical and histopathological characteristics of basal cell carcinoma in Japanese patients. Arch Dermatol 1996; 132: 320-324.
Domarus H, Stevens J. Metastatic basal cell carcinoma. Report of five cases and review of 170 cases in the literature. J Am Acad Dermatol 1984; 10: 1043-1060.
Oram Y, Orengo I, Alford E et al. Basal cell carcinoma of the scalp resulting in spine metastasis in a black patient. J Am Acad Dermatol 1994; 31: 916-920.
Blewitt RW. Why does basal cell carcinoma metastasize so rarely? Int J Dermatol 1980; 19: 144-146.
Rigel DS, Robins P, Friedman RJ. Predicting recurrence of basal-cell carcinomas treated by microscopically controlled excision. J Dermatol Surg Oncol 1981; 7: 807-810.
Rowe DE, Carrol RJ, Day CL, Jr. Long-term recurrences rates in previously untreated (primary) basal cell carcinoma: implications for patients follow-up. J Dermatol Surg Oncol 1989; 15: 315-328.
Dixon AY, Lee SH, McGregor DH. Histologic features predictive of basal cell carcinoma recurrence: results of a multivariate analysis. J Cutan Pathol 1993; 20: 137-142.
Dubin N, Kopf AW. Multivariate risk score for recurrence of cutaneous basal cell carcinomas. Arch Dermatol 1983; 119: 373-377.
Rice JC, Zaragoza P, Waheed K, Schofield J, Jones CA. Efficacy of incisional versus punch biopsy in the histological diagnosis of periocular skin tumours. Eye 2003; 17 (4): 478-481.
Pollack SV, Goslen JB, Sherertz EF, Jegasothy BV. The biology of basal cell carcinoma: a review. J Am Acad Dermatol 1982; 7: 569-577.
Hajeer AH, Lear JT, Ollier WER et al. Preliminary evidence of an association of tumor necrosis factor microsatellites with increased risk of multiple basal cell carcinomas. Br J Dermatol 2000; 142: 441-445.
Barrett TL, Smith KJ, Hodge JJ et al. Immunohistochemical nuclear staining for p53, PCNA, and Ki-67 in different histologic variants of basal cell carcinoma. J Am Acad Dermatol 1997; 37: 430-437.
Wikonkal NM, Berg RJW, van Haselen CW et al. Bcl-2 vs p 53 protein expression and apoptotic rate in humans non melanona skin cancers. Arch Dermatol 1997; 37: 430-437.
Naldi L, DiLandro A, D Avanzo B et al. Host-related and environmental risk factors for cutaneous basal cell carcinoma: Evidence from an Italian case-control study. J Am Acad Dermatol 2000: 42: 446-452.
Long CC, Darke C, Marks R. Celtic ancestry, HLA phenotype and increased risk of skin cancer. Br J Dermatol 1998; 138: 627-630.
Strutton GM. Pathological variants of basal cell carcinoma. Australas J Dermatol 1997; 38: S31-35.
Compton JG, Goldstein AM, Turner M et al. Fine mapping of the locus for nevoid basal cell carcinoma syndrome on chromosome 9q. J Invest Dermatol 1994; 103: 178-181.
Requena L, Farina MC, Robledo M, Sangueza OP, Sanchez E, Villanueva A, Marquina A, Tamarit R. Multiple hereditary infundibulocystic basal cell carcinomas: a genodermatosis different from nevoid basal cell carcinoma syndrome. Arch Dermatol 1999; 135 (10): 1227-35.
Lindberg H, Jepsen FL. The nevoid basal cell carcinoma syndrome. Histopathology of the basal cell tumors. J Cutan Pathol 1983; 10: 68-73.
Zaragoza García P, Costa Vila J, Diab Haggi F, García Gil de Bernabé FJ, Valentín-Gamazo y Alcalá L, Zaragoza Casares P. Cirugía básica de anejos oculares. Tecnimedia Editorial S.L.; 1996.
Malhotra R, Huilgol SC, Huynh NT, Selva D. The Australian Mohs database, part II: periocular basal cell carcinoma outcome at 5-year follow-up. Ophthalmology 2004; 111 (4): 631-636.
Zagrodnik B, Kempf W, Seifert B, Muller B, Burg G, Urosevic M, Dumm.er R. Superficial radiotherapy for patients with basal cell carcinoma: recurrence rates, histologic subtypes, and expression of p53 and Bcl-2. Cancer 2003; 98 (12): 2708-2714.