HISTORIA Y HUMANIDADES
Historia del tratamiento del pterygion.
Desde Susruta hasta la betaterapia surfocular (parte I)
MURUBE J, ESTEBAN DE ANTONIO M, RIVAS L
Dedicado a los Dres. Arruga, Barraquer y Castroviejo
1
Este trabajo se ha desarrollado como parte
de la beca de la Fundación Mutua Médica Madrileña 2005/443.
La primera cita clara del tratamiento del pterygion que se
conserva se refiere al tratamiento quirúrgico, y es de hace unos 3.000 años,
cuando Susruta (117,130) escribió: «El paciente se tumba en una mesa. Se rocía
el pterygion con polvo de sal. Se le hace mirar lateralmente, y con un gancho se
le engarfia y tracciona la parte más floja y superficial del pterygion. A
continuación se separa éste del ojo, raspando su parte profunda con un
cuchillete de extremo redondeado pero afilado. Los restos que queden adheridos
al globo deben ser sajados. Después se aplica sobre el surfóculo un ungüento
para que no se reproduzcan».
El TRATAMIENTO MÉDICO del pterygion ha tenido escaso
desarrollo hasta fechas muy recientes, siendo hasta el presente aún de escasos
resultados. En el Egipto faraónio, entre las muchas fórmulas existentes, estaba
la aplicación de pastas de incienso, antimonio, miel, o excremento de pelícano o
de lagarto (5). Hipócrates (siglos IV-V aC) (67) citó colirios de cinc, cobre,
hierro, bilis, orina y leche materna. En los siglos siguientes se usaron
distintas fórmulas, no más eficaces que las egipcias, que se enriquecieron en
las culturas mahometana y cristiana de la Edad Media, y continuaron en la Edad
Moderna. Así, Bartisch (1583) (24) citó las mezclas de azúcar, polvo de
hematites, alumbre, vitriolo blanco, alcanfor y tártaro de vino. Sennert (1628)
(121), repite estos tratamientos con ligeras variantes. La piedra divina era una
mezcla de alumbre, vitriolo azul, nitro y alcanfor, que en forma de pasta o
disuelta en agua, se usaba como colirio (95,119). Algunas de las antiguas
infusiones aún persisten, como la infusión de malvarrubia (Marrubium
vulgare), todavía usada en Valle Guerra (Tenerife) (102). En la Edad
Contemporánea se iniciaron los colirios de fórmula química identificada, los
lavados boratados isotónicos, los colirios de sulfato de Zinc 2% (94,95), y los
colirios de nitrato de plata (95). El tratamiento médico exclusivo apenas se ha
usado por su ineficacia:
Un curioso tratamiento mixto médico-quirúrgico es el recogido en
un manuscrito medieval anónimo conservado en la Biblioteca Nacional de Madrid
(12). Este escrito distingue dos tipos de pterygion: para la uña nerviosa,
blanca o lisa recomienda el tratamiento clásico de cortarla con instrumento de
hierro; pero para la uña carnosa delgada recomienda sangrar la vena cefálica y
purgar la cabeza con decocción de Galeno, trocisco verde o aceite.
Recientemente se están introduciendo diversos tratamiento
médicos, que actualmente se usan como adición a la excisión quirúrgica:
corticosteroides, thiotepa, ciclosporina A, mitomicina C, fluorouracilo,
antifibróticos, interferones, anti-VEGF, antioxidantes, catalasas, etc.
Posiblemente sean la base del desarrollo en un futuro de un tratamiento tópico
sin necesidad de cirugía.
El TRATAMIENTO QUIRÚRGICO del pterygion, que como vemos
se inició con el raspado y excisión simple, ha seguido un largo camino con la
ligadura, torsión, desviación, plicatura, destrucción por cauterización o
electrolisis , betaterapia, etc. (11,94,98). Veamos cómo ha ido evolucionando
hasta el presente. El tratamiento quirúrgico inicial fue la remoción quirúrgica
(¿escisión o excisión? Vide Nota) dejando la superficie corneal y escleral
denudadas. Actualmente se conoce como la técnica de esclera desnuda (Bare
Sclera Technique).
Excisión quirúrgica simple (esclera desnuda): Tras la
anterior cita quirúrgica de Susruta, los cambios fueron escasos durante
siglos.Por ejemplo, Celsus (*circa 25 aC-Xca 50dC) (40) publicó una
cirugía que apenas difiere de la de Susruta, salvo en que para mantener la
tracción del pterygion durante la extirpación pasa un hilo por debajo de él:
«Tras ayunar durante un día, el paciente se sienta de cara al médico, o bien se
sienta de espaldas a él y se acuesta colocando su cabeza sobre un muslo del
médico. Algunos prefieren la primera posición si el ojo a operar es el
izquierdo, y la segunda posición si es el derecho. Un ayudante abre un parpado y
el cirujano el otro. El cirujano pasa un gancho bajo el pterygion y —dejando
ahora que el ayudante abra los dos párpados—, con la otra mano tracciona del
pterygion hacia sí mismo, elevándolo. Pasa una aguja curva enhebrada por detrás
del pterygion. Tracciona de los dos extremos del hilo, elevando el pterygion. Y
con un escalpelo lo corta y separa del ojo, procurando no dejar restos en el
lecho o por el contrario producir un agujero que provocará un flujo persistente
de humor. Después se aplica en la superficie cruenta hilachas con miel, y se
cubre con un tejido tejido de lino o lana. El ojo debe abrirse diariamente para
evitar que los párpados se adhieran por una cicatriz. La fecha ideal para operar
es la primavera; y si no, el otoño, que es mejor que el verano y el invierno».
Milenio y medio después apenas nada había cambiado. Bartisch
(24) (fig. 1) y Saint-Yves (119) seguían usando técnicas parecidas a las de
Susruta y Celsus: Saint Yves (1767) sienta el paciente en el suelo, se coloca
tras él, y el paciente descansa su cabeza sobre el muslo izquierdo del cirujano.
Un ayudante mantiene abierto los párpados superior e inferior. Esta posición, si
opera el ojo derecho. Si opera el ojo izquierdo y el cirujano no es ambidextro,
sienta al paciente en una silla. Pasa la aguja curva con hilo de seda tras el
pterygion, y anuda los dos cabos del hilo, y tracciona del pterygion hacia
delante. Después corta el pterygion por sus límites superior e inferior con una
lanceta, y lo despega de la esclera. A continuación introduce una de las ramas
de una tijera por debajo y otra por arriba del pterygion, y corta de un golpe la
unión del pterygion a la carúncula. Traccionando del hilo hacia la córnea,
diseca y separa el pterygion hasta la córnea transparente. Finalmente venda el
ojo durante 4 días, poniéndo «agua de la vida», y más tarde «piedra divina»
disuelta en agua común. Mexia (1814) no usa el hilo para traccionar, sino una
pinza (95).
Fig. 1. Extirpación de pterygion (Bartisch, 1583): Toma un gancho y atraviesa el
pterygion con él sin acercarte demasiado al globo. Atraviesa esta parte
superficial con una aguja enhebrada con un hilo de seda. Toma los dos extremos
del hilo con una mano. Separa el pterygion con un cuchillo afilado y puntiagudo.
Extírpalo con el bisturí en la otra mano hasta el canthus del ojo. Aplica sobre
el surfóculus el siguiente colirio: acedera, alumbre, albayalde y alcanfor. Y el
siguiente emplasto: clara de tres huevos, agua de maslo, masilla y alumbre.
A lo largo de estos siglos, la variación conceptual más notoria
es la recogida por Martínez (92), quien pasa una aguja enhebrada por debajo del
pterygion y anuda fuertemente el hilo para que el pterygion se vaya atrofiando.
Los grandes avances en el tratamiento quirúrgico del pterygion
se están haciendo en los último 150 años, sobre todo en los ultimos decenios. A
ello contribuyó grandemente la aparición en 1884 de la anestesia surfocular con
cocaína. Como un curioso antecedente a la anestesia, Ali Ibn Isa escribió sobre
adormecer al paciente («tanwim») (7,45). Se aplicase o no un supuesto sedante,
el paciente debía ser fuertemente sujetado para evitar sus movimientos (fig. 2).

Fig. 2. Preparación de un paciente para ser operado de pterygion (Bartisch
1583). La inmovilización del paciente se hacía en aquella época físicamente. Los
métodos químicos, como la "esponja somnífera" de Hipócrates (impregnada en opio,
beleño y mandrágora), raramente eran usados.
Ya recientemente aparecieron numerosas variantes de la técnica
de esclera desnuda: extirpación de áreas conjuntivales limítrofes no
microscópicamente afectadas, cauterización del lecho, etc. (27,129). Como el
daño que favorecerá la recidiva del pterygion no parece estar en sus células
epiteliales, sino en el tejido fibrovascular subyacente, la extirpación del
pterygion visible debe completarse con dos medidas: 1) La perfecta limpieza de
la esclera desnuda (corte, raspado, etc.) y 2) La eliminación del tejido
subconjuntival circundante al pterygion visible. Por ello, actualmente, tras la
extirpación del pterygion, debemos separar por disección roma la conjuntiva
residual de su tejido episcleral y tenoniano subyacente, y traccionando de éste
con una pinza, exteriorizarlo y extirparlo también. Esto es especialmente
importante en los pterygia con extensión retrógrada supraescleral, especialmente
si alcanzan la musculatura ocular extrínseca.
La técnica de esclera desnuda es la más simple de ejecutar, pero
la que da más recidivas, que según diversos cirujanos asciende al 20-89% delos
operados (17,71,125,138).
ADICIONES A LA EXCISIÓN SIMPLE
Adición de autotransplante conjuntival por deslizamiento.
Czermack (46) fue a nuestro saber el primero que tras la excisión del pterygion
suturó los bordes libres superior e inferior de la conjuntiva el uno al otro,
cubriendo el área denudada.
Después surgieron muchas otras técnicas de autotransplante
conjuntival por deslizamiento. Así, Campodonico (33) cubría el área denudada
arrastrando un flap de conjuntiva inferior que suturaba a la episclera del área
superior denudada. Y Arruga (15) disecaba la conjuntiva situada entre el limbo
superior y la inserción del recto superior, y la arrastraba sobre el lecho del
pterygion, donde la cosía (fig. 3). Kenyon et al. (75) hacen una variante de
esta técnica, y tras la excisión del pterygion, toman del cuadrante temporal
superior un colgajo de conjuntiva bulbar que transplanta sobre la esclera
denudada. Las variantes usadas son numerosas (18,69,75,111,112,135).
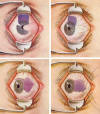
Fig. 3. Técnica de Arruga. Extirpación del pterygion y autotrasplante
conjuntival por deslizamiento hacia abajo de la conjuntiva sana situada sobre el
limbo corneal superior y sobre el pterygion (Arruga H. Cirugía ocular.
Barcelona: Salvat. 1950. pp. 325-326).
La tasa de recurrencias con autotransplantes conjuntivales por
deslizamiento es del 45-69%. (111,112). Kenyon et al (75) con su variante
quirúrgica publicaron sólo un 5,3 de recurrencias. Con ésta u otras variantes se
han citado recurrencias del pterygion del 2%, 7,9% y 39% (8,41,131).
Adición de autotransplante conjuntival libre. El transplante
conjuntival autólogo libre proveniente del mismo o del otro ojo (63), compite
actualmente con el transplante de membrana amniótica, que es más simple de
ejecutar, y que no exige hacer una autoextracción conjuntival. No obstante, aún
aceptando muchas de las propiedades positivas de la membrana amniótica, algunos
autores prefieren el transplante conjuntival autólogo al transplante de membrana
amniótica, y así Prabhasawat et al. (111) encuentran que el autotransplante
conjuntival previene las recurrencias del pterygion mejor que la membranaa
amniótica, ocurriendo las recidivas con el primero en el 4,8% de los casos y con
el segundo, en el 14,8%.
Adición de autotransplante del pterygion por desviación.
Knapp (79), en 1868, cortaba horizontalmente el pterygion en dos mitades, la
cabeza de la mitad superior la introducía bajo la conjuntiva bulbar superior, y
la cabeza de la mitad inferior bajo la conjuntiva bulbar inferior. Blascovics
(28), en 1918, despegaba la mitad lateral del pterygion, y doblándola hacia
atrás sobre sí mismo, llevaba su cabeza hacia la carúncula, suturándola en esta
posición. Desmarres (48) separaba la cabeza, cuello y cuerpo del pterygion, y
sin extirparlo, introducía la cabeza bajo lo conjuntiva sana inferior, donde la
suturaba. McReynolds modificó esta última técnica cubriendo con la conjuntiva
adyacente el área limbal denudada. La tasa de recurrencias era del 30-75% (74).
Adición de autotransplantes buco-mucoso. En casos de
tratamiento quirúrgico de pterygia ya recidivados se han usado transplantes
autólogoas de mucosa bucal. Castroviejo (37) usó autotransplantes de mucosa
bucal tomados con su electroqueratotomo, colocándolos sobre la esclera denudada
y cosiéndolos con seda negra 8-0 —la sutura más delicada en su época—, que
retiraba a las 2 semanas.
Adición de transplante de membrana amniótica. La membrana
amniótica tiene una antigenicidad muy escasa y por ello no desencadena reyección
inmunológica. Contiene leucotrienos, prostaglandinas, interleukinas, enzimas, y
vitaminas, y además posee altos niveles de muchos factores de crecimiento que
promueven la epitelización de la superficie corneal con excepción de los que
favorecen la neovascularización a la que por el contrario inhiben. Su accion
antiiflamatoria es grande. Modula la cicatrización reduciéndo la proliferación
fibroblástica, y la cicatriz exuberante. La migración del epitelio corneal y
conjuntival sobre la membrana amniótica es fácil. Una de sus características más
específicas para su uso en la cirugía del pterygion es que suprime el TGF-beta
en los fibroblastos del pterygion (84,123). El mantenimiento de la membrana
puede durar de varias semanas a varios meses (114), pero es muy frecuente que el
epitelio corneal crezca sobre la membrana basal amniótica y la incorpore (59).
Por todo ello, su uso para cubrir la esclera denudada ha sido
muy amplio (29,59,61,85,89, 96,105,111,115,121,123,124,126).
Adición de queratectomía superficial. La parte de invasión
corneal del pterygion se eliminaba generalmente por corte y raspado. La adición
de queratectomía superficial empezó cuando los cirujanos empezaron a usar
anteojos quirúrgicos telescópicos, y sobre todo, cuando a lo largo de la decada
de los 1960 empezaron a extenderse los microscopios quirúrgicos. Castroviejo
(38) postulaba hacer una queratectomía del área corneal invadida, tan
superficial como posible, pero suficiente para eliminar la córnea alterada.
Adición de transplante corneal. La idea de cubrir con una
queratoplastia heteróloga el área corneal adelgazada por una cirugía de
pterygion fue de Magitot (91). Distintos autores han repetido con diversas
variantes este proceder (31,83, 103,107,109,138).
En casos de pterygia recidivados en que repetidas operaciones
provocaron un adelgazamiento y perforación corneal, Catroviejo introdujo en la
década de los años 1930 (37) los transplantes perforantes periféricos con forma
de creciente lunar o de segmento de círculo.
Adición de autotransplante limbo-conjuntival. Barraquer
(19-22) había ya hecho reiteradamente la observación de que en la cirugía del
pterygion la recidiva puede evitarse con pequeños transplantes
corneoconjuntivales. La comprensión del porqué de esto se inició cuando Davanger
et al (47) sugirieron en 1979 que la estructura papilar limbal es la generadora
de las células epiteliales corneales. Otros estudios soportaron que las células
limbales emigran centrípetamente hacia la córnea para reparar pérdidas
epiteliales traumáticas (78). Sobre estos hallazgos, Thoft et al., 1983 (133)
elaboraron su hipótesis XYZ, para explicar cómo se genera, desplaza y mantiene
la masa epitelial corneal, y Buck 1985 (30) observó que en el recambio epitelial
normal hay también un movimiento celular corneal centrípeto. En 1986 Schermer et
al (120) evidenciaron que las células madre del epitelio corneal están en el
limbo, basándose en la expresión de una queratina de 64 kd específica del
epitelio corneal.
Los actuales criterios de que la luz UV daña las células madre
estaminales del epitelio corneal, situadas en el limbo, están llevando a tratar
los casos graves o recurrentes con autotranplantes limbales (3,64,100,115).
Estas técnicas tienen la ventaja de que en la mayorís de los pterygia el limbo
no afectado está normal y disponible, y el arco de limbo a extirpar puede no ser
excesivo. Los transplantes de limbo alógenos son más raros que los autólogos,
pero no quedan excluidos como posible tratamiento (43).
Adición de cauterización. Algunos autores han sugerido que
no es la aparición de tejido conjuntivo lo que atrae y estimula los neovasos,
sino que viceversa, son los vasos los que estimulan la aparición de elementos
inflamatorios y cicatriciales. Por ello, cauterizan los vasos de los bordes y
lecho resultantes de la extirpación del pterygion (6,74). La cauterización debe
ser mesurada, pues el exceso sería lesivo (77).
Adicion de corticosteroides. La disminución de la
inflamación postoperatoria con corticosteroides tópicos disminuye la inflamación
y por tanto la tendencia a la recidiva (35,72,140). Hoy la aplicación tópica de
un corticosteroide durante varios días entra en el protocolo habitual de la
cirugía del pterygion, generalmente asociándolo a algún antibiótico.
Adición de thiotepa. El thiotepa (triethylen
thiophosphoramida) es un agente radiomimético que oblitera los neovasos por
inhibir la mitosis del endotelio de los capilares y por tanto, su crecimento
(86). Se ha usado en dilución al 1:2000 (15 mg en 30 cc de solución de Ringer),
una gota tópica cada 3 horas durante 8 semanas. En 30 pacientes Meacham (93)
sólo tuvo una recidiva, y en 17 pacientes Cassady (35) también sólo una. Como
complicación se ha citado la vasodilatación conjuntival, alergia al thiotepa y
despigmentación de la piel de los párpados (73,136).
Adición de ciclosporina A. La ciclosporina A aislada del
hongo Tolypocladium inflatum Gamsi inhibe la calcineurina, que es una
serina/treonina fosfatasa que defosforiliza los factores nucleares de las
células T activadas. Hace varias décadas que se utiliza como antiinflamatorio y
como inmunosupresor por vía sistémica o tópica (43). Su forma en colirio se
comercializa actualmente dos formas: El Restasis (Lab. Allergan, EEUU) en
excipiente de aceite de ricino, y el Modusik-A (Lab. Sophia. Méjico) en
excipiente acuoso. Su acción antiproliferativa de los fibroblastos del pterygion
ha sido comprobada in vitro (66). También se ha estudiado en el pterygion en
aplicación tópica de ciclosporina A al 1%, y comparándola con el tiothepa al
0,5% (136).
Adición de mitomicina C. La mitomicina C (MMC) es un agente
antibiótico y antitumoral que inhibe los ácidos ribonucleico y deoxiribonucleico
(RNA y DNA), la síntesis de proteínas y la proliferación celular. Tiene un
efecto prolongado en el tiempo. Se usa tópicamente en dilución 0,02%,
aplicándola empapapada en una hemosteta que se mantiene sobre el lecho escleral
denudado durante 2 minutos (34,56,60,65,110,137), y dejando después la esclera
desnuda o cubriéndola con conjuntiva. También se ha usado la aplicación
postoperatoria, instilando la dilución de MMC, bis in die durante 5 días. Se han
citado complicaciones como keratopatía punctata epitelial, avascularidad limbal,
distrofia escleral y corneal, descompensación corneal, placas de calcificación,
y excepcionalmente queratomalacia (corneal melting), glaucoma o catarata (57,60,
87,104,118). En un estudio doble ciego hecho en Tenerife por Pérez Silguero et
al. sobre 273 ojos con pterygion, se les aplicó en el mismo acto quirúrgico una
esponjilla empapada en MMC durante 3 minutos, y después se instiló una gota
tópica durante 5 días. En los pacientes de menos de 60 años, las recidivas sin
MMC fueron del 41,1%; con MMC al 0,005%, del 28,2%; y con MMC al 0,010%, del
15,2%.
La MMC, cuando usada excesivamente durante la operación, puede
ocasionar graves lesiones de distrofia escleral. El recubrir la lesión con
conjuntiva autóloga puede mejorar el cuadro, pero en muchos casos resulta
insuficiente (70).
Adición de fluouracilo. El 5-fluorouracilo (5-FU) es un
agente quemoterapéutico que inhibe la timidilato sintetasa, un enzima importante
en la síntesis de DNA. Si falta la síntesis de DNA se inhibe la proliferación
celular. El 5-FU tiene la ventaja sobre la MMC de que sólo afecta a las células
proliferantes, mientras que la MMC afecta tanto a las proliferantes como a las
quiescentes. La inyección de 5-FU cuando un pterygion está recurriendo reduce la
neovascularización, se cree que por inhibir los fibroblastos y por ello las
necesidades de oxígeno y estímulo para los neovasos.
El 5-FU se ha aplicado tanto en pterygia primarios como en
recidivados, principalmente para evitar recurrencias en ojos pronos a ellas
(1,2,26,106).
Adición de antifibróticos. La acción antifibrótica del
TNP-470, la pioglitazona o el everolimus se han estudiado in vitro contra los
fibroblastos aislados del pterygion, pero aún no se han usado in vivo (44,81).
Adición de interferón. Los interferones (IFNs) son citokinas
secretadas por las células en situaciones de stress, tales como infección o
cáncer. Los interferones tipo I (IFN-a, IFN-b)
se segregan en todas las células somáticas, y los tipo II (IFN-g)
en las celulas del sistema inmunitario. Hasta el presente sólo se ha publicado
un estudio en que se ha aplicado el IFN-a-2b en
casos de pterygion recurrente, con resultados satisfactorios (58).
Adición de inhibidores del VEGF. El pterygion se caracteriza
por una excesiva neovascularización. En los pacientes con pterygion se ha
demostrado el aumento de factores pro-angiogénicos, como el TNF-alfa, VEGF,
FGF-2, HB-EGF, IL-6, IL-8 y MMPs (50,51,81,101), y disminución de factores
anti-angiogénicos como el thrombosporidin (TSP-1) y la endostatina (16,62,72).
Esto produce la neovascularización típica del pterygion.
Por ello, actualmenter se está ensayando la utilización de
medicación antiangiogénica. Entre los antiangiogénicos, el más usado actualmente
en oftalmogía es el bevacizumab (Avastin, de Lab. Roche), que aunque aprobado
para el cáncer colo-rectal es ampliamente usado intravítreo off-label para la
DMAE húmeda. A nuestro saber, el primer trabajo publicado sobre el uso de este
anti-angiogénico en el pterygion es el de Camilo et al. (2007) (32bis), quienes
no han encontrado menos recurrencias en los casos en que se usó que en los casos
control, tal vez por haberse aplicado con dosis insuficientes. Mejores son los
resultados obtenidos por DeStefano et al. (2007) y Kim (2008) (49,76) usando un
colirio de Avastin 10 mg/ml, al 1,0 por ciento de concentración, aplicado
surfocularmente 4 veces por día durante 25 días.
Nosotros empleamos desde hace 1 año la toma de Doxium
(dobesilato de calcio), que tiene un efecto anti-VEGF y anti-FGF, tomado en
forma de cápsulas de 500 mg, bis in die. Es un estudio conjunto con el
departamento de investigación del Hospital Ramón y Cajal (Dr. Cuevas). La menor
frecuencia de recurrencias de pterigion parece existir, pero aún se precisan más
casos para darle un valor estadístico.
Suturas y pegamentos. Todos lo métodos quirúrgicos, excepto
los de esclera desnuda, necesitan fijar mucosa, membrana amniótica o córnea
limbal cubriendo la zona denudada. Cualquier sutura es un irritante físico.
Castroviejo usaba la sutura menos traumatizante de sus tiempos, la seda negra
8-0 enhebrada. Por los años 60 aparecieron las sutura 10-0, llamadas
atraumáticas porque se continúan con la aguja. Pese a su menor roce, las suturas
son evitadas por muchos cirujanos, por ser origen de irritación y por tanto de
estimular las recurrencias. Otros cirujanos las aplican sólo cuando han
eliminado mucha superficie de conjuntiva (27,37). Ocluir el ojo hasta la
reepitelización es fundamental. Si el paciente no lo entiende, debe explicársele
que una misma herida no requiere reposo si está en la frente, y lo requiere
siendo igual si está en la planta del pié, y que una herida de pterygion se
parece más a la de la planta del pie que a la de la frente, por estar
repetitivamente sometida al frote del parpadeo.
A finales del siglo pasado comenzaron a aparecer los adhesivos
tisulares que evitan las suturas. Los comercializados y más extendidos son uno
sintético (el cianoacrilato) y uno biológico (la fibrina).
Los pegamentos derivados del cianoacrilato son compuestos que se
polimerizan rápidamente en contacto con substancias básicas tales como sangre,
lágrima, suero salino o agua, creando así una unión con gran fuerza tensil entre
los tejidos que contacta (80,134). Se aplica sobre la esclera denudada y se
coloca encima el tejido a transplantar.
Los pegamentos de fibrina (fibrin glue) polimerizan más
lentamente, tienen menor fuerza tensil, inducen muy poca reacción inflamatoria y
son biodegradables. El más usado en España es el Tissucol, de Laboratorios
Baxter, que contiene dos componentes separados: uno de fibrinógeno,
fibronectina, plasminógeno y factor XIII, diluidos en una solución de aprotinina
bovina y después congelada. Otro, una solución de trombina humana disuelta en
cloruro de calcio. Cuando tras extirpar el pterygion ambas soluciones se mezclan
y aplican sobre la esclera denudada, interaccionan entre sí y antes de que
formen un coágulo se coloca sobre la mezcla el tejido a adherir; o bien se
coloca directamente el tejido a transplantar, y bajo él se inyecta el pegamento.
El uso de pegamento de fibrina acorta el tiempo de operación, reduce las
molestias del paciente y provoca menos respuesta inflamatoria (80,127, 128,134).
Adición de betaterapia. En la presente revisión histórica
del tratamiento del pterygion, la adición de betaterapia la desglosamos para el
próximo número de Studium Ophthalmologicum, ya que su importancia bien merece
exponerla más ampliamente en una Parte II.
Antes de teminar esta Parte I de la evolución histórica del
tratamiento de pterygion digamos unas palabras sobre el tratamiento
preventivo del pterygion y de sus recidivas postquirúrgicas.
La prevención del pterygion comenzó a desarrollarse cuando
empezó a sospecharse su relación con la sobrecarga de rayos o luz ultravioleta
(LUV). Aún no hay un conocimiento claro de ello. El tratamiento preventivo
ambiental consiste en evitar la exposición a radiación UV, ya cambiando los
hábitos laborales o recreativos, especialmente en las fechas cercanas al
solsticio de verano, ya usando gafas de sol, sombrero de ala o visera. Mackenzie
et al. (90) mostraron que las personas que entre los 20 y 29 años de edad nunca
habían usado sombrero cuando se exponían al sol tenían doble riesgo de
desarrollar un pterygion que las personas que en las mismas circunstancias lo
usaban; y que el riesgo de pterygion era 9 veces mayor en las personas que en
los 10 años anteriores no usaron gafas de sol, que en las que las usaban.
El tratamiento preventivo farmacológico se basa en la
toma habitual de antioxidantes, tales como los de pequeñas moléculas (ácido
ascórbico, glutatión, alfa-tocoferol) y ciertos enzimas (catalasa, superóxido
dismutasa, glutatión peroxidasa, reductasa) protegen del stress oxidativo que
produce la LUV, y por consiguiente de la alteración de la matriz extracelular y
la síntesis del colágeno y la elastina (39).
El uso de lágrimas artificiales lubricantes y la medicación
tópica surfocular de antiinflamatorios, antihistamínicos y vasoconstrictores
parece también disminuir algo el desarrollo de pterygion.
En cuanto a las recidivas, Celsus ya señaló en el siglo
II que el pterygion suele recidivar cualquiera sea el tratamiento aplicado
(40,117). El pterygion recurrente suele ser más agresivo que el primario
(138,140), y esto le da una especial importancia.
Kamel (74), quien dio tasas de recurrencias postquirúrgicas de
entre el 30 y 50% de los operados, sugirió que las recidivas de un pterygion
primario dependen en gran parte de los factores personales del paciente y
etiopatogénicos del pterygion. Pérez Silguero et al. (104) observan que el sexo,
la diabetes y la hipertensión no modifican estadísticamente el porcentaje de
recidivas.
El factor más importante para las recurrencias hasta el presente
hallado es la previa exposición crónica la LUV. Esto explica que las recidivas
sean más frecuentes en países tropicales y subtropicales como America
Ecuatorial, Canarias o Filipinas. En el Hospital Insular de Gran Canaria, el 4%
de todas las intervenciones quirúrgicas oftalmológicas son pterygia, muchos de
ellos recidivados (99,113). Sin embargo, Cameron (32) piensa que las
recurrencias postoperatorias del pterygion no tienen ya relación con la
irradiación LUV, pues pueden aparecer aunque usen después gafas de protección
LUV, y las achaca a que es el traumatismo operatorio el que estimula la
proliferación fibroblástica. Otros autores piensan que la LUV recibida sí
influye en las recidivas, pues la alteración celular irradiativa persiste y
facilita la reproducción, al igual que el exceso de sol tomado desde la
infancia, facilita las manchas de hiperpigmentación cutánea en edades medias de
la vida. La LUV recibida en la juventud puede compararse con el dinero ingresado
en una cuenta corriente de un banco, que allí queda, y se va acumulando a nuevos
ingresos.
A lo largo de esta Parte I se han citado porcentajes de
recurrencias según diversos autores. Estos porcentajes van del 0% en los casos
más optimistas, al 90% en los menos (38,69,97,132). Y son muy distintos de unos
autores a otros, dependiendo entre otros factores del tipo de población que
sirvió de muestra, su localización geográfica, su profesión, la técnica
quirúrgica aplicada, la experiencia quirúrgica del oculista, o el número de
casos estudiados.
BIBLIOGRAFÍA
-
Abraham LM, Selva D, Casson R, Leibovitch I. The clinical
applications of fluorouracil in ophthalmic practice. Drugs 2007; 67: 737-755.
-
Akarsu C, Taner P, Ergin A. 5-fluorouracil as chemoadjuvant
for primary pterygium surgery: preliminary report. Cornea 2003; 22: 522-526.
-
Al Fayez MF. Limbal versus conjunctival autograft
transplantation for advanced and recurrent pterygium. Ophthalmology 2002; 109:
1752-1755.
-
Alaniz-Camino F. The use of postoperative beta radiation in
the treatment of pterygia. Ophthalm Surg 1982; 13: 1022-1025.
-
Albert DM, Edwards DD. The history of ophthalmology. Cambridge
(MA, USA): Blackwell Sci. 1996
-
Alger LJ. Etiology of pterygium recurrence. Amer J Ophthalmol
1964; 57: 450-453.
-
Ali Ibn Isa. Tadhkirat al-Kahhalin (Cuaderno de los Oculistas
(o Notebook of the oculists). Baghdad. Siglo X.
-
Allan BD, Short P, Crawford GJ. Pterygium excision with
conjunctival autografting: an effective and safe technique. Br J Ophthalmol
1993; 77: 698-701.
-
Álvarez de Toledo Elizalde JP, de la Paz Dalisay M. Pterigión:
Caso clínico y revisión. Arch Soc Canar Oftalmol 2003; 14: 53-63.
-
Anduze AL, Biscoe, BW. Pterygium staging in the Caribbean. Ann
Ophthalmol 1998; 30: 92-94.
-
Ang LP, Chua JL, Tan DT. Current concepts and techniques in
pterygium treatment. Curr Opinnn Ophthalmol 2007; 18: 308-313.
-
Anónimo. Medicina en romance.Conservado en la Biblioteca
Nacional de Madrid, signatura 10051.
-
Ansari MW, Rahi AHS, Shukla BR. Pseudoelastic nature of
pterygium. Br J Ophthalmol 1970; 54: 473-476.
-
Arnalich Montiel. F. Terapia celular aplicada a las
regeneración del estroma corneal: Uso de las células madre de tejido adiposo
en modelos experimentales. Tesis Doctoral. Universidad Autónoma de Madrid. 23
abril 2008.
-
Arruga H. Cirugía Ocular. Barcelona : Salvat Editores. 1950;
pp 317-330.
-
Aspiotis M, Tsanou E, Gorezis S, et al. Angiogenesis in
pterygium: study of microvessel density, vascular endothelial growth factor
and thrombospondin-1. Eye 2007; 21: 1095-1101.
-
Bahrassa VF, Datta R. Postoperative beta radiation treatment
of pterygium. Int J Radiat Oncol Biol Phys.1983; 9: 679-684.
-
Bangerter A. Pterygium operation and covering of conjunctival
defects. Ophthalmologica 1943; 106: 316-320.
-
Barraquer Moner JI. Etiología y patogenia del pterigion y de
las excavaciones de la córnea de Fuchs. Arch Soc Amer Oftalmol Optom 1964; 5:
49-60.
-
Barraquer Moner JI. Tratamiento del pterygion. Arch Soc Amer
Oftalmol Optom (Colombia) 1965; 5: 99-111.
-
Barraquer Moner JI, Hernández A. Ein neues Syndrome:
Hyposekretion der Tränendrüse. Hypotonic und mangelhafte Konvergenz. Klin
Monatsbl Augenheilk 1977; 171: 859-862.
-
Barraquer JI. Etiology, pathogenesis, and treatment of
pterygion. In: 1st Symposium on Medical and Surgical Diseases of the Cornea.
1980. Trans N. Orleans Acad Ophthalmol. St Louis, CV Mosby. pp 167-178.
-
Barraquer-Somers E, Chan CC, Green WR. Corneal epithelial iron
deposition. Ophthalmology 1983; 90: 729.
-
Bartisch von Königsbrück, G. Ophthalmodouleia, das ist
Augendienst. Dresden: M. Stöckel. 1583
-
Beard HH, Dimitry TJ. Some observations upon the chemical
nature of the ptrygium. Am J Ophthalmol 1945; 28: 303-305.
-
Bekibele CO, Baiyeroju AM, Ajayi BG. 5-fluorouracil vs.
beta-irradiation in the prevention of pterygium recurrence. Int J Clin Pract
2004; 58: 920-923.
-
Bernstein M, Unger SM. Experiences with surgery and strontium
90 in the treatment of pterygium. Am J Ophthalmol 1960; 49: 1024-1029.
-
Blaskovics L. Üeber die Saumnaht der Bindehaut und über
Operation des Pterygiums. Ref. en Zentralblatt Ophthalmol. 1931 (Tomado de
Arruga H. Cirugía Ocular. Barceloa: Salvat. 1950. p.323-324)
-
Bouchard CS, John T. Amniotic membrane transplantation in the
management of severe ocular surface disease: Indications and outcomes. The
Ocular Surface 2004; 2: 201-211.
-
Buck RC Measurement of centripetal migration of normal corneal
epithelial cells in the mouse. Invest Ophthalmol Vis Sci 1985; 26: 1296-1299.
-
Busin M, Hlladay BL, Arffa RC, et al. Precarved lyophilized
tissue for lamellar keratoplasty in recurrent pterygium. Am J Ophthalmol 1986;
102: 222-227.
-
Cameron ME. Pterygium throughout the world. Springfield:
Charles C Thomas 1965; pp 141-171.
-
bis. Camilo ER, Paes JP, Godinho TCS, et al. The use of
intra-operatorial Avastin as a coadjuvan in the surgical treatment of
recurrence pterygium. IOVS 2007; 40(suppl):S5295/B506.
-
Campodonico E. A new procedurew in the excision method of
pterygium operation. In: Zentmasyer W (ed.) Trans XII Int’l Congress
Ophthalmol. Philadelphia: WF Fell, 1922; pp 201-205.
-
Cardillo JA, Alves MR, Ambrosio LE, et al. Single
intraoperative application versus postoperative mitomycin C eye drops in
pterygium surgery. Ophthalmology 1995; 102: 1949-1952.
-
Cassady JR. The inhibition of pterygium recurrence by
Thiotepa. Amer J Ophthalmol 1966; 61: 886-888.
-
Castello B. Lexicon medicum Hippocratis, Galeni, et Avicenae,
etc. Roterdam. 1651.
-
Castroviejo R. Atlas de queratectomías y queratoplastias.
Barcelona: Salvat Edit. 1st edition 1964. 264-265, 300-301.
-
Castroviejo R. Symposium on the cornea. Trans Amer Acad
Ophthalmol Otolarynolg 1972; 76: 165-172.
-
Cejkova J, Stipek S, Crkovska J, et al. UV Rays, the
prooxidant/antioxidant imbalance in the cornea and oxidative eye damage.
Physiol Res 2004; 53: 1-10. 2004.
-
Celsus, Aulas Cornelius , De medicina (On medicine). Circa 30
AD. , Liber VII, 7.
-
Chen PP,Ariyasu RG, Kaza V, et al. A randomized trial
comparing mitomycin C and conjunctival autograft after excision of primary
pterygium. Am J. Ophthalmol 1995; 120:151-160.
-
Chen PL, Cheng YW, Chiang CC, et al. Hypermethylation of the
p16 gene promoter in pterygia and its association with the expression of DNA
methyltransferase 3b. Mol Vis 2006; 12: 1411-1416.
-
ChenZhuo L, Ocaña M, Murube E. Transplante de limbo alógeno.
Su supervivencia determinada por la clínica y la citología de impresión. Arch
Soc Canar Oftalmol 2003; 14: 11-14.
-
Chui J, Di Girolamo N, Coroneo MT, Wakefield D. The role of
substance p in the pathogenesis of pterygia. IOVS 2007; 48: 4482-4489.
-
Cristóbal Bescós JA. La oftalmología medieval. El legado de
los árabes. Rev Microcirugía Ocular 2005; 4.
-
Czermak W. Die Augenärztlichen Operationen. Berlin & Viena: Ed
Urban & Schwarzenberg: 1907-1908.
-
Davanger M, Evensen A. Role of the pericorneal papillary
structure in renewal of corneal epithelium. Nature 1971; 229: 560-56.
-
Desmarres L. Citado por Arruga H (15).
-
DeStefano JJ, Kim T. Topical Bevacizumab (Avastin) therapy for
corneal neovascularization. Arch Ophthalmol 2007; 125: 834-836.
-
Di Girolamo N, Wakefield D, Coroneo MT. Differential
expression of matrix metalloproteinases and their tissue inhibitors at the
advancing pterygium head. IOVS 2000; 41: 4142-4149.
-
Di Girolamo N, Kumar RK, Coroneo MT, Wakefield D. UVB-mediated
induction of interleukin-6 and -8 in pterygia and cultured human pterygium
epithelial cells. IOVS 2002; 43: 3430-3437.
-
Di Girolamo N, McCluskey P, Lloyd A, et al. Expression of MMPs
and TIMPs in human pterygia and cultured pterygium epithelial cells. IOVS
2004; 41: 671-679.
-
Diccionario de la Lengua Castellana. Madrid: Imprenta de la
Real Academia Española. 1739. Tomo VI, pág 59.
-
Diccionario de la Lengua Española. Madrid. Ed. Espasa-Calpe.
1992; pág 617.
-
Domínguez González JJ, León Hernández FA. Epidemiologia del
pterigión quirúrgico en la isla de La Palma. Arch Soc Canar Oftalmol 2002; 13:
47-54.
-
Dougherty PJ, Hardten DR, Lindstrom RL. Corneoscleral melt
after pterygium surgery using a single intraoperative application of
mitomycin-C. Cornea 1996; 15: 537-540.
-
Dunn JP, Seamone CD, Ostler HB, et al. Development of scleral
ulceration and calcification after pterygium excision and mitomycin therapy.
Am J Ophthalmol 1991; 112: 343-344.
-
Esquenazi S. Treatment of early pterygium recurrence with
topical administration of interferon alpha-2b. Canad J Ophthalmol 2005; 40:
185-187.
-
Fernández-Vega Sanz L, Baamonde Arbaiza MB, Fernández-Vega
Sanz, J. Tratamiento del pterigium recidivante con injerto de membrane
amniótica. A propósito de un caso. Arch Soc Canar Oftalmol 2003; 14: 81-86.
-
Frucht-Pery J, Siganos CS, Ilsar M. Intraoperative application
of topical mitomycin Cfor pterygium surgery. Ophthalmology 1996; 103: 674-677.
-
Gabric N, Maravicic I, Dekaris I. Human amniotic membrane in
the reconstruction of the ocular surface. Doc Ophthalmol 1999; 98: 273-283.
-
Gebhardt M, Mentlein R, Schaudig U, et al. Differential
expression of vascular endothelial growth factor implies the limbal origin of
pterygia. Ophthalmology 2005; 112: 1023-1030.
-
Gómez Márquez. Nuevo procedimiento operatorio del pterigion
Arch Oftalmol Hisp-Amer 1931; 87.
-
Gris O, Güell JL, del Campo Z. Limbal-conjunctival autograft
transplantation for the treatment of recurrent pterygium. Ophthalmology 2000;
107: 270-273.
-
Helal M, Messiha N, Amayem A, et al. Intraoperative mitomycin
C versus postyoperative mitomycin C for treatment of pterygium. Ophthalmic
Surg and Lasers 1996; 27: 674-678.
-
Hercules LA, Viveiros MM, Schellini SA, et al. Exposición de
los fibroblastos de la cápsula de Tenon del pterygion a la ciclosporina 0,05%
(en portugués). Arq Bras Oftalmol 2006; 69: 831-835.
-
Hipócrates. Citado ppr Rojas Álvarez E (116).
-
Hirst LW. Distribution, risk factors, and epidemiology of
pterygium. In: Taylor HR (ed.). Ptherygium. The Netherlands: Kugler
Publications 2000; pp 15-28.
-
Hirst LW . The treatment of pterygium- Surv Ophthalmol 2003;
48:145-180.
-
Hirst L. Pterygium and P.E.R.F.E.C.T. for pterygium for
healthcare professionals. Pictorial Glossary. 2006. AAO Las Vegas. p 11.
-
Jaros PA, DeLuise VP. Pingueculae and Pterygia. Surv Ophthalm
1988; 33: 41-49.
-
Jin J, Guan M, Sima J, et al. Decreased pigment
epithelium-derived factor and increased vascular endotelial growth factor
levels in pterygia. Cornea 2003; 22: 473-477.
-
Joelson GA, Muller P. Incidence of pterygium recurrence in
patients treated with Thiotepa. Am J Ophthalmol 1976; 81: 891-892.
-
Kamel S. Pterygium. Its nature and a new line of treatment.
Brit J Opthalmol 1946; 30: 549-564.
-
Kenyon KR, Wagoner MD, Hettinger ME, et al. Conjunctival
autograft transplantation for advanced and recurrent pterygium. Ophthalmology
1985; 92: 1461-1470.
-
Kim T. Topical bevacizumab eye drops decrease corneal
neovascularization. Eurotimes 2008; 13: 12(5): 2.
-
King JH. The pterygium. Brief review of certain methods of
treatment. Arch Ophthalmol 1950; 44: 854-858.
-
Kinoshita S, Friend J, Thoft RA. Sex chromatin of donor
corneal epithelium in rabbits. Invest Ophthalmol Vis Sci 1981; 21: 434-441.
-
Knapp A . Ueber einige neue, namentlich plastische
Konjunktivaloperationen. Graefes Arch 1868; 14.
-
Koranyi G, Seregard S, Kopp ED. Cut and paste: a no suture,
small incision approach to pterygium surgery. Brit J Ophthalmol 2004; 88:
911-914.
-
Kria L, Ohira A, Amemiya T. Immunohistochemical localization
of basic fibroblast growth factor, platelet derived growth factor,
transforming growth factor-beta and tumor necrosis growth factor-alpha in the
pterygium. Acta Histochem 1996; 98: 195-201.
-
Kria L, Ohira A, Amemiya T. TNP-470 (a fungus-derived
inhibitor of angiogenesis) reduces proliferation of cultured fibroblasts
isolated from primary pterygia: a possible drug therapy for pterygia. Curr Eye
Res 1998; 17: 986-993.
-
Laughrea PA, Arentsen JJ. Lamellar keratoplasty in the
management of recurrent pterygia. Ophthalm Surg 1986; 17: 106-108.
-
Lee S, Tseng S. Amniotic membrane transplantation for
persistent epithelial defects with ulceration. Am J Ophthalmol 1997; 123:
303-312.
-
Lee SB, Li DQ, Tan DT. Suppression of TGF-beta signaling in
both normal fibroblasts and pterygial body fibroblasts by amniotic membrane.
Curr Eye Res 2000; 20: 325-334.
-
Liddy BSL, Morgan JF. Triethylene thiophosphoramide (Thiotepa)
and pterygium. Amer J Ophthalmol 1966; 888-890.
-
Lin CP, Shih MH, Tsai MC. Clinical experiences of infectious
scleral ulceration: A complication of pterygium operation. Brit J Ophthalmol
1997; 81: 980-983.
-
Liu L, Yang D. Immunological studies on the pathogenesis of
pterygium. Chin Med Sci J 1993; 8: 84-88.
-
Ma DHK, See LC, Liau SB, et al. Amniotic membrane graft for
primary pterygium: comparison with conjunctival autograft and topical
mitomycin C treatment. Brit J Ophthalmol 2000; 84: 973-978.
-
Mackenzie FD, Hirst LW, Battistutta D, Green A. Risk analysis
in the development of pterygia. Ophthalmology 1992; 99: 1056-1061.
-
Magitot A. Étude critique sur certaines proprietés biologiques
du tissue cornéen et sur la kératoplastie humaine. Ann Ocul 1916; 153:
417-420.
-
Martínez, M. Examen nuevo de cirugía moderna. Madrid: Impr.
Pedro Marin. 1788.
-
Meacham R. Triethylene phosphoramide in the prevention of
recurrent pterygia. Amer J Ophthalmol 1962; 54: 751-753.
-
Merigot de Treigny P. Le ptérygion. In :Baillart et al. Traité
d’Ophtalmologie. París: Masson Éd. Tomo IV, 1939; pp. 625-632.
-
Mexía DLM. Tratado teórico-páctico de las enfermedades de los
ojos. Valladolid: Hermano Santander. 1814.
-
Momose A. Lyophilized human amniotic membrane «patching» for
ocular surface disorders. Ocular Surg News 2000; October: 144-146.
-
Monteiro-Grillo I, Gaspar L, Monteiro-Grillo M, et al.
Postoperative irradiation of primary or recurrent pterygium: results and
sequelae. Int J Radiation Oncology Biol Phys 2000; 48: 865-869.
-
Murube del Castillo J. Oftalmonomía saharaui. Anales Real Acad
Med Sta. Cruz de Tenerife. 1977; p. 129-162
-
Murube J. Pernal, carnabón o pterygion. La enfermedad
surfocular más frecuente de Canarias. Arch Soc Canar Oftalmol 2008; 19:
Editorial.
-
Mutlu FM, Sobaci G, Tatar TA. A comparative study of recurrent
pterygium surgery: limbal conjunctival autograft transplantation versus
mytomicin C, with conjunctival flap. Ophthalmology 1999; 106: 817-821.
-
Nolan TM, Di Girolamo N, Coroneo MT, Wakefield D.
Proliferative effects of heparin-binding epidermal growth factor-like growth
factor on pterygium epithelial cells and fibroblasts. Invest Ophthalmol Vis
Sci 2004; 45:110-113. TENGO. Non fala de Tratamiento y por ello non cítolu nel
textu.
-
Ojeda Guerra A, Martín Hernández R. Remedios oftalmológicos
populares de la tradición oral de Tenerife y La Palma. Arch Soc Canar Oftalmol
1976; 1: 89-94.
-
Pearlman G, Susal AL, Hushaw J, Bartlett RE. Recurrent
pterygium and treatment with lamellar keratoplasty with presentation of a
technique to limit recurrence. Ann Ophthalmol 1970; 2; 763-766.
-
Pérez Silguero MA, Ayala Barroso E, Herrera Piñero R, Callejón
G, Martín Conde JA, Álvarez Rubio L, Abreu Reyes P. ¿Es eficaz la Mitomicina C
en el tratamiento del pterigion primario? Arch Soc Canar Oftalmol 1986-1998;
9: 9-14.
-
Peris Martínez C. Transplante de membrana amniótica en la
reconstrucción de la superficie ocular. Thesis doctoralis. Universidad de
Valencia. Schola medicinae. Dirs.: Profs. Menezo y Díaz Llopis. 2003.
-
Pherwani A, Vakil V, Eatamadi H, et al. Postoperativew
subconjunctival 5-fluorouracil in the management of recurring pterygium Brit J
Ophthalmol 2007; 91: 398-399.
-
Pierse D, Casey TA. Lamellar keratoplasty. Brit J Ophthalmol
1959; 43: 733-743.
-
Plenk JJ. Doctrina de morbis oculorum. Nápoles: Vincentium
Perez. 1782.
-
Poirier RH, Fish JR. Lamellar keratoplasty for recurrent
pterygium. Ophthalmic Surg 1976; 7: 3-41.
-
Potério MB, Alves MR, Cardillo JA, José NK. An improved
surgical technique for pterygium excision with intraoperartive application of
mitomycin C. Ophthalmic Surg and Lasers 1998; 29: 685-687.
-
Prabhasawat P, Barton K, Burkett G, Tseng SC. Comparison of
conjunctival autografts, amniotic membrane grafts, and primary closure for
pterygium excision. Ophthalmology 1997; 104: 974-985.
-
Riordan-Eva P, Kielhorn I, Ficker LA, et al. Conjunctival
autografting in the surgical treatment of pterygium. Eye 1993; 7: 634-638.
-
Rodríguez López C, Cabrera López F. Comunicación personal.
-
Rodríguez Martín J, de Bonis Redondo E, Rodríguez Santana A,
González de la Rosa MA. Transplantede membrana amniótica en patología de la
superficie ocular. Arch Soc Canar Oftalmol 2001; 12: 101-107.
-
Rodríguez Martín J, Martín Barrera F, Arteaga Hernández V,
Abreu Reyes J, Aguilar Estévez J, González de la Rosa M. Transplante de limbo
en las patología surfocular. Arch Soc Canar Oftalmol 2003; 14: 71-76.
-
Rojas Álvarez E. Cirugía del pterigion: Una historia que aún
no termina. Arch Soc Españ Oftalmol 2008; 83: 333-334.
-
Rosenthal JW. Chronology of pterygium therapy. Amer J
Ophthalmol 1953; 36: 1601-1616.
-
Rubinfeld RS, Pfister RR, Stein RM, et al. Serious
complications of topical mitomycin-C after pterygium surgery. Ophthalmology
1992; 99: 1647-1654.
-
Saint-Yves. Nouveau traité des maladies des yeux. Amsterdam &
Leipzik : Arkstée & Merkus. 1767.
-
Schermer A, Galvin S, Sunn TT. Differentiation-related
expression of major 64k corneal keratin in vivo and in culture suggests limbal
location of corneal epithelial stem cells. J Cell Biol 1986; 103: 49-62.
-
Sennert D. Medicinae practicae libri V I. primera edición
Wittenberg. 1628-1635.
-
Shimazaki J, Yang HY, Tsubota K. Amniotic membrane
transplantation for ocular surface reconstruction in patients with chemical
and termal burns. Ophthalmology 1997; 104; 12: 2068-2076.
-
Shimazaki J, Shinozaki N, Tsubota K. Transplantation of
amniotic membrane and limbal autograft for patients with recurrent pterygium
associated with symblepharon. Br J Ophthalmol 1998; 82: 235-240.
-
Shimazaki J. Kosaka K, Shimmura S, Tsubota K. Amniotic
membrane transplantation with conjunctival autograft for recurrent pterygium.
Ophthalmology 2003; 110: 119-124.
-
Sing G, Wilson MR, Foster CS. Mytomycin eye drops as treatment
for pterygium. Ophthalmology 1988; 95: 813-821.
-
Solomon A, Pires RT, TsengSC. Amniotic membrane
transplantation after extensive removal of primary and recurrent pterygia.
Ophthalmology 2001; 108: 4494-60.
-
Srinivasan S, Dollin M, Rootman DS, Slomovic AR. Application
of fibrin glue to conjunctival autograft during primary pterygium surgery.
Annul meeting of the Amer Soc Cataract Refract Surg. Marzo 2006. San
Francisco, California.
-
Srinivasan S, Slomovic AR. Pterygium: current concepts and
treatment modalities. VISION Pan. America 2007; 6(1): 10-15.
-
Sugar SS. A surgical treatment for pterygium based on new
concepts as to its nature. Am J Ophthalmol 1949; 32: 912-916.
-
Susruta. Citado por Bidyadhar NK. Susruta and his ophthalmic
operation. Arch Ophthalmol 1939; 22: 550.
-
Tan DTH, Chee SP, Dear KBG, Lim ASM.E ffect of pterygium
morphology on pterygium recurrence in a controlled trial comparing
conjunctival autografting with bare scleral excision. Arch Ophthalmol 1997;
115: 1235-1240.
-
Tarr KH, Constable IJ. Late complications of pterygium
treatment. Brit J Ophhalmol 1980; 64: 496-505.
-
Thoft RA, Friend J. The X, Y, Z hypothesis of corneal
epithelial maintenance. [letter]. Invest Ophthalmol Vis Sci 1983; 24:
1442-1443.
-
Uy HS, Reyes JMG, Flores JDG, et al. Comparison of fibrin glue
and sutures fo attaching conjunctival autografts after pterygium excision.
Ophthalmology 2005; 112: 667-671.
-
van den Brenk HA. Results of prophylactic postoperative
irradiation in 1,300 cases of pterygium. Am J Roentgenol 1968; 103: 723-733.
-
Wu H, Chen G. Ciclosporina A y Tiothepa en prevención de las
recurrencias postoperatorias del pterygion. (en chino). Yan Ke Xue Bao 1999;
15: 91-92.
-
YanyaliAC, Talu H, Alp BN, et al. Intraoperative mitomycin C
in the treatment of pterygium. Cornea 2000; 19: 471-473.
-
Youngson RM. Recurrence of pterygium after excision. Brit J
Ophthalmol 1972a; 56: 120-125.
-
Ye J, Song YS, Kang SH, et al. Involvement of bone
marrow-derived stem and progenitor cells in the pathogenesis of pterygium. Eye
2004; 18: 839-843.
-
Zauberman H. Pterygium and its recurrence. Amer J Ophthalmol
1967; 63: 1780-1786.
NOTAS
Nota: En la
literatura norteamericana y lenguas influidas, que hoy marcan la terminología
del futuro, para la extirpación de un tejido suele usarse la palabra excision
(del latín excisio = corte, destrucción) con el significado de cortar y
eliminar. En lengua castellana (53) sólo existió con dicha raíz el adjetivo
sciso, con significado de cortado o roto. En el español actual del DRAE (54)
no existe el término excisión y sólo existe el término escisión (en latín
scissio expresaba corte, separación o división), al que se da el discutible
significado de extirpación de un tejido. En la evolución del castellano
(lengua que desaparecerá pronto, o ya prácticamente –aunque no políticamente-
desaparecida) al español, lo más apropiado sería adoptar en español escisión,
cuando se refiere al corte, e incorporar excisión cuando se refiere a la
extirpación del tejido.


