REVISIÓN ACTUALIZADA
Glaucoma pigmentario e iridotomía
láser. Criterios e indicaciones actuales
PINÓS J1, SABATER A2,
NAVARRO G2, MONTERO J3, AMSELEM L2, CARBONELL P2,
GONZALVO A2
1 Doctor
en Medicina. Departamento de Oftalmología. Hospital Casa de Salud de Valencia.
Consorcio Hospital General Universitario de Valencia. Departamento de Cirugía.
Facultad de Medicina. Universidad de Valencia. España.
2 Doctor en
Medicina. Departamento de Oftalmología. Hospital Casa de Salud de Valencia.
España.
3 Doctor en
Medicina. Departamento de Oftalmología. Hospital Casa de Salud de Valencia.
Consorcio Hospital General Universitario de Valencia. España.
RESUMEN
El propósito de la revisión actualizada es valorar la utilidad
de la iridotomía láser en el Glaucoma Pigmentario (GP).
Se revisan indicaciones, ventajas e inconvenientes de la
iridotomía láser en el GP; se revisan los criterios para su indicación y su
mecanismo de funcionamiento. Se considera la utilidad del procedimiento de la
iridotomía láser, valorando la disminución de liberación de gránulos de melanina
al humor acuoso, así como el cambio en la configuración iridiana y sus
relaciones anatómicas, revirtiendo la forma cóncava de la periferia media del
iris, consiguiendo la rotura del bloqueo pupilar inverso.
La iridotomía láser consigue el aplanamiento del iris, rompiendo
en la mayoría de casos, el bloqueo pupilar inverso. Esto hace disminuir la
dispersión de pigmento al humor acuoso y su depósito en la malla trabecular. No
obstante, si el daño trabecular es avanzado, la iridotomía no produce
disminución de la PIO.
INTRODUCCIÓN
Sugar y Barbour (1) fueron los primeros autores en describir un
paciente con Glaucoma Pigmentario (GP) en 1949.
El GP supone un 0,5% a 5% de la población glaucomatosa actual en
Estados Unidos (aproximadamente de 25.000 a 220.000 individuos afectados).
Aunque estudios de screening recientes de población insinúan que estas cifras no
son más que infraestimaciones de la situación real (2).
El GP se manifiesta de forma típica entre la tercera y cuarta
década de vida, sin demostrar una preponderancia clara de género, aunque la
expresión fenotípica es mayor en el varón, sobre todo en las edades más
tempranas. El diagnóstico inicial del GP suele ser anterior en el tiempo en el
varón (35 años), que en la mujer (46 años) (3).
El Glaucoma Pigmentario (GP) y el Síndrome de Dispersión
Pigmentaria (SDP) constituyen, posiblemente, dos estadios evolutivos diferentes
de una misma entidad nosológica única.
El GP se suele presentar con una tríada diagnóstica «clásica»
que consiste en:
-
Huso corneal de Krukemberg.
-
Defectos de transiluminación iridianos radiales.
-
Pigmentación intensa del trabeculum.
La evolución del proceso hace que, al iniciarse la presbicia, la
pérdida de la capacidad acomodativa y el aumento de tamaño del cristalino
empeoren la situación.
ETIOPATOGENIA DEL GLAUCOMA PIGMENTARIO
En el GP y SDP, la inserción iridiana es posterior a la
situación anatómica habitual, y la configuración del iris periférico tiende a
ser cóncava. El contacto iridozonular que aparece durante la acomodación, así
como con los movimientos normales del iris (miosis, midriasis) provoca el roce
mecánico del epitelio pigmentado de la cara posterior del iris, con la
consiguiente liberación de gránulos de melanina al humor acuoso. El mecanismo de
la elevación de la presión intraocular (PIO) en el GP y SDP es análogo al que se
desarrolla en el glaucoma pseudoexfoliativo.
En el GP se aprecia una morfología anatómica característica del
ángulo irido-corneal, en la que el iris se encuentra insertado más posterior a
lo habitual. Además de esta particularidad anatómica, se ha demostrado que
existe un gradiente de presiones inverso entre las cámaras anterior y posterior
(4). Estas dos situaciones conllevan a que, la mayor parte del tiempo, se
produzca un bloqueo pupilar inverso, adoptando el iris en su periferia media,
una morfología cóncava, que provoca un roce mecánico iris-cristalino-zónula
(mayor en los movimientos iridianos y acomodativos).
El roce sobre el epitelio pigmentado de la cara posterior del
iris provoca su daño, con dispersión de gránulos de melanina al humor acuoso,
que acaban depositándose en la malla trabecular a nivel del ángulo
irido-corneal. Esta situación, sin aumento de PIO, es lo que llamamos Síndrome
de Dispersión Pigmentaria (2,5,6).
Pavlin CJ, en 1994, propuso la acomodación como una de las
causas del SDP/GP (7). En su estudio demuestra mediante biomicroscopía
ultrasónica (BMU) que el cristalino se desplaza hacia delante, lo que provoca
que el humor acuoso continúe saliendo por la malla trabecular, pero de forma más
lenta de lo habitual. Esta situación hace que la PIO en la cámara anterior
aumente, y el gradiente de presiones entre las cámaras anterior y posterior
favorece la aparición del bloqueo pupilar inverso, que llevaría al aumento de la
concavidad iridiana posterior.
Aunque hay autores que relacionaban los picos tensionales con la
realización de ejercicio físico (8), en la mayoría de casos no es posible
determinar una relación evidente (9-11). Karickhoff JR afirma que: «… caminar,
ciertas posiciones de la cabeza o algunos movimientos oculares pueden crear la
suficiente diferencia en las presiones de las cámaras anterior y posterior, para
hacer que la válvula iridiana se abra o cierre», lo que provocaría el bloqueo
pupilar inverso, aumentando el roce irido-zonular. Esto no ha quedado demostrado
de forma fehaciente, pero Karickhoff fue el primero en establecer la patogenia
del SDP/GP (12).
Las vibraciones causadas en los obreros que manejan taladros de
percusión neumáticos también se han relacionado con la liberación de pigmento en
humor acuoso (13). Los pacientes de SDP/GP pueden sufrir elevaciones bruscas de
PIO tras la midriasis inducida farmacológicamente.
El depósito continuado de los gránulos de melanina bloquea (o al
menos, eso creemos) la dinámica de salida del humor acuoso, provocando un
aumento de la PIO, causando un Glaucoma Pigmentario (6,14).
El iris en estos casos presenta una concavidad posterior, que se
llama deflección iridiana posterior o negativa. Cuando la deflección es
positiva, el iris se arquea hacia delante hacia la cara posterior de la córnea,
adquiriendo una morfología convexa, como en los casos de iris bombé. La
deflección iridiana se mide por una línea imaginaria que marca la distancia
máxima del epitelio pigmentario a una línea que une el punto de contacto
cristaliniano más interno con la parte más externa en la raíz del iris (fig. 1).
El contacto iridolenticular es la distancia medida entre los
puntos de contacto de la cara posterior del iris con la cara anterior del
cristalino, interno (Punto 1 en la figura 1) y externo (Punto 2 en la figura 1).
Esta distancia solo puede ser medida mediante BMU o, de una manera mucho más
tosca, mediante otras pruebas de imagen, como ecografías modo B o TAC/RMN.
Fig. 1: Contacto iridolenticular: Esquema de las relaciones estructuras del
segmento anterior del ojo. (1) Punto de contacto irido-cristaliniano más
interno; (2) Punto de contacto irido-cristaliniano más externo; (3) Punto de
finalización del epitelio pigmentario en la raíz del iris; (4) Deflección
iridiana posterior o negativa: Distancia máxima del epitelio pigmentado del iris
con la línea imaginaria que une los puntos 1 y 3.
La situación no es explicable de forma completa recurriendo a
interpretaciones anatómicas simplistas, debiendo recurrir al uso de sofisticados
modelos matemáticos, que nos puedan hacer entender lo complejo del
funcionamiento de las estructuras tisulares implicadas (15).
Debemos considerar los efectos elasto-hidrodinámicos sobre la
dinámica del humor acuoso, la distribución de las presiones en las cámaras
anterior y posterior y en el contorno del iris. En estos modelos se deben tener
en cuenta que las paredes de las estructuras presentan comportamientos muy
diferentes, así el cristalino se comporta como una estructura sólida,
incompresible, mientras que la malla trabecular y el humor vítreo son sólidos
porosos, y la córnea actúa de forma elástica (fig. 2).
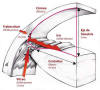
Fig. 2: Esquema de límites y dimensiones de los elementos del segmento anterior
del ojo para el establecimiento de un modelo matemático del comportamiento de
presiones y movilidad estructural.
El iris más grueso en los pacientes asiáticos o afroamericanos
lo hace ser menos flexible, evitando así el arqueo posterior del mismo y el roce
zonulo-lenticular (16). Los varones suelen tener el iris de mayor tamaño que las
mujeres, con lo que, al menos teóricamente, son más susceptibles para padecer
SDP/GP, ya que el contacto entre ambas estructuras se encuentra facilitado.
En el año 2002, Heys JJ et al (15), demuestran mediante un
modelo matemático que la profundidad de la cámara anterior sufre alteraciones
muy importantes durante el proceso de la acomodación, ocasionando del mismo modo
un aumento en la diferencia de presiones entre la cámara anterior y posterior.
Estos resultados quedan reflejados en la tabla 1.

Por otro lado, en el estudio citado se demuestra que otros
factores, como el lugar anatómico de la inserción iridiana, el módulo iridiano,
el tiempo durante el que se realizan los movimientos acomodativos, la rigidez
corneal (grosor: 0,5 mm y módulo: 10,3 MPa), la permeabilidad de la malla
trabecular, o la incompresibilidad (práctica) del humor acuoso, apenas tienen
efectos apreciables. La velocidad de adaptación del cristalino se considera
constante en el modelo (aunque esto no es cierto, depende de forma importante de
la edad y del estado acomodativo previo).
De todas formas no debemos olvidar que el modelo matemático
referido en el estudio citado es un ejercicio meramente teórico, bidimensional
de una situación real que está sujeta a muchos otros factores y variables,
muchos de ellos desconocidos en el momento actual; por lo que no debemos extraer
de él, conclusiones dogmáticas que compliquen aún más la ya suficientemente
complicada situación.
IRIDOTOMÍA LASER EN SDP/GP
En la actualidad, pensamos que la iridotomía láser puede
eliminar el bloqueo pupilar inverso, aplanando el iris en la periferia media,
reduciendo así el contacto iridozonular y el daño mecánico del epitelio
pigmentado (17).
En 1984, fue Badrudin Kurwa el primero en afirmar que la
iridotomía láser producía un aplanamiento iridiano periférico. Posteriormente,
David Campbell en el Meeting de la American Glaucoma Society celebrado en San
Diego (USA) confirmó los hallazgos del estudio mencionado (18,19).
En el año 1992, Karickhoff presentó dos estudios, corroborando
los hallazgos previos (12,20). Más tarde, en 1994, el grupo de Potash SD, Tello
C y Liebmann J coincidieron con todos los anteriores, pero fue Kanadani FN quien
confirmó por primera vez la situación con un estudio en el que se usa BMU (21).
En España, Méndez-Hernández C et al J confirmaron la configuración anatómica
característica del SDP/GP, mediante BMU en el año 2003 (22).
Objetivos de la iridotomía láser
Al permitir la comunicación entre las cámaras anterior y
posterior, igualando así el gradiente de presión intraocular entre ellas, la
iridotomía láser tiene los siguientes objetivos:
-
Revertir la concavidad iridiana periférica.
-
Reducir el roce irido-zonular-cristaliniano.
-
Reducir el daño mecánico al epitelio pigmentado del iris.
-
Reducir la dispersión de pigmento al humor acuoso.
Resultados de la iridotomía láser en
SDP/GP
Los estudios de Carassa RG et al, en cuatro pacientes con SDP
(23), a los que se realizó una iridotomía láser, demuestran que el procedimiento
provoca cambios importantes en la morfología de las estructuras del ángulo
iridocorneal, restaurando la morfología iridiana normal, consiguiendo la
rectificación de la concavidad iridiana periférica, reduciendo de esta forma el
contacto y roce irido-zonulo-lenticular.
Los resultados en cuanto a la deflección iridiana quedan
reflejados en la tabla 2.

Los resultados en relación al contacto irido-zonular-lenticular
se muestran en la tabla 3 (23).

En el SDP/GP se produce la liberación de pigmento al humor
acuoso que rellena las cámaras anterior y posterior, así como de forma similar
sucede en la pseudoexfoliación capsular y en el glaucoma pseudoexfoliativo.
El depósito en el trabeculum de los gránulos de melanina
liberados provoca la dificultad en la dinámica de salida del humor acuoso de la
cámara anterior, con la consiguiente elevación de la PIO (24).
Kuchle, usando el Laser Flare-Cell Meter Kowa FC-1000, valoró la
liberación de gránulos de melanina en el humor acuoso en casos de SDP, en dos
grupos de pacientes, en los que en el primero se realizó una iridotomía láser, y
en el segundo no, comparando la concentración de gránulos de melanina en 0,075 µ
litros de humor acuoso (24).
En los pacientes del segundo grupo, en el que se realizó la
iridotomía láser, se manifiesta una reducción del 65% (9,0 a 4,0) en la
liberación de gránulos de melanina desde el epitelio pigmentado del iris al
humor acuoso, lo que apoyaría el carácter beneficioso de la reversión del
bloqueo pupilar inverso por el procedimiento láser.
En ambos grupos del estudio también quedó demostrado que,
durante la midriasis farmacológica, se produce un aumento de casi el doble en la
liberación de gránulos de melanina.

En casos de traumatismos iridianos, en los que se disminuye el
área de roce mecánico iridozonular periférico, y la fricción tisular, se
«protege» en cierto modo de la dispersión de gránulos pigmentarios de melanina
del epitelio pigmentado. Del mismo modo, pacientes con colobomas iridianos lo
suficientemente extensos quedan «protegidos» del SDP/GP (25).
Reistad CE et al, en un estudio retrospectivo, expone que en
pacientes con GP la iridotomía láser disminuye la PIO 4,0 ± 5,4 mm Hg respecto
al grupo control no tratados con iridotomía en el que se reduce 1,9 ± 3.8 mm Hg
(14). Este estudio tiene como debilidad el ser retrospectivo, no randomizado, no
ciego y que la muestra de pacientes es demasiado pequeña para un análisis
estadístico formal. Sometiendo los datos a una observación más concienzuda, la
disminución de PIO encontrada deja de ser significativa. Si además consideramos
factores como la edad, raza o PIO basal, la diferencia de PIO hallada no es
valorable estadísticamente. Aunque no demuestre la utilidad real de la
iridotomía láser en GP/SDP, tampoco sugiere que su práctica sea inapropiada en
estos pacientes. Por lo tanto serían precisos estudios futuros adicionales para
aclarar estos aspectos.
Con la iridotomía láser no cabe esperar la normalización de
forma inmediata de la PIO elevada, ya que únicamente produce los efectos ya
reseñados de disminución de la liberación de gránulos de melanina al humor
acuoso. Esta disminución permite que la malla trabecular se limpie poco a poco
de la deposición pigmentaria (5).
En 1992, Karickhoff JR (12,20) demuestra que mediante la
realización de iridotomía láser en el GP se reduce de forma estadísticamente
significativa la incidencia de aumentos de PIO en los dos años siguientes a la
realización de la iridotomía.
Sin embargo, los hallazgos a largo plazo (10 años de evolución o
más) en otros estudios sobre el tema muestran resultados contradictorios. En
ningún caso se demuestra una efectividad clara de la iridotomía láser en la
disminución de PIO, encontrando, en muchos casos, en los pacientes tratados con
el procedimiento láser, condiciones similares a la evolución espontánea a largo
término (5,14,26-29).
CONCLUSIÓN
A la luz de los conocimientos actuales existen muchas incógnitas
no resueltas en cuanto al papel real de la iridotomía en el GP.
Entre otras, ¿por qué los varones jóvenes miopes tienen un
riesgo elevado de GP/SDP?, ¿existe alguna predisposición por grupo de sexo,
edad, etc. que no comprendemos?, ¿qué relación tiene el incremento de
degeneraciones retinianas en empalizada en el GP/SDP?, ¿existen otros factores
que no conocemos en la actualidad?
Si consideramos que la acomodación es el principal factor en los
complejos modelos matemáticos, ¿por qué hay poco GP, aunque todos acomodamos?
Los pacientes con GP suelen demostrar un gran rango acomodativo, pero ningún
estudio hasta la fecha ha podido relacionarlo de forma fehaciente con su
aparición.
La inserción iridiana más posterior es una ocurrencia normal en
el GP/SDP, pero en los modelos predictivos, apenas tiene significación como
factor de riesgo. ¿Cuál es el valor real de esta disposición estructural del
ángulo irido-corneal?
¿Hay algún otro factor de riesgo adicional que no valoramos? Se
ha postulado que el parpadeo intenso o muy frecuente puede influir de forma
significativa, abriendo y cerrando la válvula iridiana, en la génesis del
GP/SDP.
Se precisan nuevos estudios para aclarar todas estas situaciones
que en la actualidad no podemos explicar.
BIBLIOGRAFÍA
-
Sugar H, Barbour F. Pigmentary Glaucoma: A rare clinical
entity. Am J Ophthalmol 1949; 32: 90-92.
-
Ritch R, Steinberger D, Liebmann J. Prevalence of pigment
dispersion syndrome in a population undergoing glaucoma screening. Am J
Ophthalmol 1993; 117: 707-710.
-
Sugar HS. Pigmentary glaucoma. A 25-year review. Am J
Ophthalmol 1966; 62: 499-507.
-
Pillunat LE, Bohm A, Fuisting B, Kohlhaas M, Richard G.
[Ultrasound biomicroscopy in pigmentary glaucoma]. Ophthalmologe 2000; 97:
268-271.
-
Lehto I, Vesti E. Diagnosis and management of pigmentary
glaucoma. Curr Opin Ophthalmol 1998; 9: 61-64.
-
Farrar SM, Shields MB. Current concepts in pigmentary
glaucoma. Surv Ophthalmol 1993; 37: 233-252.
-
Pavlin CJ, Macken P, Trope G, Feldman F, Harasiewicz K, Foster
FS. Ultrasound biomicroscopic features of pigmentary glaucoma. Can J
Ophthalmol 1994; 29: 187-192.
-
Jensen PK, Nissen O, Kessing SV. Exercise and reversed
pupillary block in pigmentary glaucoma. Am J Ophthalmol 1995; 120: 110-112.
-
Schenker HI, Luntz MH, Kels B, Podos SM. Exercise-induced
increase of intraocular pressure in the pigmentary dispersion syndrome. Am J
Ophthalmol 1980; 89: 598-600.
-
Haynes WL, Johnson AT, Alward WL. Effects of jogging exercise
on patients with the pigmentary dispersion syndrome and pigmentary glaucoma.
Ophthalmology 1992; 99: 1096-1103.
-
Smith DL, Kao SF, Rabbani R, Musch DC. The effects of exercise
on intraocular pressure in pigmentary glaucoma patients. Ophthalmic Surg 1989;
20: 561-567.
-
Karickhoff JR. Pigmentary dispersion syndrome and pigmentary
glaucoma: a new mechanism concept, a new treatment, and a new technique.
Ophthalmic Surg 1992; 23: 269-277.
-
Mansour AM, Uwaydat SH, Khouri AS. Ocular sequelae of
pneumatic drills. Eye 2000; 14: 64-66.
-
Reistad CE, Shields MB, Campbell DG, Ritch R, Wang JC, Wand M.
The influence of peripheral iridotomy on the intraocular pressure course in
patients with pigmentary glaucoma. J Glaucoma 2005; 14: 255-259.
-
Heys JJ, Barocas VH. Computational evaluation of the role of
accommodation in pigmentary glaucoma. Invest Ophthalmol Vis Sci 2002; 43:
700-708.
-
Semple HC, Ball SF. Pigmentary glaucoma in the black
population. Am J Ophthalmol 1990; 109: 518-522.
-
Fourman S. Iridotomy in eyes with pigmentary glaucoma.
Ophthalmic Surg 1992; 23(12): 843-845.
-
Campbell DG, Boys-Smith JW. Pigmentary glaucoma. Trans New
Orleans Acad Ophthalmol 1985; 33: 102-110.
-
Campbell DG. Pigmentary dispersion and glaucoma. A new theory.
Arch Ophthalmol 1979; 97: 1667-1672.
-
Karickhoff JR. Reverse pupillary block in pigmentary glaucoma:
follow up and new developments. Ophthalmic Surg 1993; 24: 562-563.
-
Kanadani FN, Dorairaj S, Langlieb AMl. Ultrasound
biomicroscopy in asymmetric pigment dispersion syndrome and pigmentary
glaucoma. Arch Ophthalmol 2006; 124: 1573-1576.
-
Mendez-Hernandez C, Garcia-Feijoo J, Cuina-Sardina R,
Garcia-Sanchez J. [Ultrasound biomicroscopy in pigmentary glaucoma]. Arch Soc
Esp Oftalmol 2003; 78: 137-142.
-
Carassa RG, Bettin P, Fiori M, Brancato R. Nd:YAG laser
iridotomy in pigment dispersion syndrome: an ultrasound biomicroscopic study.
Br J Ophthalmol 1998; 82: 150-153.
-
Kuchle M, Nguyen NX, Mardin CY, Naumann GO. Effect of
neodymium:YAG laser iridotomy on number of aqueous melanin granules in primary
pigment dispersion syndrome. Graefes Arch Clin Exp Ophthalmol 2001; 239:
411-415.
-
Tesser PM. An iris coloboma preventing pigmentary glaucoma.
Arch Ophthalmol 2003; 121: 1055-1056.
-
Erdurmus M, Keskin UC, Karadag R, Yagci R. Response to laser
peripheral iridotomy and visual recovery in pigmentary glaucoma. J Glaucoma
2006; 15: 75.
-
Chen MJ, Lin SC. Effect of a YAG laser iridotomy on
intraocular pressure in pigmentary glaucoma. Br J Ophthalmol 2002; 86:
1443-1444.
-
Yang JW, Sakiyalak D, Krupin T. Pigmentary glaucoma. J
Glaucoma 2001; 10: S30-32.
-
Lehto I. Long-term prognosis of pigmentary glaucoma. Acta
Ophthalmol 1991; 69: 437-443.





