COMUNICACIÓN SOLICITADA
El papel de las combinaciones fijas en glaucoma
GARCÍA-SÁENZ S1, TOLEDANO FERNÁNDEZ N2
1 Doctora
en Medicina y Cirugía. Servicio de Oftalmología. Sección de Glaucoma. Hospital
Universitario de Móstoles. Madrid. España.
E-mail: sofgarsae@yahoo.com
2 Doctor en
Medicina. Hospital Universitario de Fuenlabrada. Hospital Madrid Norte
Sanchinarro. Madrid. España.
RESUMEN
El glaucoma es una enfermedad crónica que requiere tratamiento médico prolongado para evitar la progresión del daño neurológico. Muchas veces la causa de la no respuesta al tratamiento es el mal cumplimiento. Existen muchos causas de incumplimiento terapéutico como son los factores socio-demográficos, el desconocimiento de la enfermedad, y los relacionados con el propio tratamiento.
Los regímenes terapéuticos complicados, y la iatrogenia inducida por los colirios antiglaucomatosos junto con la no percepción de enfermedad en muchos casos, hace que la tasa de incumplimiento en glaucoma sea muy alta. Para intentar mejorar este factor han surgido en el mercado distintas combinaciones fijas de fármacos hipotensores oculares que mejoran la posología y disminuyen los efectos secundarios, todos, sin embargo, se combinan con un beta bloqueante, lo que limita su uso a pacientes en los que los betabloqueantes no estén contraindicados. Las combinaciones fijas aumentan el perfil de seguridad y tolerancia al tratamiento sin encarecerlo, se convierten en el momento actual en una buena alternativa terapéutica, pero también debemos tener en cuenta que no deben sustituir ni demorar otros tratamientos frente al glaucoma, como el láser o la cirugía, cuando sean necesarios.
Palabras claves: Cumplimiento, combinaciones fijas, perfil de seguridad, tolerancia, coste.
INTRODUCCIÓN
El glaucoma es una neuropatía óptica que se acompaña de una pérdida de Campo Visual (CV) típica y cuyo estadio final es la ceguera. Es la segunda causa de ceguera a nivel global (1); se trata de una enfermedad crónica que requiere tratamiento de por vida. Afecta a más de 50 millones de personas, causando más de 7 millones de ciegos bilaterales en el mundo (2).
La prevalencia del glaucoma es variable según los distintos estudios y rangos de edad que consideremos, así el estudio Segovia (3), hecho en España, determina que entre los 40 y 79 años la prevalencia del glaucoma es del 2,1% de la población. Este porcentaje aumenta a partir de los 80 años (4), observándose una prevalencia del 1,6-12,8%. Se sospecha además que el 50% de los pacientes glaucomatosos no están diagnosticados (5).
El principal factor de riesgo conocido del glaucoma es la presión intraocular (PIO) elevada; todos los tratamientos buscan su descenso. Existen fármacos antiglaucomatosos, que además de éste postulan otros mecanismos de acción secundarios como son la neuroprotección (6) y la intervención sobre el flujo ocular (7), pero sólo es el descenso de la PIO el que tiene un efecto terapéutico probado.
La PIO objetivo, según la definición actual de las guías de la Sociedad Europea de Glaucoma (SEG) (8), se puede describir como el nivel de PIO más alto del que se espera que prevenga un daño glaucomatoso futuro o que pueda disminuir la progresión de la enfermedad a un mínimo. Este nivel varía entre individuos y ojos y es estrictamente individual.
Las mismas guías dicen que por ello no podemos generalizar. Cada paciente debe ser individualizado y aunque la PIO basal es importante, también debemos considerar el daño estructural del nervio óptico (N.O.), el tipo de glaucoma de que se trata, la edad del paciente y otros factores sistémicos asociados; así, ante un paciente relativamente joven, debemos ser más exigentes en el descenso de la PIO, para garantizar una función visual útil durante toda su vida, que en un paciente anciano con menor esperanza de vida.
Existen distintos estudios multicéntricos que avalan esta individualidad en el tratamiento. Así, el OHTS (9) demuestra que un descenso de la PIO del 20% con respecto a la basal es suficiente para disminuir el riesgo de progresión campimétrica.
El estudio EMGT (10) habla de un 25% con respecto a la basal, el CNTGS (11) observa que un descenso de la PIO del 30% o mayor con respecto a la basal asocia menor incidencia de progresión de daño en el CV y que en algunos casos de GTN (Glaucoma de Tensión Normal) el daño se puede contener con PIO <12 mmHg. El estudio AGIS (12) ha demostrado que en pacientes con GPAA avanzado, disminuye la progresión del daño en el CV con PIO <18 mmHg.
Por último, un estudio de reciente publicación, el Canadian Glaucoma Study (CGS) (13) confirma la relación entre PIO y progresión en el seguimiento de pacientes con glaucoma con un riesgo relativo de 1,19 lo que indica que cada mm de Hg añadido, incrementa el riesgo de progresión en un 19%.
De acuerdo con las directrices de la SEG, 3.ª edición (8), con respecto al tratamiento, ante un paciente glaucomatoso el tratamiento inicial farmacológico será la monoterapia (siendo la primera elección más generalizada los análogos de las prostaglandinas (PG) o los betabloqueantes). En el caso de que la monoterapia no consiga alcanzar una reducción en la PIO satisfactoria, o sea mal tolerada, se deberá intentar otra monoterapia que tenga un mecanismo de acción diferente a la primera antes de añadir un segundo fármaco.
Sin embargo, hay casos en los que un solo fármaco es insuficiente para disminuir la PIO de un paciente hasta una presión objetivo deseable o hay evidencia de progresión y la presión objetivo es reconsiderada; en ese caso una terapia adyuvante puede ser iniciada (8).
En este punto, cuando el descenso de PIO no es satisfactorio, es el momento de iniciar un tratamiento combinado, con un segundo fármaco añadido.
El OHTS (9) demuestra que hasta un 60% de los pacientes tiene un buen control en monoterapia, pero que hay un 40% que requiere 2 o más fármacos y que de ésos hasta un 9% usan 3 o más medicaciones hipotensoras oculares.
Ante una posología complicada existe una menor adhesión al tratamiento, entendiendo adhesión como el cumplimiento de la toma del tratamiento tal y cómo se prescribió, así como la persistencia en el tiempo, es decir, la reposición de dicho tratamiento cuando éste se acabe (8,14). Esta falta de adhesión conlleva una menor eficacia terapéutica. Hacer más fácil el régimen de administración debería ser un objetivo prioritario para el oftalmólogo. A ello contribuyen las combinaciones fijas (CF) en glaucoma.
Aquí desarrollaremos cuales son las razones por las que han surgido las combinaciones fijas, así como su interés en el tratamiento actual del glaucoma.
EL PORQUÉ DE LA TERAPIA COMBINADA
El objetivo de las combinaciones fijas tiene idealmente dos vertientes, por un lado mantener o mejorar la eficacia hipotensora (15,16,17,18) del mismo tratamiento administrado por separado y por otro lado disminuir la yatrogenia (19). Al utilizarse una posología más cómoda y una menor cantidad de gotas, favorecemos el cumplimiento del tratamiento y minimizamos los efectos secundarios derivados del mismo, tanto aquellos que se producen a nivel local por el mismo principio activo (hiperemia, crecimiento de pestañas…) como por los conservantes presentes, como el cloruro de benzalconio; esto se ha comprobado al estudiar la expresión de receptores inflamatorios en la superficie ocular de pacientes con tratamiento crónico antiglaucomatoso (20), así como los posibles efectos sistémicos, especialmente asociados a los beta-bloqueantes (18).
TERAPIAS COMBINADAS EN GLAUCOMA
Existen en el mercado distintos fármacos antiglaucomatosos utilizados en monoterapia.
Aquellos que actúan disminuyendo la producción de Humor Acuoso (HA) (19,20), como es el caso de los beta-bloqueantes, al actuar sobre los receptores beta del cuerpo ciliar. El Betaxolol es B1 selectivo y por tanto más seguro en cuanto a efectos sistémicos, pero se ha observado que es menos efectivo que el resto de los beta bloqueantes no selectivos como lo son el timolol, levobunolol, carteolol y metipranolol, Estos reducen la PIO entre un 20 y un 27% (8), pero pueden inducir empeoramiento de patologías como la EPOC, el asma, bradicardias, cuadros confusionales y el ojo seco entre otros.
Los Inhibidores de la Anhidrasa Carbónica, como la dorzolamida y la brinzolamida, con una reducción media de la PIO del 17-20% (8). La tolerancia tópica, sobre todo de la dorzolamida, es regular. Ambas producen sabor amargo y pueden presentan algunos efectos sistémicos, sobre todo en casos de insuficiencia renal.
Los Agonistas a2-adrenérgicos, como la apraclonidina y la brimonidina, producen una reducción media de la PIO que va del 18 al 25% (8), Tienen un mecanismo de acción mixto ya que además de disminuir la producción de HA, también reducen la PIO al aumentar el flujo del HA por la vía convencional; su efecto secundario más significativo es su alto índice de alergia, que en el caso de la apraclonidina, llega a producir taquifilaxia hasta en un 45% de los pacientes a los 6 meses.
Los que aumentan el flujo uveoescleral como son los análogos de las PG, latanoprost y travoprost, clasificados como prodrogas, actúan sobre la metaloproteasa reestructurando la matriz extracelular del músculo ciliar; y el bimatoprost, un análogo a la prostamida F2a, que no es una prodroga, ya que actúa sobre receptores específicos diferentes a los de las PG pero también involucrados en el descenso de la PIO y por lo tanto con distinta posibilidad de respuesta entre pacientes (21,22). La eficacia reductora de la PIO tanto de los análogos de PG como del bimatoprost se mueve en un rango del 31 a 33% (35).
Por último están los agonistas colinérgicos como la pilocarpina, con efectos secundarios locales inaceptables en el momento actual como la miosis, pseudomiopización, disminución de Agudeza Visual (AV), riesgo de Desprendimiento de Retina (DR), iritis…, que han influido en la restricción de su uso.
Estos diferentes modos de acción hacen que los distintos fármacos puedan combinarse de muy diversas formas estableciendo regímenes terapéuticos muy variados. Como ya hemos visto hasta un 40% de los pacientes glaucomatosos están en tratamiento con 2 o más fármacos (9,15), por tanto cuánto más sencilla sea la posología, mejor será el cumplimiento y como luego veremos este es un factor fundamental en una enfermedad crónica como el glaucoma.
No todos los principios activos utilizados para el tratamiento del glaucoma son miscibles en un solo frasco, pero sí lo son con un beta-bloqueante, por lo que éstos forman parte de todas las combinaciones fijas existentes en el mercado y por lo tanto, todos aquellos pacientes en los que éstos están contraindicados, no son candidatos al tratamiento con combinaciones fijas.
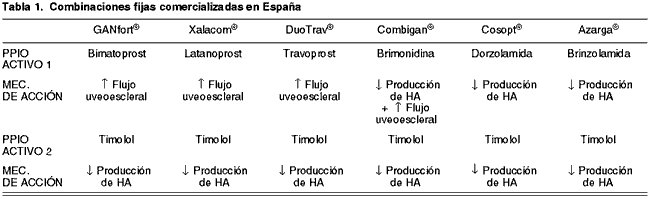
En España están disponibles en el momento actual distintas combinaciones fijas (tabla 1).
EL VALOR DE LAS TERAPIAS COMBINADAS EN GLAUCOMA
Favorecen el Cumplimiento
El glaucoma es una enfermedad crónica que requiere tratamiento de por vida. Por eso el cumplimiento es esencial para disminuir las secuelas de la enfermedad (15). El paciente que tiene un glaucoma mal controlado pero poco avanzado, no observa beneficio ni mejora en su patología al estar sometido a una politerapia de difícil cumplimiento, y sin embargo sí que percibe la yatrogenia derivada de la misma. Es sobre todo en estos pacientes en los que una simplificación en el régimen terapéutico facilitará el cumplimiento. Aquí tienen un gran papel las combinaciones fijas (23).
Muchas veces los pacientes no cumplidores se identifican con falsos no respondedores, con lo que se inician tratamientos alternativos, mono o politerapias, sin ninguna efectividad, pudiendo incluso llegar a la cirugía. En este tipo de pacientes también pueden resultar útiles las CF.
Factores asociados al mal cumplimiento (15)
Factores socio-demográficos
Parece demostrado que los hombres son menos cumplidores con su tratamiento que las mujeres y que un nivel socioeconómico bajo se asocia más frecuentemente a incumplimiento. No está clara la asociación con factores raciales, más bien parece existir una asociación con factores socioeconómicos y educacionales.
Los pacientes glaucomatosos son, en un alto porcentaje, personas de edad avanzada, con lo que frecuentemente refieren olvido al ponerse las gotas, o dificultades técnicas (24,25,26) al no saber instilarse el colirio, produciéndose frecuentemente pérdida de gotas (36%); otros pacientes refieren dificultad al apretar el bote de colirio, ya que por problemas óseos (artrosis, artritis…) se ven incapaces de generar la fuerza necesaria para ello.
En ocasiones es la dificultad en leer la etiqueta o en identificar el colirio lo que les impide el cumplimiento. También se ha observado que tan solo un 62% de los pacientes se instilan las gotas por si solos, dependiendo de alguien ajeno para poder cumplir el tratamiento, por lo que es conveniente implicar en el conocimiento del glaucoma y sus tratamiento a la familia y allegados. (27,28).
Conocimiento de la enfermedad
El conocimiento de la enfermedad tiene una correlación positiva con el cumplimiento. Se observa que cuanto más sabe el paciente de su enfermedad mejor sigue el tratamiento. Es por tanto muy importante la labor educativa del oftalmólogo y la habilidad de éste para crear un ambiente de confianza y comunicación que conviene con un paciente crónico (27,28).
Factores relacionados con la propia enfermedad
Pacientes con peor Agudeza Visual (AV) y con mayor afectación campimétrica siguen mejor las pautas del tratamiento prescrito que aquellos pacientes con menor daño percibido.
Factores relacionados con el tratamiento
Los regímenes terapéuticos sencillos favorecen el cumplimiento (9,22,23,24), de tal forma que cuando la frecuencia de instilación de las gotas es de una o como mucho dos veces al día, aumenta la tasa de cumplimiento y de adhesión al tratamiento. Cuando se hacen estudios comparativos de los distintos fármacos antiglaucomatosos (26), son el grupo de derivados de las PG los que tienen mayor tasa de cumplimiento y adhesión. Esto puede ser quizás por su comodidad posológica o por sus escasos efectos secundarios, o porque debido a su potente efecto hipotensor el propio oftalmólogo tiende a mantenerlos, aunque tengan como contrapartida un coste algo mayor.
Las combinaciones fijas, juegan por lo tanto un papel importante, ya que favorecen el cumplimiento y por ello aumentan la eficacia de los tratamientos basados en ellas.
El coste del tratamiento también influye en el cumplimiento (30,31), así como en la tolerancia de los efectos secundarios inducidos por el mismo.
La realidad es que, como el oftalmólogo ya sabe, el cumplimiento en el tratamiento oftalmológico es muy bajo y la percepción por parte del paciente de este bajo cumplimiento es menor a la realidad (24,25). Hay estudios realizados con maleato de timolol al 0,5% que presentan hasta un 30% de pacientes no cumplidores (32). Este porcentaje aumenta cuando la posología se hace más complicada, como por ejemplo cuando se prescribía la monoterapia con pilocarpina 4 veces al día (21).
Por lo tanto se debe tender a prescribir regímenes terapéuticos sencillos, en la medida de lo posible con frecuencias de instilación iguales o menores a dos veces al día para favorecer su cumplimiento.
También es un hecho probado que cuando se aproxima la cita de la revisión, el paciente mejora el cumplimiento en los días previos. Esto nos puede llevar a clasificar como cumplidor a un paciente que en realidad no lo es (25). Por tanto, ante un paciente con progresión campimétrica a pesar de haber conseguido la PIO objetivo en cada una de las visitas de control se debe sospechar incumplimiento y posible buen seguimiento del tratamiento los días previos a la cita (9).
Evitan el efecto de lavado
A los pacientes con politratamientos tópicos se les debe informar de la conveniencia de esperar entre las instilaciones al menos 5 minutos para evitar el efecto lavado (25). Las combinaciones fijas evitan este problema al instilarse ambas medicaciones en una sola gota.
Aumentan el perfil de seguridad y tolerancia al tratamiento
Cuando se combinan dos medicaciones hipotensoras en un solo colirio, disminuyen los posibles efectos secundarios de las medicaciones administradas en monoterapia. Así, se ha observado que el tratamiento con una CF de derivados de las PG + Beta-bloqueante produce menor hiperemia que la PG en monoterapia. Igualmente, no se ha observado que la hipertricosis ni la hiperpigmentación del iris sean mayores con las CF que con sus componentes administrados por separado (19,33).
Tampoco se ha observado daño endotelial ni engrosamiento corneal inducido por la CF con PG (33,34).
El conservante Cloruro de benzalconio disminuye su concentración en la CF comparado con su presencia en monoterapias que se administraran de forma consecutiva, disminuyendo por lo tanto la yatrogenia de las mismas.
De estar disponibles los preparados con combinaciones fijas de fármacos serían preferibles a dos instilaciones de los mismos agentes por separado. Esto mejoraría el cumplimiento por disminuir la frecuencia de la dosificación. Con combinaciones fijas, los ojos están expuestos a una cantidad diaria de conservante menor (8).
Disminuyen el coste del tratamiento
El coste de las medicaciones también influye en el cumplimiento; es de hecho un factor referido por los pacientes como causa de mal seguimiento terapéutico (30,31,34).
Teniendo en cuenta la frecuencia de la instilación de las CF, el tamaño de la gota a instilar según la CF de que se trate, y el tamaño del frasco de colirio, se ha observado que no todas las CF son igual de coste-efectivas (31,32).
El coste de las combinaciones fijas es muy similar al de las combinaciones no fijas, encontrándose una diferencia de entre 0 y 20 céntimos de euro más al día cuando se compara el coste diario de la CF frente al uso de los componentes de la combinación administrados por separado (considerando el timolol más barato disponible en el mercado). Esto puede influir en la toma de decisiones desde un punto de vista economicista a la hora de prescribir, ya que los beneficios obtenidos del uso de las CF compensan el coste adicional mínimo de las mismas.
CONCLUSIONES
El glaucoma es una enfermedad crónica en la que el cumplimiento terapéutico se hace fundamental para evitar la progresión del daño neurológico.
Se ha observado que regímenes terapéuticos sencillos facilitan este cumplimiento, y formando parte de esos regímenes están las combinaciones fijas de fármacos hipotensores oculares, útiles tanto para sustituir un tratamiento con combinaciones no fijas o cuando una monoterapia no es efectiva y se necesita un segundo fármaco añadido. Las combinaciones fijas han demostrado ser igual de efectivas o más que las combinaciones no fijas (15-17,35,36). Mejoran la calidad de vida del paciente al hacer más cómoda la posología. Disminuyen la yatrogenia inducida por la politerapia aumentando el perfil de seguridad; evitan el efecto de lavado y además suponen un mínimo coste farmacológico adicional comparado con el de la suma de los mismos principios activos en combinaciones no fijas.
La aparición de las CF ha supuesto un cambio en la forma de actuar del clínico oftalmólogo, se realizan menos trabeculectomías y menos tratamientos láser que hace 10 años. Esta nueva arma terapéutica, sin embargo no debe hacernos cambiar la indicación quirúrgica del paciente glaucomatoso. Debemos tener en cuenta que una CF es una politerapia de administración y posología cómodas, pero no un sustituto de la cirugía.
Es el tiempo el que nos dirá si estamos utilizando las CF de un modo correcto en relación con nuestros pacientes.
BIBLIOGRAFÍA
-
Resnikoff S, Pascolini D. Global data on visual impairment in the year 2002. Bull World Health Organ (2004); 82: 844-51.
-
Kosoko O, Quigley H A, Vitale S, Enger C, Kerrigan L, Tielsch JM. Risk factors for noncompliance with glaucoma follow-up visits in a residents’ eye clinic
Ophthalmology, Volume 105, Issue 11, 1 November 1998, Pages 2105-2111. -
Anton A, et al. Prevalence of primary open-angle glaucoma in a Spanish population: the Segovia study. J Glaucoma. 2004 Oct; 13(5): 371-6.
-
Hattenhauer MG, Johnson DH, Ing HH, Herman DC, Hodge DO, Yawn BP, Butterfield LC, Darryl T. The probability of blindness from open-angle glaucoma
Ophthalmology, Volume 105, Issue 11, 1 November 1998, Pages 2099-2104. -
Friedman, et al. «Prevalence of OAG among adults in the US». Arch Opht 2004; 122: 532-538.
-
Bluementhal EZ, Weinreb RN. Assessment of the retinal nerve fiber layer in clinical trials of glaucoma neuroprotection. Surv Ophthalmol. 2001 May; 45 Suppl 3: S305-12; discussion S332-4. Review.
-
Martinez A, Sanchez MA. Comparison of the effects of 0,005% latanoprost and fixed combination dorzolamide/timolol on retrobulbar haemodynamics in previously untreated glaucoma patients. Curr Med Res Opin. 2006; 22(1): 67-73.
-
European Glaucoma Society. Terminology and guidelines for glaucoma, 3rd Edition. 2008. Available on-line at http://www.eugs.org/ebook-new.asp
-
Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002; 120: 701-13.
-
Leske C, Heijl A, Hyman L, Bengtsson B, Dong L, Yang Z, EMGT Group. Predictors of long-term progression in the early manifest glaucoma trial. Ophthalmology 2007; 114: 1965-1972.
-
Collaborative normal tension glaucoma study group. Comparison of glaucomatous progression between untreated patients with normal tension glaucoma and patiens with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998; 126: 487-497.
-
The AGIS Investigators. The Advanced Glaucoma Intervention Study: The relationship between control onf intraocular pressure and visual field deterioration. Am J Ophthalmol 2000; 130: 429-440.
-
Chauhan B, et al. Canadian Glaucoma Study. Risk factors for the progression of Open -angle glaucoma. Arch. Ophthalmol 2008; 126: 1030-6.
-
Olthoff CMG, Schouten JS, van de Borne BW, Webers CA. Noncompliance with Ocular Hypotensive Treatment in patients with Glaucoma or Ocular Hypertension An Evidence-based Review. Ophthalmology 2005; Vol 1, 12: 953-961.
-
Sherwood MB. Twice dayly 0.2% brimonidine-0.5% timolol fixed combination therapy vs monotherapy with timolol or brimonidine in patients with glaucoma or ocular hypertension.a 12-month randomized trial. Arch Ophthalmol 2006; 124(9): 1230-8.
-
Goni FJ. Brimonidine/timolol Fixed combination Study Group. 12-week study comparing the fixed combination of brimonidine and timolol with concomitant use of the individual components in patiens with glaucoma and ocular hypertension. Eur J. Ophthalmol 2005; 15(5): 581-90.
-
Hommer A. Ganfort Investigators Group I. A double-masked, randomized, parallel comparison of a fixed combination of bimatoprost 0.03% timolol 0.5% with nonfixed combination use in patiens with glaucoma or ocular hypetension. Eur J Ophthalmol. 2007; 17(1): 53-62.
-
Bron A, Nordmann JP. Observational survey on the use of dual therapy in ocular hypertension or glaucoma treatment. J Fr Ophthalmol. 2006; 29(2): 164-8.
-
Dunker S, Schmucker A. Tolerability, quality of life, and persistency of use in patients with glaucoma who are switched to the fixed combination of latanoprost and timolol. Adv Ther. 2007; 24(2): 376-86.
-
Boudain C, et al. The Ocular Surface of Glaucoma Patients Treated over the Long Term Expresses Inflammatory Markers Related to Both T-Helper 1 and T-Helper 2 Pathways. Ophthalmology. Vol 115, Issue 1; Jan 2008: 109-115.
-
Higginbotham EJ, MD. The Efficacy and Safety of Unfixed and Fixed Combinations of Latanoprost and other Antiglaucoma Medications. Survey Ophthalmology 2002; Vol 47: (Suppl 1) S133-14.
-
Woodward DF et al. Prostamides (prostaglandin-ethanolamides) and their pharmacology. Br J Pharmacol. 2008 Feb; 153(3): 410-9. Epub 2007 Aug 27.
-
Soltau JB, Zimmerman TJ. Changing Paradigms in the Medical Treatment of Glaucoma. Survey Ophthalmology 2002; Vol 47: (Suppl 1) S2-S5.
-
Robin AL, Covert D. Does Adjunctive Glaucoma Therapy Affect Adherence to the Initial Primary Therapy? Ophthalmology 2005; 112: 863-868.
-
Winfield AJ. A study of the causes of non-compliance by patients prescribed eyedrops. Br. J. Ophthalmol 1990; 74: 477-480.
-
Sleath B. Patient-Reported Behavior and Problems Using Glaucoma Medications. Ophthalmology 2006; 113: 431-436.
-
Nesher R, Ezra-Nimni O. A Model for quantifying Difficulty in Squeezing Eyedrops From Their containers. Arch Ophthalmol 2007; 125: 1114-1117.
-
Haynes RB. Helping patients follow prescribed treatment clinical applications. JAMA (2002); 288: 2880-2883.
-
Roster DL. Effectiveness of interventions to improve patient compliance. A meta-analysis. Med Care 1998; 36: 1138-61.
-
Nordstrom BL. Persistence and Adherence With Topical Glaucoma Therapy.American Journal Ophthalmology. 2005. Vol 140. 598.e1-598.e11.
-
Ventura MP. Cost considerations of the new fixed combinations for glaucoma medical therapy. J Clin Pharm Ther. 2005; 30(3): 251-4.
-
Goldberg LD. Cost considerations in the medical management of glaucoma in the US. Estimated yearly costs and cost effectiveness of bimatoprost compared with other medications. Pharmacoeconomics. 2006; 24(3): 251-64.
-
Kass MA. Gordon and R E. Compliance with topical timolol treatment. Am J Ophthalmol (1987); 103: 188-193.
-
Frampton JE. Topical brimonidine 0.2%/timolol 0.5% ophthalmic solution: in glaucoma and ocular hypertension. Drugs Aging 2006; 23(9): 753-61.
-
Higginbotham EJ, et al. Latanoprost and timolol combination therapy vs monotherapy. Arch Ophthalmol 2002; 120: 915-22.
-
Brandt, Cantor, et al. Bimatoprost/timolol fixed combination: a 3-month double-masked, randomized parallel comparison to its individual components in patients with glaucoma or ocular hypertension. J J. Glaucoma 2008 Apr-May; 17(3): 211-6.
-
Craven, Walters, et al. Brimonidine and timolol fixed-combination therapy versus monotherapy: a 3-month randomized trial in patients with glaucoma or ocular hypertension. J Ocul Pharmacol Ther. 2005 Aug; 21(4): 337-48.