COMUNICACIÓN SOLICITADA
Infecciones en cirugía refractiva corneal con láser excímer
DE ROJAS V1, LLOVET F2, MARTÍNEZ M3, COBO-SORIANO R2, ORTEGA-USOBIAGA J4, BELTRÁN J5, BAVIERA J5
1 Doctora
en Medicina y Cirugía. Especialista en Oftalmología. Clínica Baviera - Instituto
Oftalmológico Europeo (A Coruña).
2 Doctor en Medicina y Cirugía. Especialista en Oftalmología. Clínica
Baviera - Instituto Oftalmológico Europeo (Madrid).
3 Licenciada en Medicina y Cirugía. Especialista en Oftalmología.
Clínica Baviera - Instituto Oftalmológico Europeo (Madrid).
4 Doctor en Medicina y Cirugía. Especialista en Oftalmología. Clínica
Baviera - Instituto Oftalmológico Europeo (Bilbao).
5 Licenciado en Medicina y Cirugía. Especialista en Oftalmología.
Clínica Baviera - Instituto Oftalmológico Europeo (Valencia).
RESUMEN
La cirugía refractiva corneal con láser excímer se ha convertido en el procedimiento de primera elección para la corrección de ametropías. El LASIK es actualmente la técnica preferida, por la rápida rehabilitación visual con una baja tasa de complicaciones, pero la popularidad de los procedimientos de ablación de superficie se encuentra en alza ya que son menos susceptibles de complicaciones relacionadas con el lentículo, el riesgo de ectasia es menor y su eficacia y seguridad están bien documentadas. Con cualquiera de estas técnicas existe preocupación sobre el desarrollo de queratitis infecciosa que aunque rara, es una complicación potencialmente grave. En esta revisión se analiza la incidencia, día de presentación, resultado de cultivos, factores de riesgo, síntomas de presentación, diagnóstico, tratamiento y agudeza visual final en infecciones después de LASIK y procedimientos de ablación de superficie. La incidencia de infección después de LASIK es baja, pero la tasa de infección después de ablación superficial es estadísticamente más elevada. Los gérmenes implicados con más frecuencia son gram positivos, probablemente procedentes de la flora de la superficie ocular, pero no se pueden descartar los gérmenes atípicos, por lo que es esencial el diagnóstico microbiológico, sobre todo en casos de LASIK. Dado que se trata de una complicación con consecuencias visuales potencialmente graves, se recomienda tratamiento tópico profiláctico en el postoperatorio, siendo las fluoroquinolonas de cuarta generación, especialmente moxifloxacino, los agentes de elección. La aparición de esta complicación en pacientes asintomáticos subraya la necesidad de un programa de revisiones postoperatorias adecuado. Se recomienda tratamiento agresivo y precoz de la infección con antibióticos fortificados, tras levantamiento del lentículo y lavado antibiótico de la interfase en el caso de LASIK. El levantamiento precoz del lentículo se asocia con una tendencia a mejores resultados visuales, menor tasa de leucomas y menor número de procedimientos de rehabilitación visual posterior. Con un tratamiento precoz y adecuado se pueden conseguir resultados visuales satisfactorios. En relación a los mismos, no hemos encontrado diferencias estadísticamente significativas entre la agudeza visual final tras infecciones después de ablación de superficie y después de LASIK, a pesar de que el tratamiento de las infecciones después de LASIK es más complejo. En cuanto a las infecciones por micobacterias tras LASIK, su tratamiento es complejo por el retraso en el diagnóstico, la resistencia a antibióticos convencionales, respuesta lenta al tratamiento, penetración inadecuada de los antibióticos y resistencia a terapia única.
Palabras clave: LASIK, ablación de superficie, fotoqueratectomía refractiva, LASEK, Epi-LASIK, queratitis infecciosa.
INTRODUCCIÓN
La cirugía refractiva corneal con láser excímer se ha convertido en el procedimiento de primera elección para la corrección de ametropías. El LASIK es actualmente el procedimiento preferido por la rápida rehabilitación visual con una baja tasa de complicaciones (1,2). Sin embargo, la queratitis infecciosa tras LASIK es una complicación grave que conlleva riesgo de pérdida de agudeza visual.
Las ablaciones de superficie incluyen fotoqueratectomía refractiva (PRK), LASEK y Epi-LASIK. La popularidad de este tipo de procedimientos se encuentra en alza ya que son menos susceptibles de complicaciones relacionadas con el lentículo, el riesgo de ectasia es menor y su eficacia y seguridad están bien documentadas (3-10). Sin embargo, el tiempo de recuperación visual es más prolongado y existe preocupación sobre el desarrollo de queratitis infecciosa que aunque rara, es una complicación potencialmente grave.
El objetivo de esta revisión es analizar la incidencia, día de presentación, resultado de cultivos, factores de riesgo, síntomas de presentación, diagnóstico, tratamiento y agudeza visual final en infecciones después de LASIK y procedimientos de ablación de superficie. Por sus características particulares, las infecciones por micobacterias tras LASIK se tratarán en un apartado diferenciado.
INCIDENCIA
La incidencia de este tipo de infecciones resulta difícil de estimar. Por ser raras, se requieren series muy largas de pacientes para calcular su incidencia y hasta muy recientemente, la mayor parte de publicaciones recogen series con casuística limitada.
LASIK
Dos series retrospectivas arrojan una incidencia de 2 casos en 1062 ojos (2) y 1 caso en 1019 procedimientos (1). El bajo número de casos no permite realizar un análisis integrado de los datos del cual extraer conclusiones útiles para su diagnóstico y tratamiento. Dos de las series más importantes incluyen 15 y 17 casos respectivamente derivados desde varios centros a instituciones de referencia de tercer nivel, lo que hace imposible calcular la incidencia (11,12).
Una revisión de la literatura realizada en el año 2004 concluye que la incidencia es variable (0,02%-1,5%) (13). Dicha revisión incluyó 103 infecciones de 87 pacientes en 42 artículos analizados. No obstante, muchos casos de infección pueden no ser publicados y estas cifras podrían infraestimar la tasa real de infecciones. Y por otra parte, los peores se publican más frecuentemente, sesgando por tanto los resultados finales de agudeza visual y secuelas.
La American Society of Cataract and Refractive Surgery (ASCRS) ha realizado encuestas de donde se han obtenido datos sobre incidencia y causas más frecuentes de infección. La incidencia calculada a partir de estas encuestas ha sido de 1 caso en 2.919 procedimientos (14) y 1 caso en 2.131 procedimientos (15). Estas estimaciones están sujetas sin embargo, al sesgo de «no respuesta» de encuestas con una tasa de respuesta menor del 66%.
Dado que la tasa de infección tras LASIK es baja, el análisis de series numerosas de casos provenientes de un mismo centro podrían revelar más datos sobre ciertos parámetros clínicos y proporcionar una mejor comprensión de la presentación, etiología y tratamiento de estas infecciones. Sin embargo, dada la baja incidencia de esta complicación, se precisarían muchos pacientes para poder extraer conclusiones útiles y tal número de casos es difícil de obtener de una sola institución. Series de este tipo se han publicado dos. Una de ellas encontró 10 casos de infección en 10.477 ojos (16) y la segunda, la más numerosa publicada hasta la fecha, ha encontrado 72 casos en 204.586 procedimientos (0.035%) (17) (tabla 1). En esta última, Llovet et al (17) han realizado un análisis retrospectivo de las infecciones después de LASIK que se han detectado en todos los centros de nuestra institución. Esta serie reúne las ventajas de los dos tipos de estudios anteriores. Por un lado, procede de una población lo suficientemente numerosa para estimar con exactitud la incidencia de una complicación poco frecuente. Ello permite además estudiar la tasa de infección en una situación donde la mayor parte de las variables implicadas están controladas ya que, aunque los pacientes fueron intervenidos en distintos centros de la misma institución, los protocolos pre, intra y postoperatorios seguidos por pacientes y cirujanos son los mismos. Por otro lado, la muestra de casos de infección es lo suficientemente numerosa para extraer conclusiones sobre resultado de cultivos, factores de riesgo, tratamiento y resultados visuales.

Ablación de superficie
Wroblewski (18) y Leccisotti (19) encontraron una incidencia de 5 casos en 25.337 procedimientos de PRK (0,019%) y 2 casos en 10.452 procedimientos (0,02%) respectivamente, mientras que Machat (20) y Oliveira (21) calcularon una incidencia de queratitis tras PRK de 1/1000 (0,1%) y 9/4492 (0,2%), respectivamente.
Como en las infecciones en LASIK, el escaso número de casos hace difícil realizar un análisis integrado y extraer conclusiones sobre diagnóstico y tratamiento. Dos series numerosas incluyen 13 y 16 casos respectivamente después de PRK, pero no especifican el número total de procedimientos lo que impide calcular la incidencia. La primera de ellas es una revisión de la literatura realizada en 2003 recoge 26 casos tras PRK (22), y la otra serie sólo proporciona información sobre resultado de cultivos (23).
En lo que se refiere a LASEK y Epi-LASIK, las únicas publicaciones de casos han sido anecdóticas: 5 casos después de LASEK (24-27) y 2 casos después de Epi-LASIK (28). La incidencia de infección después de estos procedimientos podría ser similar a la de PRK, dado que incluyen los mismos factores de riesgo para infección.
Recientemente hemos presentado la serie más numerosa de casos tras cirugía de superficie, que incluye 39 casos de 38 pacientes en 18651 procedimientos, lo que arroja una incidencia de un 0,2%, o de 1 caso en 500 procedimientos. Si tenemos sólo en cuenta los casos con cultivo positivo (13 casos), entonces la incidencia de infecciones probadas sería de un 0,06%. Aunque se excluyeron del estudio los casos compatibles con infiltrados estériles, tratándose de un estudio retrospectivo, sería posible que alguno de los casos con cultivo negativo no fuese de etiología infecciosa (de Rojas V, Llovet F, Martínez M, Beltrán J, Baviera J. Infectious keratitis in 18,651 laser surface ablation procedures. XXVIII Congress of the ESCRS. París, 4-8/IX/2010). La incidencia de infecciones totales es similar a la publicada por Machat (20) y de Oliveira (21), pero es 10 veces mayor que la estimada por Wroblewski (18) o Leccisotti (19). La razón de una menor tasa de infección en las series de Wroblewski y Leccisotti no está clara. Ambos son estudios retrospectivos y pueden no haberse recogido ciertos casos de infección. En particular, la serie de Wroblewski incluye los casos de infección tras cirugía de superficie en 6 centros de la Armada Americana y sería posible que infraestimase la incidencia si el paciente se destina a otro lugar. Por otro lado, nuestra tasa de infecciones tras LASIK es de las más bajas de la literatura. Dado que la institución, protocolos y período de estudio es el mismo, nuestra tasa de infección tras cirugía de superficie no debería ser mayor que la de otros centros. Esto también sugiere que las series que muestran menor tasa de infección tras cirugía de superficie podrían estar infraestimando la incidencia.
Todas las series mencionadas anteriormente incluyen pacientes tratados mediante PRK, mientras que nuestra serie incluye pacientes tratados ya sea mediante PRK o LASEK. Se han publicado pocos casos de infección después de LASEK (24,27). Sin embargo, asumimos que el riesgo de infección debería ser similar al de la PRK, por lo que hemos considerado la incidencia y características de presentación de ambos procedimientos de forma conjunta (tabla 2).
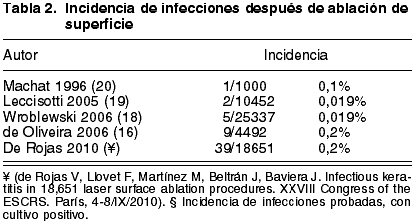
Parece pues que la incidencia de infección tras procedimientos de superficie podría ser mayor que la incidencia tras procedimientos de LASIK. Ciertamente, no resulta sorprendente por tres razones: en primer lugar, existe un defecto epitelial que tarda aproximadamente 4 días en cerrar; en segundo lugar, el empleo de una lente de contacto de porte prolongado incrementa el riesgo de queratitis infecciosa; y en tercer lugar, el uso de corticoides tópicos para controlar la respuesta de reparación tisular puede suprimir la capacidad del sistema inmune para luchar contra la infección. Si tenemos en cuenta que en una misma institución la tasa de infección tras LASIK es de 0,035% (17) y la tasa de infección tras ablación de superficie es de 0,2% para infecciones totales y 0,06% para infecciones probadas (de Rojas V, Llovet F, Martínez M, Beltrán J, Baviera J. Infectious keratitis in 18,651 laser surface ablation procedures. XXVIII Congress of the ESCRS. París, 4-8/IX/2010), ésta sería de 5,7 a 2 veces mayor (p<0,001 o p<0,05 test c2). Dado que la institución, los protocolos, los quirófanos y los cirujanos son los mismos, el único factor que puede explicar la diferencia en la tasa de infección es el tipo de cirugía en sí misma. Este hallazgo está de acuerdo con los resultados de un estudio previo en el que la tasa de infección tras LASIK fue de un 0,1% frente a 0,2% tras PRK (21). El análisis continuado de la seguridad y eficacia relativa de estos procedimientos es muy importante en relación con el consentimiento informado y la medicina basada en la evidencia.
TIEMPO DE PRESENTACIÓN DE LA INFECCIÓN TRAS LA CIRUGÍA
LASIK
Las infecciones después de LASIK se han clasificado en tempranas y tardías según se presenten en la primera semana o después de la primera semana tras el LASIK (13). Esta clasificación tiene utilidad de cara al tratamiento ya que el tiempo de inicio de los síntomas varía dependiendo del microorganismo causal. En la revisión de literatura realizada por Chang el 49,4% de las infecciones fueron precoces y el 50,6% tardías. Las infecciones por bacterias grampositivas tienen más tendencia a presentarse dentro de la primera semana después de LASIK mientras que las infecciones por micobacterias no tuberculosas se presentan con mayor frecuencia después de la primera semana (13). En nuestra serie el tiempo transcurrido desde la cirugía hasta el comienzo de los síntomas fue de 16±31 días (rango 1-180), siendo precoz en el 62,5% de los casos (17). No se detectó agrupamiento de casos.
Ablación de superficie
El tiempo entre la cirugía y la aparición de los primeros síntomas en cirugía de superficie es menor de una semana en la mayor parte de los casos (18,19,21,22). En nuestra serie, un 71,79% de los casos se presentaron en la primera semana, porcentaje mayor que en los casos de LASIK (de Rojas V, Llovet F, Martínez M, Beltrán J, Baviera J. Infectious keratitis in 18,651 laser surface ablation procedures. XXVIII Congress of the ESCRS. París, 4-8/IX/2010).
RESULTADO DE CULTIVOS
LASIK
Según una encuesta realizada por la ASCRS, los organismos implicados con más frecuencia en infecciones después de LASIK durante el año 2001 eran las micobacterias no tuberculosas (28% de los casos) seguidos de los estafilococos (20%) (14). Otra encuesta realizada en el año 2004 cuyos resultados se presentaron en la ASCRS 2005 mostró una disminución en el número de micobacterias no tuberculosas con sólo 2 casos comunicados. El 61% de los casos comunicados en esta encuesta fueron causados por estafilococos (15).
En una revisión de la literatura sobre los casos publicados de queratitis infecciosa tras LASIK, de los 100 casos con resultados de cultivo, un 47% habían sido causados por micobacterias no tuberculosas y un 19% por estafilococos (13). En la serie de 10 casos publicada por Moshirfar, la etiología más frecuente fueron también las micobacterias no tuberculosas seguidas de los estafilococos (16).
Los microorganismos encontrados en nuestra serie fueron todos grampositivos (21 casos de los 54 en los que se tomaron muestras; el resto mostraron resultado negativo). Las bacterias aisladas fueron: Staphylococcus epidermidis (9 casos), Streptococcus pneumoniae (8 casos), Streptococcus viridans (2 casos), Streptococcus pyogenes (1 caso) y Staphylococcus aureus (1 caso). No se detectó ningún caso de infección polimicrobiana ni ocasionada por micobacterias u hongos, pero no se pueden descartar en una situación con una tasa elevada de cultivos negativos. No obstante, la etiología fúngica no parece probable ya que no se precisó terapia antifúngica en ningún caso. El comienzo de los síntomas fue precoz en todos los casos con cultivo positivo, excepto en uno de ellos, en el que se produjo una desepitelización durante la cirugía con erosiones recidivantes posteriormente. Todos los casos con cultivo negativo tuvieron una presentación tardía (17). Garg et al (12) publicaron recientemente una serie de 17 casos de 15 pacientes. Los microorganismos aislados fueron hongos (4 ojos), Nocardia asteroides (5 ojos), micobacterias no tuberculosas (4 ojos), Acanthamoeba (2 ojos), Corynebacterium (1 ojo), Staphylococcus epidermidis (1 ojo). Nocardia, hongos y Acanthamoeba son causas raras de infecciones tras LASIK. Un análisis detallado de estos casos revela que las publicaciones sobre estos microorganismos poco comunes proceden de países con clima tropical. También es posible que siendo estudios que proceden de centros de tercer nivel, seleccionen las peores infecciones, es decir, que sólo aquellas que no responden a un tratamiento estándar de amplio espectro tienden a ser derivadas a centros de referencia (12). La etiología por gérmenes gram negativos es rara en todas las series (11,16,29,30).
Los resultados anteriores muestran que aunque en algunos estudios (13,14,16) se ha encontrado que las micobacterias no tuberculosas eran la causa más frecuente de infecciones tras LASIK, los más recientes han detectado un incremento en las infecciones causadas por estafilococos (15) y bacterias meticilín-resistentes después de LASIK (Kim TK. Cornea Day. ASCRS Congress. Chicago, 4-9/IV/2008). Este cambio puede reflejar la creciente toma de conciencia de la necesidad de realizar el LASIK en condiciones de asepsia adecuadas (31,32) (que explicaría la disminución de infecciones ocasionadas por micobacterias), convirtiéndose entonces la flora ocular del paciente en la principal fuente de microorganismos causantes de infección, como es habitual en otras infecciones en procedimientos oftalmológicos. El incremento en infecciones ocasionadas por S aureus meticilín-resistentes (MRSA) podría reflejar el incremento en la tasa de portadores de MRSA en la comunidad, como se ha documentado recientemente (33). Una tendencia similar hacia un incremento en el número de infecciones ocasionadas por MRSA ha sido puesto de manifiesto por Deramo et al en las endoftalmitis postoperatorias (34). Y como se expondrá en apartado de factores de riesgo, los trabajadores sanitarios presentan un mayor riesgo de infección por estafilococos meticilín–resistentes (35).
Ablación de superficie
En nuestro análisis de queratitis infecciosa tras ablaciones de superficie detectamos 39 casos de infección en 18.651 procedimientos. Se tomaron muestras en 27 casos, 13 de los cuales fueron positivos, todos para bacterias grampositivas: Staphylococcus species (9 casos: Staphylococos epidermidis, 1 caso; Staphylococcus aureus, 4 casos; Staphylococcus species, 4 casos), Pseudomonas species (1 caso) y Streptococcus pneumoniae (2 casos). Se identificó Cándida parasilopsis en un caso de la lente de contacto, pero no de la muestra corneal –posible contaminación– (de Rojas V, Llovet F, Martínez M, Beltrán J, Baviera J. Infectious keratitis in 18,651 laser surface ablation procedures. XXVIII Congress of the ESCRS. París, 4-8/IX/2010). Wroblewski detectó 4 casos de S. aureus incluyendo dos casos meticilín resistentes (18). De 16 casos de infecciones tras queratectomía refractiva publicados por Leal, todos fueron causados por microorganismos grampositivos excepto un caso producido por Penicillium (23). En la serie de 13 ojos con infección tras PRK publicados por Donnenfeld (22) todas las bacterias implicadas fueron grampositivas, en su mayoría estafilococos. Estos mismos autores realizaron una revisión de los casos publicados hasta ese momento en la literatura y encontraron como agentes causales: Mycobacterium chelonae (4), triple etiología fúngica (Acremonium, Penicilium, Aureobasidium), Scopulariopsis y Aspergillus. De los 10 casos restantes, 4 eran especies de estafilococos, 2 eran especies de estreptococos, y un caso de Pseudomonas aeruginosa.
Aunque estudios previos sobre infecciones relacionadas con lentes de contacto han documentado una elevada incidencia de infecciones por Pseudomonas aeruginosa (36), nuestra serie sólo muestra un caso y una revisión de la literatura otro caso más (22) en un paciente que no recibió antibióticos profilácticos. Se ha evaluado también la contaminación de lentes de contacto después de tres días en pacientes tratados mediante PRK y bajo profilaxis con antibióticos tópicos. El 7,4% fueron positivas para bacilos grampositivos y sólo en un caso se aisló una bacteria gramnegativa (1,2%) (37).
ORIGEN DE LOS GÉRMENES, FACTORES DE RIESGO Y PREVENCIÓN
LASIK
Los factores de riesgo potenciales asociados con las queratitis en LASIK publicados en la literatura incluyen blefaritis, ojo seco, defectos epiteliales, lentes de contacto terapéuticas y ambiente sanitario (11,13,15,17,35).
Se han considerado varias fuentes posibles de origen de los microorganismos que incluyen instrumental quirúrgico, manos del cirujano, factores ambientales y la flora de la superficie ocular y periocular. La tasa de contaminación de la interfase tras LASIK se ha evaluado en un estudio reciente en un 24,5% (38). Como en otros estudios de contaminación durante cirugía intraocular (39) el organismo aislado más frecuentemente fue el estafilococo. Esto no es sorprendente, ya que es parte de la flora normal de la conjuntiva y se cree que las bacterias que causan complicaciones quirúrgicas proceden de los párpados y la conjuntiva. Sin embargo, en 38,8% de los casos de contaminación, los cultivos de los márgenes palpebrales, conjuntiva e instrumentos fueron negativos, así que las causas de contaminación en estos casos no pudieron ser determinadas.
Las bacterias grampositivas más frecuentemente implicadas (S. aureus y estafilococo coagulasa-negativo) están generalmente asociadas a blefaritis. Se recomienda una exploración cuidadosa de los párpados para su detección y tratamiento antes de la cirugía con higiene palpebral, tetraciclinas orales y antibióticos tópicos.
La exposición al ambiente sanitario constituye un factor de riesgo para infecciones por estafilococos meticilín-resistentes tanto en LASIK como en PRK, según ha demostrado la publicación tanto de casos anecdóticos (16,40,41) como la de una serie reciente (35). Solomon et al publicaron una serie de 13 ojos en 12 pacientes intervenidos, 10 de LASIK y 2 de PRK, nueve de los cuales eran trabajadores sanitarios o estaban expuestos al ambiente sanitario (35). Los trabajadores sanitarios tienen una mayor prevalencia de colonización por S. aureus meticilín resistente que la población general. Sobre la base de estas series, en pacientes expuestos al ambiente sanitario se recomienda una profilaxis preoperatoria con higiene palpebral y bacitracina o fluoroquinolonas de cuarta generación y realizar una toma de muestra nasal para detectar portadores. Se recomienda además considerar el tratamiento monocular en caso de pacientes portadores (35).
Las infecciones por hongos y micobacterias están en general relacionadas con fallos en las medidas de esterilización y/o de técnicas intraoperatorias estériles. Se han publicado agrupaciones epidémicas de casos (todos causados por micobacterias no tuberculosas) en los que se encontró la fuente de la infección: Mycobacterium chelonae originado de una lente de contacto empleada como máscara durante la ablación (42); M. szulgai identificado en el hielo empleado para enfriar BSS en el campo quirúrgico (43); M. chelonae aislado del esterilizador portátil por vapor empleado para esterilizar el microqueratomo (44).
Factores tales como la inmunosupresión sistémica o diabetes no parecen aumentar el riesgo de infección tras LASIK (45).
Ablación superficial
Los factores de riesgo potenciales en infecciones en ablación de superficie publicados en la literatura tras ablación superficial incluyen blefaritis, manipulación de la lente de contacto (22) y el ambiente sanitario (35).
Tratamiento antibiótico profiláctico
En la actualidad, según se ha expuesto con anterioridad, el mayor riesgo lo representan los microorganismos grampositivos, y debido a los factores de riesgo asociados con las queratitis infecciosas, se recomienda el empleo de antibióticos profilácticos tras ablación de superficie. El tratamiento profiláctico con antibióticos de amplio espectro ha disminuido de forma significativa el número de casos con cultivo positivo en un modelo de contaminación de la interfase en cerdos (46). Un estudio reciente (47) ha analizado la susceptibilidad a los antibióticos de bacterias aisladas de pacientes que se iban someter a cirugía refractiva. Los microorganismos aislados fueron los siguientes: 85% estafilococos coagulasa-negativos, 2,3% S. aureus, 1,2% S. pneumoniae y 4,8% bacilos gram negativos. Los antibióticos más efectivos frente a estas bacterias fueron gemifloxacino, moxifloxacino y gatifloxacino.
Los antimicrobianos de elección son pues las fluoroquinolonas de cuarta generación. Proporcionan un amplio espectro de cobertura tanto para grampositivos como para gramnegativos (48) con baja toxicidad y buena penetración ocular (49), especialmente el moxifloxacino. Las fluoroquinolonas de cuarta generación son más eficaces frente a microorganismos resistentes a fluoroquinolonas anteriores (50), tienen mayor actividad frente a grampositivos, especialmente S. pneumoniae (48), así como mayor actividad frente a anaerobios (48) y micobacterias no tuberculosas (51,52).
Estas fluoroquinolonas presentan sin embargo dos puntos débiles en su cobertura. Primero, aunque tienen mayor actividad frente a MRSA que las fluoroquinolonas anteriores (50), su eficacia frente a MRSA es menor que frente a S. aureus meticilín-sensibles (MSSA) (53). Y segundo, pueden ser menos activas frente Pseudomonas aeruginosa que ciprofloxacino y no cubren Pseudomonas aeruginosa ciprofloxacín-resistente (53). De hecho, aunque escasos, se han publicado casos de resistencia clínica en estas dos situaciones (54).
SÍNTOMAS DE PRESENTACIÓN
LASIK
En nuestra serie se detectaron síntomas en el 54% de los pacientes, mientras que 9 casos fueron asintomáticos (17). En estos casos la infección se diagnosticó en una de las visitas postoperatorias de rutina, lo que pone de manifiesto la necesidad de un seguimiento adecuado de los pacientes. Dado que el 62,5% de los casos aparecen durante la primera semana y el 90,27% durante el primer mes, un esquema recomendable de visitas postoperatorias sería el siguiente: 1 día, 7 días, 1 mes y 3 meses. El 41,6% de los ojos sintomáticos presentaron dolor, 34,72% disminución de agudeza visual y 55,5% ojo rojo. Un 9,7% de los pacientes notaban fotofobia y un 28,83% se quejaron de epífora. Estas tasas son similares a las publicadas en una revisión de la literatura (13).
Ablación de superficie
Respecto a los casos de ablación de superficie, 11 ojos de 39 casos con infección eran asintomáticos. Un 71,79% de los casos aparecieron en la primera semana y 89,74% en el primer mes. Todo ello enfatiza la necesidad de realizar las revisiones de rutina en los tiempos apropiados. Los ojos sintomáticos presentaban dolor (48,71%), disminución de agudeza visual (69,23%), ojo rojo (46,15%), fotofobia (17,94%), epífora (25,64%) y molestias (56,41%) (de Rojas V, Llovet F, Martínez M, Beltrán J, Baviera J. Infectious keratitis in 18,651 laser surface ablation procedures. XXVIII Congress of the ESCRS. París, 4-8/IX/2010).
DIAGNÓSTICO
Diagnóstico clínico
LASIK
El principal signo de infección tras LASIK es la presencia de infiltrados focales en la interfase (13,17). Estos infiltrados deben diferenciarse de otras causas de queratitis tras LASIK, particularmente de queratitis lamelar difusa, pero también de infiltrados periféricos estériles o queratitis lamelar multifocal (16,55). Infecciones en la interfase pueden confundirse inicialmente con queratitis lamelar difusa, lo cual retrasa la instauración del tratamiento apropiado (56). El diagnóstico diferencial entre queratitis lamelar difusa y queratitis infecciosa es muy importante ya que precisan tratamientos diferentes. En la queratitis lamelar difusa el infiltrado es difuso, no presenta focos predominantes, está limitado a la interfase sin extenderse ni en el lecho estromal ni en lentículo. No hay reacción en cámara anterior ni dolor a diferencia de las queratitis infecciosas. No obstante conviene señalar que la queratitis lamelar difusa puede encontrarse asociada a un infiltrado infeccioso ya que representa una reacción inespecífica a cualquier estímulo inflamatorio en una córnea con estructura lamelar.
Ablación de superficie
En cuanto a la ablación de superficie, ocurre algo similar. El signo de la infección por excelencia es también la presencia de infiltrados que en el caso de ablación superficial deben diferenciarse de infiltrados estériles (relacionados con el uso de lente de contacto o utilización de antiinflamatorios no esteroideos tópicos). Estos últimos se localizan en periferia o media periferia, son pequeños (1-3 mm), sin reacción en cámara anterior. En la mayoría de los casos el epitelio se haya intacto o presenta mínima queratopatía y los infiltrados suelen localizarse fuera del área del defecto epitelial inducido por la cirugía (18,57).
Diagnóstico microbiológico
LASIK
La toma de muestras para cultivo es esencial en cualquier tipo de infección tras cirugía de superficie, pero especialmente después de LASIK. Los microorganismos implicados pueden ser atípicos, difíciles de predecir y no responder adecuadamente a tratamiento empírico. Además, la mayoría de las infecciones después de LASIK presentan infiltrados estromales multifocales que a veces no tienen las características clínicas clásicas tales como borde plumoso incluso si la etiología es fúngica (12). La obtención de muestras para cultivo proporciona otras ventajas aparte del diagnóstico microbiológico:
a) retirada de tejido infectado.
b) mejor penetración de antibióticos.
En el White Paper de la ASCRS sobre infecciones en LASIK se recomienda realizar toma de cultivo en agar sangre, agar chocolate, Sabouraud y caldo de tioglicolato. Si la infección se presenta más de 2 semanas tras LASIK se recomienda añadir medios para crecimiento de micobacterias no tuberculosas –Lowenstein-Jensen o Middlebrook 7H-9– además de los anteriores ya que este tipo de gérmenes tiende a presentarse de forma más tardía. Si la muestra es suficiente también se recomienda realizar extensiones para tinción con Gram, plata metenamina y Ziehl-Neelsen o auramina/rodamina para descartar patógenos poco frecuentes como Nocardia, micobacterias no tuberculosas y hongos. Si los cultivos fuesen negativos y ante un empeoramiento del curso de la infección, se debe considerar biopsia corneal o PCR (15).
Si el material es escaso debe tomarse una extensión más un medio de cultivo enriquecido (tioglicolato o caldo de infusión cerebro-corazón) y cuando sea posible, una extensión más o un agar (23).
Ablaciones de superficie
Como hemos expuesto anteriormente, la mayor parte de las infecciones tras cirugía de superficie están ocasionadas por bacterias grampositivas, pero se han publicado casos ocasionados por hongos y micobacterias, aunque con menos frecuencia que en cirugía LASIK. Por ello conviene incluir placas específicas para estos microorganismos. En el caso de ablación de superficie se recomienda además realizar el cultivo de la lente de contacto en caldo de tioglicolato (21).
TRATAMIENTO
LASIK
El tratamiento de las infecciones después de LASIK no es sencillo. Los microorganismos atípicos bajo un lentículo suponen un desafío diagnóstico y terapéutico. La localización en la interfase hace más difícil el acceso para la toma de muestras y no permite la adecuada penetración de los antibióticos. El tratamiento empírico sin previa toma de muestras no está recomendado ya que algunos de las bacterias implicados no responden al tratamiento convencional. Por ello se recomienda una actitud terapéutica agresiva con levantamiento inmediato del lentículo, toma de muestra para cultivo y extensiones y lavado de la interfase con antibióticos (vancomicina fortificada 50 mg/ml para infecciones de comienzo precoz y amikacina fortificada 35 mg/ml para infecciones de comienzo tardío) (15). El tratamiento mediante levantamiento inicial del lentículo se asocia con mejores resultados visuales, menos leucomas residuales y menor número de procedimientos de rehabilitación visual que el tratamiento inicial con antibióticos tópicos (13) (Llovet F, de Rojas V, Martínez M, Baviera J. Queratitis infecciosa tras LASIK: Actitud terapéutica. 25 Congreso SECOIR. Cádiz, 19-22/V//2010). En nuestra serie además, 10 de los 18 casos inicialmente tratados con tratamiento tópico sin irrigación de la interfase, precisaron posteriormente levantamiento del lentículo y lavado con antibióticos (17).
El tratamiento se inicia luego de forma empírica según las pautas descritas a continuación y/o guiados por los resultados de la tinción de las extensiones si fue posible realizarlas. La modificación del tratamiento se basa en la respuesta clínica y los resultados de los cultivos. El White Paper de la ASCRS recomienda distintas combinaciones según la infección sea de comienzo precoz o tardío (fig. 1). Este tratamiento no cubre infecciones por hongos, por lo que el resultado ha de modificarse luego según los resultados de los cultivos (15).

Fig. 1. Recomendaciones de tratamiento en infecciones después
de LASIK según el White Paper de la ASCRS (15).
Se recomienda añadir doxiciclina oral (100 mg, dos veces al día) porque inhíbe la producción de colagenasas y suspender los corticoides tópicos.
Amputación del flap
Existen ocasiones en las que a pesar de un tratamiento adecuado, se requiere la amputación del lentículo. El lentículo por un lado, no permite la penetración adecuada de los antibióticos y una vez que se vuelve necrótico, no sólo pierde todas sus cualidades ópticas, sino que sirve de refugio a los microorganismos, lo cual dificulta el éxito del tratamiento. La amputación del lentículo no es infrecuente en infecciones después de LASIK (13,15) especialmente cuando están implicados bacterias atípicas o agresivas. En la revisión de la literatura de 103 infecciones, se amputaron 37 lentículos (13), la mayor parte en infecciones causadas por micobacterias o microorganismos agresivos. Las series referentes a agrupaciones epidémicas de micobacterias no tuberculosas muestran que casi el 50% de los ojos afectados requirieron amputación del lentículo (42-44). En la serie de Karp (11) 5 de 15 ojos con infecciones post-LASIK –todas ellas causadas por micobacterias no tuberculosas– precisaron amputación del lentículo. En las publicaciones de Moshirfar et al (16,54) un caso de queratitis causada por P. aeruginosa de un total de 10 ojos con queratitis infecciosa requirió amputación del lentículo (16) así como un caso de infección por MRSA (54). En el estudio de Solomon et al (35), dos lentículos tuvieron que ser amputados en 12 casos de infecciones por MRSA y en nuestro estudio el caso que requirió amputación estaba causado por un S. pneumoniae (17).
En las situaciones en las que es necesario amputar el flap, el tejido corneal escindido debe remitirse para su análisis anatomopatológico con tinciones adecuadas (hematoxilina–eosina, PAS, Ziehl-Neelsen) con el fin de identificar el microorganismo si no fue posible aislarlo con anterioridad.
Queratoplastias
Entre un 10 (58) y un 14,5% (13) de las infecciones después de LASIK requieren tratamiento quirúrgico mediante queratoplastia.
Enucleación
Se han descrito tres casos en la literatura que precisaron enucleación, uno en la encuesta de la ASCRS (14) y dos en la serie de Karp et al (11), provocados uno de ellos por Acanthamoeba y el otro por Fusarium oxysporum.
Ablación de superficie
En infecciones de superficie, tras la retirada de la lente de contacto y toma de muestras para cultivo, se recomienda iniciar tratamiento tópico con una combinación de antibióticos de amplio espectro, teniendo en cuenta que los microorganismos causales más frecuentes son los grampositivos. Se puede recomendar la misma pauta que la expuesta en el apartado anterior para infecciones de comienzo precoz. Conviene así mismo añadir doxiciclina oral (100 mg/cada 12 horas) para inhibir las colagenasas.
Queratoplastias
En nuestra serie los 39 casos de infección se resolvieron con tratamiento médico pero un caso precisó queratoplastia para rehabilitación visual. Uno de trece casos (22) y 1 de 2 casos (19) precisaron también queratoplastia en dos series previas.
RESULTADOS VISUALES
LASIK
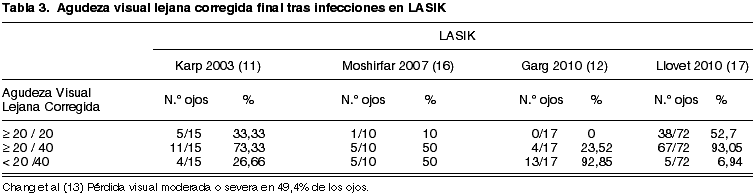
La agudeza visual final después del tratamiento de infecciones tras LASIK varía según las series (tabla 3). Nuestra serie (17) muestra resultados mejores que los publicados previamente (11,13,16). Varios factores pueden explicar la diferencia. En primer lugar los resultados de Karp et al (11), Garg et al (12) y Chang et al (13), derivan del análisis de publicaciones o series de casos referidos a centros de tercer nivel respectivamente por lo que puede que se seleccionen los peores casos y los resultados estén sesgados; en segundo lugar, en nuestro estudio no hemos detectado casos de infecciones fúngicas o por micobacterias, que tienen mucho peor pronóstico que las causadas por gram positivos (11-13). Nuestros resultados también son mejores que los de Moshirfar (16). Este grupo mostró en sus resultados que sólo un 30% de los ojos alcanzaron un 20/40 de agudeza visual y sólo un 20% de los ojos llegaron a 20/20. Otra vez en esta serie, 4 de 10 casos estaban causados por micobacterias y hubo también 2 infecciones polimicrobianas, una producida por micobacterias y otra por Alternaria (16).
Ablación de superficie
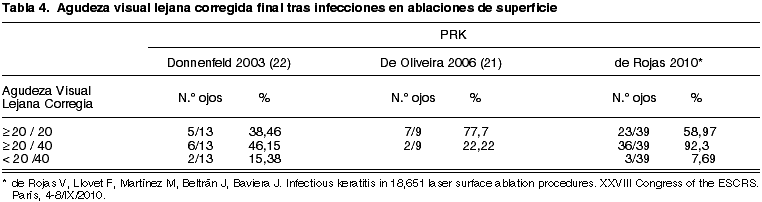
Los resultados visuales finales de nuestra serie de infecciones en ablación de superficie son iguales o ligeramente mejores que los publicados por otros autores (tabla 4).
En relación a los resultados visuales, no hemos encontrado diferencias estadísticamente significativas entre la agudeza visual final tras infecciones después de ablación de superficie (de Rojas V, Llovet F, Martínez M, Beltrán J, Baviera J. Infectious keratitis in 18,651 laser surface ablation procedures. XXVIII Congress of the ESCRS. París, 4-8/IX/2010) y después de LASIK (17) (p=0,901; test Mann-Whitney) (fig. 2), a pesar de que el tratamiento de las infecciones después de LASIK es más complejo.
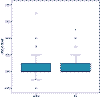
Fig. 2. Comparación de la agudeza visual lejana corregida
(AVLC) final (log MAR) después de infecciones en LASIK (17) y cirugía de
superficie (AS). * (de Rojas V, Llovet F, Martínez M, Beltrán J, Baviera J.
Infectious keratitis in 18,651 laser surface ablation procedures. XXVIII
Congress of the ESCRS. París, 4-8/IX/2010).
QUERATITIS POR MICOBACTERIAS NO TUBERCULOSAS DESPUÉS DE LASIK
Las infecciones después de LASIK ocasionadas por micobacterias no tuberculosas merecen una consideración especial. Como veremos a continuación, su tratamiento es complejo por el retraso en el diagnóstico, la resistencia a antibióticos convencionales, respuesta lenta al tratamiento, penetración inadecuada de los antibióticos y resistencia a terapia única (58).
Aunque actualmente se ha detectado una tendencia hacia bacterias grampositivas como principal causa de infecciones en LASIK (15,17), estudios anteriores han encontrado que las micobacterias no tuberculosas fueron en su momento, los microorganismos más frecuentemente implicados en infecciones en LASIK (13, 14,16,58).
Las micobacterias no tuberculosas son microorganismos ubicuos que se encuentran en el suelo, el agua y los alimentos (59) y la contaminación intraoperatoria se ha propuesto como la fuente más probable de infecciones en LASIK (60,61). Se han descrito al menos cuatro brotes epidémicos de infecciones por micobacterias después de LASIK (15,42-44) lo cual demuestra la importancia de la adecuada esterilización del instrumental y la necesidad de utilizar técnicas estériles intraoperatorias así como de realizar la cirugía en quirófano. Es posible que la toma de conciencia de estos puntos tenga un papel en el descenso del porcentaje de infecciones de esta etiología observado en los últimos estudios.
Una revisión de la literatura del año 2005 (58) identificó 50 casos confirmados mediante cultivo de infecciones ocasionadas por micobacterias (66% Mycobacterium chelonae, 14% Mycobacterium abscesos, 10% Mycobacterium szulgai; 4% Mycobacterium mucogenicum; 4% Mycobacterium fortuitum y 2% Mycobaterium terrae). El tiempo de inicio de los síntomas varió de 3 días a 6 meses. El tiempo medio de aparición de las infecciones por M. szulgai, de crecimiento lento fue de 2,5 meses, mientras que el de las micobacterias de crecimiento rápido fue de 3,4 semanas. El tiempo de presentación medio de todas ellas es mayor que el de presentación de infecciones ocasionadas por hongos u otras bacterias (11-13). El tiempo medio hasta en comienzo fue de 21,17 días –de 10 a 65 días–. El curso clínico es más larvado y menos sintomático que el de las infecciones causadas por otras bacterias, lo que hace que se diagnostiquen de forma más tardía y se confundan en ocasiones con queratitis lamelar difusa (58). Para el diagnóstico microbiológico se requiere la toma de muestras para cultivo y extensiones en medios adecuados y con tinciones específicas. Las tinciones apropiadas son Ziehl-Neelsen o tinciones fluorocromas (auramina, rodamina) y los medios el Löwenstein-Jensen o Middlebrook. La PCR no se realiza de rutina pero puede considerarse en casos de sospecha con cultivos negativos y la electroforesis puede emplearse en casos de brotes epidémicos para comparar los microorganismos aislados y estudiar el origen de la contaminación (42,43).
La queratitis por micobacterias es más difícil de tratar que otros tipos de queratitis bacteriana y a menudo requiere tratamiento combinado. En el pasado la amikacina se consideraba el tratamiento de elección para queratitis por micobacterias (62). Sin embargo, la amikacina tuvo una elevada tasa de fracaso en tratamiento (60%) (63) por su mala penetración a través del epitelio intacto (64). La amikacina se ha empleado a menudo en combinación con claritromicina, pero el empleo de la misma está limitado por su toxicidad y mala tolerancia (63). Se ha usado también azitromicina tópica (42). El ciprofloxacino se ha empleado como alternativa o en combinación con antibióticos fortificados y constituyó un tratamiento de primera línea para varias infecciones corneales, aunque las resistencias se han convertido en un factor limitante (65). Las fluoroquinolonas de cuarta generación, especialmente moxifloxacino, tienen ventajas significativas sobre las fluoroquinolonas de generaciones anteriores en el tratamiento de infecciones por micobacterias, incluyendo una actividad bactericida superior, mayor concentración corneal y disminución de la tasa de resistencias (66-68) y tienen acción sinérgica con claritromicina (69).
No obstante, es conveniente tener en cuenta que existen ciertos indicios de resistencia detectados en clínica y en laboratorio de algunas cepas a fluoroquinolonas de cuarta generación (70-72). Los corticoides deben suspenderse durante la infección activa ya que prolongan y empeoran el curso de la infección (63).
Por todo lo expuesto anteriormente, la mayoría de los casos de infecciones por micobacterias no tuberculosas (49%) precisan tratamiento con varios antibióticos simultáneamente (58) y se recomienda iniciar el tratamiento con terapia triple según lo indicado en la tabla 5, añadiendo tratamiento con antibióticos orales (claritromicina o doxiciclina). El tiempo desde el diagnóstico hasta la resolución de los síntomas es prolongado, 71,5 días de media (11). En la revisión de literatura realizada por John, un 54% de los casos precisaron amputación del lentículo y 4 requirieron queratoplastia (58).

CONCLUSIONES
Las infecciones después de LASIK son raras, pero las infecciones después de ablación superficial son estadísticamente más frecuentes. Los microorganismos implicados con más frecuencia son grampositivos, probablemente procedentes de la flora de la superficie ocular, pero no se pueden descartar los microorganismos atípicos, por lo que es esencial el diagnóstico microbiológico, sobre todo en casos de LASIK. Dado que se trata de una complicación con consecuencias visuales potencialmente graves, se recomienda tratamiento tópico profiláctico en el postoperatorio, siendo las fluoroquinolonas de cuarta generación, especialmente moxifloxacino los agentes de elección. La aparición de esta complicación en pacientes asintomáticos subraya la necesidad de un programa de revisiones postoperatorias adecuado. Se recomienda tratamiento agresivo y precoz de la infección con antibióticos fortificados, tras levantamiento del lentículo y lavado antibiótico de la interfase en el caso de LASIK. El levantamiento precoz del lentículo en el caso de LASIK se asocia con una tendencia a mejores resultados visuales, menor tasa de leucomas y menor número de procedimientos de rehabilitación visual posterior. Con un tratamiento precoz y adecuado se pueden conseguir resultados visuales satisfactorios.
BIBLIOGRAFÍA
-
Lin RT, Maloney RK. Flap complications associated with lamellar refractive surgery. Am J Ophthalmol 1999; 127: 129-136.
-
Stulting RD, Carr JD, Thomppson KP, Waring GO 3rd, Wiley WM, Walker JG. Complications of laser in situ keratomileusis for the correction of myopia. Ophthalmology 1999; 106: 13-20.
-
Randleman J, Woodward M, Lynn M, Stulting RD. Risk assessment for ectasia after corneal refractive surgery. Ophthalmology 2008; 15: 37-50.
-
Teus MA, de Benito-Llopis L, García-González M. Comparison of visual results between laser-assisted subepithelial keratectomy and epipolis laser in situ keratomileusis to correct myopia and myopic astigmatism. Am J Ophthalmol 2008; 46: 357-362.
-
Hondur A, Bilgihan K, Hasanreisoglu B. A prospective bilateral comparison of epi-LASIK and LASEK for myopia. J Refract Surg 2008; 24: 928-934.
-
Tobaigy FM, Ghanem RC, Sayegh RR, Hallak JA, Azar DT. A control-matched comparison of laser epithelial keratomileusis and laser in situ keratomileusis for low to moderate myopia. Am J Ophthalmol 2006; 142: 901-908.
-
Salz JJ, Maguen E, Nesburn AB, Warren C, Macy JI, Hofbauer JD, Papaioannou T, Berlin M. A two-year experience with excimer laser photorefractive keratectomy for myopia. Ophthalmology 1993; 100: 873-882.
-
Seiler T, Wollensak J. Myopic photorefractive keratectomy with the excimer laser. One-year follow-up. Ophthalmology 1991; 98: 1156-1163.
-
Wallau AD, Campos M. One-year outcomes of a bilateral randomised prospective clinical trial comparing PRK with mitomycin C and LASIK. Br J Ophthalmol 2009; 93: 1634-1638.
-
Randleman J, Loft E, Banning C Lynn MJ, Stulting RD. Outcomes of wavefront-optimized surface ablation Ophthalmology 2007;114; 983-988.
-
Karp CL, Tuli SS, Yoo SH, Vroman DT, Alfonso EC, Huang AH, Pflugfelder SC, Culbertson WW. Infectious keratitis afer LASIK. Ophthalmology 2003; 110: 503-510.
-
Garg P, Chaurasia S, Vaddavalli PK, Muralidhar R, Mittal V, Gopinathan U. Microbial keratitis after LASIK. J Refract Surg 2010; 26: 209-216.
-
Chang MA, Jain S, Azar DT. Infections following laser in situ keratomileusis: an integration of the published literature. Surv Ophthalmol 2004; 49: 269-280.
-
Solomon R, Donnenfeld ED, Azar Dt, Holland EJ, Palmon FR, Pflugfelder SC, Rubenstein JB. Infectious keratitis after laser in siu keratomileusis: results of an ASCRS survey. J Cataract Refract Surg 2003; 29: 2001-2006.
-
Donnenfeld ED, Kim TK, Holland EJ Azar DT, Palmon FR, Rubenstein JB, Daya S, Yoo SH; American Society of Cataract and Refractive Surgery Cornea Clinical Committee. ASCRS White Paper. Management of infectious keratitis following laser in situ keratomileusis. J Cataract Refract Surg 2005; 31: 2008-2011.
-
Moshirfar M, Welling JD, Feiz V, Holz H, Clinch TE. Infectious and non-infectious keratitis after laser in situ keratomileusis. Occurrence, management and visual outcomes. J Cataract Refract Surg 2007; 33: 474-483.
-
Llovet F, de Rojas V, Interlandi E, Martín C, Cobo-Soriano R, Ortega-Usobiaga J, Baviera J. Infectious keratitis in 204586 LASIK procedures. Ophthalmology 2010; 117: 232-238.
-
Wroblewski KJ, Pasternak JF, Bower KS, Schallhorn SC, Hubickey WJ, Harrison CE, Torres MF, Barnes SD. Infectious keratitis after photorefractive keratectomy in the United States Army and Navy. Ophthalmology 2006; 113: 520-525.
-
Leccisotti A, Bartolomei A, Greco G, Manetti C. Incidence of bacterial keratitis after photorefractive keratectomy [letter]. J Refract Surg 2005; 21: 95-96.
-
Machat JJ. Excimer laser refractive surgery: Practice and principles. Thorofare, NJ: SLACK Inc.; 1996: 359-400.
-
de Oliveira GC, Solari HP, Ciola FB, Lima AL, Campos MS. Corneal infiltrates after excimer laser photorefractive keratectomy and LASIK. J Refract Surg 2006; 22: 159-165.
-
Donnenfeld ED, O’Brien TP, Solomon R, Perry HD, Speaker MG, Wittpenn J. Infectious keratitis after photorefractive keratectomy. Ophthalmology 2003; 110: 743-747.
-
Leal F, Lima ALH, de Freitas D, Campos M. Análise laboratorial das ceratitis infecciosas secundárias à cirurgia refractiva. Arq Bras Oftalmol 2005; 68: 353-356.
-
Jung SW, Kwon YA, Lee MK, Song SW. Epidermophyton fungal keratitis following laser-assisted subepithelial keratectomy. J Cataract Refract Surg 2009; 35: 2157-2160.
-
Parthasarathy A, Theng J, Ti SE, Tan DT. Infectious keratitis after laser epithelial keratomileusis. J Refract Surg 2007; 23: 832-835.
-
Maverik KJ, Conners MS. Aureobasidium pullulans fungal keratitis following LASEK. J Refract Surg 2007; 23: 727-729.
-
Lifshitz T, Levy J, Klemperer I, Beer-Sheva I. Bacterial keratitis after laser subepithelial keratectomy. J Refract Surg 2005; 21: 94-96.
-
Nomi N, Morishige N, Yamada N, Chikama T, Nishida T. Two cases of methicillin-resistant Staphylococcus aureus keratitis after Epi-LASIK. Jpn J Ophthalmol 2008; 52: 440-443.
-
Sharma N, Sinha R, Singhvi A, Tandon R. Pseudomonas keratitis after laser in situ keratomileusis. J Cataract Refract Surg 2006; 32: 519-521.
-
Muñoz G, Alió JL, Pérez-Santonja JJ, Artola A, Abad JL. Ulcerative keratitis caused by Serratia marcescens after laser in situ keratomileusis. J Cataract Refract Surg 2004; 30: 507-512.
-
LaHaye LC, Rieke H, Farshad F. Cleaner LASIK is possible. J La State Med Soc 2007; 159: 30-36.
-
Kohnen T. Infections after corneal refractive surgery: can we do better? J Cataract Refract Surg 2002; 28: 569-570.
-
Grundmann H, Aires-de-Sousa M, Boyce J, Tiemersma E. Emergence and resurgence of methicillin-resistant Staphylococcus aureus as a public-health threat. Lancet 2006; 368: 874-885.
-
Deramo VA, Lai JC, Winokur J, Luchs J, Udell IJ. Visual outcome and bacterial sensitivity after methicillin-resistant Staphylococcus aureus-associated acute endophthalmitis. Am J Ophthalmol 2008; 145: 413-417.
-
Solomon R, Donnenfeld ED, Perry HD, Rubinfeld RS, Ehrenhaus M, Wittpenn JR Jr, Solomon KD, Manche EE, Moshirfar M, Matzkin DC, Mozayeni RM, Maloney RK. Methicillin-resistant Staphylococcus aureus infectious keratitis following refractive surgery. Am J Ophthalmol 2007; 143: 629-634.
-
Alfonso E, Mandelbaum S, Fox MJ, Forster RK. Ulcerative keratitis associated with contact lens wear. Am J Ophthalmol 1986; 101: 429-433.
-
Dantas PE, Nishiwaki-Dantas MC, Ojeda VH, Holzchuh N, Mimica LJ. Microbiological study of disposable soft contact lenses after photorefractive keratectomy. CLAO J 2000; 26: 26-29.
-
Feizi S, Jadidi K, Naderi M, Shahverdi S. Corneal interface contamination during laser in situ keratomileusis. J Cataract Refract Surg 2007; 33: 1734-1737.
-
Seal D, Reischl U, Behr A, Ferrer C, Alió J, Koerner RJ, Barry P; ESCRS Endophthalmitis Study Group. Laboratory diagnosis of endophthalmitis. Comparison of microbiology and molecular methods in the European Society of Cataract & Refractive Surgeons multicenter study and susceptibility testing. J Cataract Refract Surg 2008; 34: 1439-1450.
-
Rudd JC, Moshirfar M. Meticillin-resistant Staphylococcus aureus keratitis after laser in situ keratomileusis. J Cataract Refract Surg 2001; 27: 471-473.
-
Solomon R, Donnenfeld ED, Perry HD, Jensen HG, Stein J, Snyder RW, Wittpenn JR,Donnenfeld ED. Bilateral methicillin-resistant Staphylococcus aureus keratitis in a medical resident following uneventful photorefractive keratectomy. Eye Contact Lens 2003; 9: 187-189.
-
Chandra NS, Torres MF, Winthrop KL, Bruckner DA, Heidemann DG, Calvet HM, Yakrus M, Mondino BJ, Holland GN. Cluster of Mycobacterium chelonae keratitis cases following laser in-situ keratomileusis. Am J Ophthalmol 2001; 132: 819-830.
-
Fulcher SFA, Fader RC, Rosa RH, Holmes GP. Delayed-onset mycobacterial keratitis after LASIK. Cornea 2002; 21: 546-554.
-
Freitas D, Alvarenga L, Sampaio J, Mannis M, Sato E, Sousa L, Vieira L, Yu MC, Martins MC, Hoffling-Lima A, Belfort R Jr An outbreak of Mycobacterium chelonae infection after LASIK. Ophthalmology 2003; 110: 276-285.
-
Cobo-Soriano R, Beltrán J, Baviera J. LASIK outcomes in patients with underlying systemic contraindications: a preliminary study. Ophthalmology. 2006; 113: 1118-1124.
-
Wahab SA, Moreira H, Buquera M, Moreira L, Daros AC, Oliveira CS. Experimental investigation of postoperative use of medication in refractive surgery. Arq Bras Oftalmol 2005; 68: 223-227.
-
Chung JL, Seo KYS, Yong DE, Mah FS, Kim TI, Kim EK, Kim JK. Antibiotic susceptibility of conjunctival bacterial isolates from refractive surgery patients. Ophthalmology 2009; 116: 1067-1074.
-
Scheld WM. Maintaining fluoroquinolone class efficacy: review of influencing factors [editorial]. Emerg Infect Dis 2003; 9: 1-9.
-
Neu HC. Microbiologic aspects of fluoroquinolones [review]. Am J Ophthalmol 1991; 112(suppl): 15S-24S.
-
Mather R, Karenchak LM, Romanowski EG, Kowalski RP. Fourth generation fluoroquinolones: new weapons in the arsenal of ophthalmic antibiotics. Am J Ophthalmol 2002; 133: 463-466.
-
Hyon J-Y, Joo M-J, Hose S, Sinha D, Dick JD, O’Brien TP. Comparative efficacy of topical gatifloxacin with ciprofloxacin, amikacin, and clarithromycin in the treatment of experimental Mycobacterium chelonae keratitis. Arch Ophthalmol 2004; 122: 1166-1169.
-
Abshire R, Cockrum P, Crider J, Schlech B. Topical antibacterial therapy for mycobacterial keratitis: potential for surgical prophylaxis and treatment. Clin Ther 2004; 26: 191-196.
-
Saravolatz LD, Leggett J. Gatifloxacin, gemifloxacin, and moxifloxacin: the role of 3 newer fluoroquinolones. Clin Infect Dis 2003; 37: 1210-1215.
-
Moshirfar M, Mirzaian G, Feiz V, Kang PC. Fourth-generation fluoroquinolone-resistant bacterial keratitis after refractive surgery. J Cataract Refract Surg 2006; 32: 515-518.
-
Hadden OB, Patel D, Gray TB, Morris AT, Ring CP. Multifocal lamellar keratitis following laser in situ keratomileusis. J Cataract Refract Surg 2007; 33: 144-147.
-
Peng Q, Holzer MP, Kaufer PH, Apple DJ, Solomon KD. Interface fungal infection after laser in situ keratomileusis presenting as diffuse lamellar keratitis. A clinicopathological report. J Cataract Refract Surg 2002; 28: 1400-1408.
-
Arshinoff SA, Mills MD, Haber S. Pharmacotherapy of photorefractive keratectomy. J Cataract Refract Surg 1996; 22: 1037-1044.
-
John T, Velotta E. Nontuberculous (Atypical) Mycobacterial keratitis after LASIK. Current status and clinical implications. Cornea 2005; 24: 245-255.
-
Wallace RJ, Jr, Brown BA, Griffith DE. Nosocomial outbreaks/pseudo-outbreaks caused by nontuberculous mycobacteria. Annu Rev Microbiol 1998; 52: 453-490.
-
Daines BS, Vroman DT, Sandoval HP, Steed LL, Solomon KD. Rapid diagnosis and treatment of mycobacterial keratitis after laser in situ keratomileusis. J Cataract Refract Surg 2003; 29: 1014-1018.
-
Holmes G, Bond GB, Fader RC, Fulcher SF. A cluster of cases of Mycobacterium szulgai keratitis that occurred after laserassisted in situ keratomileusis. Clin Infect Dis 2002; 34: 1039-1046.
-
Biswell R. Cornea. In: Vaughan D, Asbury T, Riordan-Eva P, eds, General Ophthalmology, 15th ed. Stamford, CT, Appleton & Lange 1999; 119-141.
-
Ford JG, Huang AJW, Pflugfelder SC, Alfonso EC, Forster RK, Miller D. Nontuberculous mycobacterial keratitis in south Florida. Ophthalmology 1998; 105: 1652-1658.
-
Eiferman RA, Stagner JI. Intraocular penetration of amikacin; iris binding and bioavailability. Arch Ophthalmol 1982; 100: 1817-1819.
-
Alexandrakis G, Alfonso EC, Miller D. Shifting trends in bacterial keratitis in south Florida and emerging resistance to fluoroquinolones. Ophthalmology 2000; 107: 1497-1502.
-
Hamam RN, Noureddin B, Salti HI, Haddad R, Khoury JM. Recalcitrant post-LASIK Mycobacterium chelonae keratitis eradicated after the use of fourth-generation fluoroquinolone. Ophthalmology 2006; 113: 950-954.
-
Lee SB, Oliver KM, Mohan SK, Slomovic AR. Fourth-generation fluoroquinolones in the treatment of mycobacterial infectious keratitis after laser-assisted in situ keratomileusis surgery. Can J Ophthalmol 2005; 40: 750-753.
-
Abshire R, Cockrum P, Crider J, Schlech B. Topical antibacterial therapy for mycobacterial keratitis: potential for surgical prophylaxis and treatment. Clin Ther 2004; 26: 191-196.
-
Hyon JY, Joo MJ, Hose S, Sinha D, Dick JD, O’Brien TP. Comparative efficacy of topical gatifloxacin with ciprofloxacin, amikacin, and clarithromycin in the treatment of experimental Mycobacterium chelonae keratitis. Arch Ophthalmol 2004; 122: 1166-1169.
-
Höfling-Lima AL, de Freitas D, Mello Sampaio JL, Leão SC, Contarini P. In Vitro activity of fluoroquinolones against Mycobacterium abscessus and Mycobacterium chelonae causing infectious keratitis after LASIK in Brazil. Cornea 2005; 24: 730-734.
-
Majid Moshirfar, MD, Jay J. Meyer, MPH, Ladan Espandar. Fourth-generation fluoroquinolone-resistant mycobacterial keratitis after laser in situ keratomileusis. J Cataract Refract Surg 2007; 33: 1978-1981.
-
de la Cruz J, Behlau I, Pineda R. Atypical mycobacteria keratitis after laser in situ keratomileusis unresponsive to fourth-generation fluoroquinolone therapy. J Cataract Refract Surg 2007; 33: 1318-1321.