COMUNICACIÓN SOLICITADA
Coroiditis serpiginosa: índices de actividad
SALAZAR MÉNDEZ R1, CORDERO COMA M2
Complejo Hospitalario
Universitario de León. Servicio de Oftalmología.
1 Médico Residente Oftalmología. Hospital Universitario Central de
Asturias.
2 Médico Adjunto Oftalmología. Hospital de León.
RESUMEN
Introducción: La coroiditis serpiginosa (CS) se clasifica dentro del grupo de los síndromes de manchas blancas (SMB). Constituye una uveítis posterior bilateral de curso crónico y progresivo, donde se alternan fases activas y fases quiescentes. Su diagnóstico se basa fundamentalmente en la exploración oftalmoscópica, aunque, con frecuencia, ésta es insuficiente para determinar la actividad del cuadro y establecer así la actitud terapéutica más adecuada. En este artículo se revisa la CS, analizando el valor de diversos factores (agudeza visual, exploración funduscópica, angiografía con fluoresceína y verde indocianina, campimetría, autofluorescencia y pruebas electrofisiológicas) en la monitorización de la actividad de las lesiones.
Conclusiones: El pronóstico visual en la CS está influido de forma determinante por la tendencia a la recurrencia del proceso inflamatorio. Estos episodios de inflamación recurrente son causa de una pérdida indolora aunque progresiva de la visión, de forma que resulta esencial identificarlos y tratarlos de forma precoz y agresiva. En este manejo suele ser preciso valorar diversos indicadores de actividad. El conocimiento y utilización de éstos resulta crucial en el seguimiento y toma de decisiones de estos pacientes.
La coroidopatía serpiginosa es un trastorno infrecuente y bilateral, caracterizado por una inflamación crónica, progresiva y recurrente, de etiología desconocida, que afecta al complejo formado por el epitelio pigmentario de la retina (EPR) y la coriocapilar. Fue descrita por primera vez en 1932 por Junius, aunque su descripción completa data de 1os años setenta (1), y desde entonces ha recibido diversos nombres: esclerosis coroidea peripapilar, degeneración coriorretiniana helicoidea peripapilar, coroiditis geográfica, coroidopatía geográfica, coroidopatía geográfica helicoidea peripapilar… (2).
Representa menos del 5% del total de las uveítis posteriores (en algunas regiones la prevalencia es mucho mayor, como en La India, donde alcanza un 19%). Se presenta en adultos jóvenes o de mediana edad, describiéndose en muchos estudios una mayor frecuencia en el sexo masculino, sin predisposición racial o familiar (aunque recientemente se ha descrito una mayor frecuencia de HLA B7 en este grupo). Aunque se han descrito casos asociados a diversos procesos sistémicos (enfermedad Crohn, celiaca, distonía, sarcoidosis, panarteritis nodosa…), en ninguno se ha podido establecer una relación causal. (2,3)
El cuadro se caracteriza por la aparición de lesiones amarillentas irregulares en el área peripapilar y macular con progresión serpiginosa o helicoidal, aunque se han descrito al menos tres patrones diferenciados:
-
Patrón clásico o geográfico papilar: Es el más frecuente, representando el 80% de los casos. El cuadro activo debuta como parches cremosos subretinianos de bordes mal definidos en la región peripapilar, que progresan centrífugamente siguiendo un patrón irregular serpiginoso. Estas lesiones resuelven al cabo de 6-8 semanas, siendo sustituidas por una atrofia del complejo EPR/coriocapilar. Es frecuente hallar lesiones en diferentes estadios evolutivos, siendo más frecuente la recurrencia de las mismas en los márgenes de cicatrices previas. (2,4)
-
Coroiditis macular serpiginosa: Aproximadamente el 59% de los casos se inician a nivel macular (5). No presenta diferencias demográficas o angiográficas con la CS clásica, excepto por su localización y el peor pronóstico visual, secundario a la afectación foveal y el alto riesgo de neovascularización coroidea (NVC). Con frecuencia se diagnostica erróneamente como degeneración macular asociada a la edad (DMAE), toxoplasmosis o diversas distrofias maculares. (2,4)
-
Variantes atípicas (coroiditis ampiginosa o «relentless placoid chorioretinitis»): Ocasionalmente las lesiones aparecen en periferia, aisladas o en el contexto de un patrón multifocal. También se han descrito casos diagnosticados inicialmente como epiteliopatía pigmentaria placoide multifocal posterior aguda (EPPMPA), con posterior progresión a CS. En comparación con las formas clásicas, suele existir un menor compromiso foveal y, por tanto, un mejor pronóstico visual (2-4,6).
Respecto a su anatomía patológica, aunque existen muy pocos estudios histopatológicos, en éstos se ha podido demostrar la existencia de una infiltración difusa linfocitaria, así como una atrofia de fotorreceptores, EPR y coriocapilar, siendo ésta última la capa más afectada. (7) Se han propuesto muy diversas teorías patogénicas, ninguna de ellas confirmada en la actualidad, representando quizás la CS una manifestación común a muy diversos procesos sistémicos:
-
Autoinmune: teoría basada en su reciente asociación con el CMH (HLA B7), la reactividad frente al antígeno S y la frecuente hipocomplementemia C3 detectada en los pacientes (2,8,9).
-
Infecciosa: históricamente la CS se ha relacionado con la infección tuberculosa y herpética (1,2,10). Desde la década de los cincuenta se reconoce la relación entre este proceso y la tuberculosis (TB), donde se pueden observar coroiditis que simulan las lesiones de la CS («tuberculous serpiginous-like coroiditis» o TB-SLC), debutando como una coroiditis multifocal con tendencia a la coalescencia en forma de patrón ameboide (8,9). Estas lesiones presentan un curso implacable pese al empleo de inmunosupresión sistémica, respondiendo de forma satisfactoria y definitiva al tratamiento antituberculoso (TAT). El mecanismo exacto que produce este cuadro es desconocido aunque parece representar una reacción de hipersensibilidad inmunomediada por el bacilo tuberculoso (11,12). Recientemente se han tratado de establecer las principales diferencias clínicas entre la CS clásica y la TB-SLC. Así, la TB-SLC suele cursar con una vitritis más intensa y lesiones multifocales distribuidas tanto en polo posterior como periferia con pigmentación variable (fig. 1), a diferencia de la CS clásica donde la vitritis es mínima o ausente y las lesiones se circunscriben al área peripapilar y macular (13). En definitiva, la TB latente ha de descartarse como primera causa de CS, dadas sus implicaciones terapéuticas y pronósticas, preferiblemente mediante la combinación de los resultados de la intradermorreacción y el QuantiFERON TB-Gold. (14) En caso de resultado positivo, es preciso iniciar una pauta de TAT, que será curativa en el caso de tratarse de TB-SLC e imperativa antes de plantear un tratamiento inmunosupresor en la CS, dado el alto riesgo de TB diseminada.
-
Vascular: en algunos pacientes la CS puede coexistir con vasculopatías o trastornos de la coagulación (incremento del facto VIII de von Willebrand), así como acompañarse en sus manifestaciones de periflebitis y obstrucciones vasculares, o bien compartir aspecto clínico con la oclusión de vasos ciliorretinianos (2,8,15).
-
Degenerativa: basada en su curso crónico y progresivo, su edad de presentación y su eventual asociación con trastornos degenerativos (2).
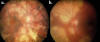
Fig. 1: Aspecto oftalmoscópico de (a) ojo derecho y (b) ojo izquierdo en
paciente con TB-SLC.
PARÁMETROS DE ACTIVIDAD
El diagnóstico de la CS se basa fundamentalmente en la exploración funduscópica (fig. 2). No obstante, con frecuencia es difícil determinar el estado de actividad de las lesiones y, por tanto la actitud terapéutica, basándose exclusivamente en su aspecto clínico. Por esta razón, resultan especialmente útiles las pruebas complementarias, que proporcionan información adicional y de gran valor en la monitorización de estos pacientes:

Fig. 2: Curso evolutivo en paciente con lesiones activas de CS.
– Campo visual (CV): La AV describe de forma muy limitada el impacto visual de las enfermedades coriorretinianas con repercusión macular, como la CS (2). En estos casos resulta imperativo cuantificar la función macular, por ejemplo mediante microperimetría, un método no invasivo que explora la fijación y los defectos del CV central. Estudios recientes han demostrado una conservación de la fijación en más del 60% de los casos incluso con afectación macular extensa, lo que parece indicar que la existencia de una mínima área de sensibilidad retiniana residual es útil para mantener la fijación aún en casos de CS con extensa atrofia. En casos bilaterales, la fijación estable y central es detectada en el ojo con mejor AV, a pesar de presentar las mismas lesiones atróficas. Suele identificarse un escotoma denso central rodeado de un escotoma relativo en las lesiones geográficas (correspondiéndose este último con zonas de fuga en la verde indocianina no visualizables mediante angiografía). Además, la actividad del proceso suele correlacionarse con la densidad de dicho escotoma (16).
– Pruebas electrofisiológicas: El electrorretinograma (ERG) y el electrooculograma (EOG) son normales excepto en casos de larga evolución y/o con lesiones extensas en polo posterior (2).
– Angiografía con fluoresceína (AFG): Los hallazgos no son patognomónicos. Las áreas atróficas se visualizan hipofluorescentes en tiempos precoces por la atrofia coriocapilar, con hiperfluorescencia progresiva de los bordes y eventual tinción escleral (fig. 3). Las lesiones activas bloquean precozmente la fluoresceína y muestran una tinción difusa con fuga progresiva en tiempos tardíos (fig. 4). En las fases de actividad, con frecuencia permite identificar tramos de vasculitis perilesionales (fig. 5) (2).
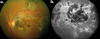
Fig. 3: Aspecto (a) oftalmoscópico y (b) angiográfico de lesioón serpiginosa
macular inactiva.
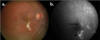
Fig. 4: Aspecto (a) oftalmoscópico y (b) angiográfico de paciente con lesión
activa (flecha) y lesión inactiva (punta flecha).
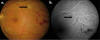
Fig. 5: Aspecto (a) oftalmoscópico y (b) angiográfico de paciente con CS activa
y vasculitis (flecha).
– Angiografía con verde indocianina (ICGA): Permite reconocer, a diferencia de la AFG, diferentes patrones angiográficos en función del estadio evolutivo. Así, en fases inactivas de coroiditis identifica el grado de atrofia coroidea y cicatrización, siendo especialmente útil para descartar o confirmar la actividad de un proceso coroideo. Mientras que en la AFG las lesiones activas suelen mostrar un bloqueo precoz con tinción tardía variable según el grado de disfunción de la barrera hematorretiniana, en la ICGA las lesiones se muestran hipofluorescentes durante todo el estudio debido a la destrucción extensa de la coriocapilar, permitiendo incluso, en algunos casos, identificar lesiones no visibles mediante oftalmoscopia. Esta hipofluorescencia es, además, más evidente y mejor definida que la observada en AFG. La ICGA permite identificar cuatro patrones distintivos en función del estadio evolutivo de la enfermedad:
-
Fase subclínica (coroidea): Hipofluorescencia de bordes difusos, siendo la AFG y la exploración funduscópica normales, al no existir aún afectación del EPR.
-
Fase activa: Existe ya afectación del EPR, siendo visibles las lesiones mediante AFG y funduscopia. La ICGA revela una hipofluorescencia precoz de bordes poco nítidos, que ocasionalmente, en formas especialmente agresivas, puede acompañarse de tinción tardía y difusión de colorante (fig. 6).
-
Fase cicatricial: Mientras que la AFG no muestra signos de actividad a nivel del EPR, la ICGA permite demostrar la persistencia de la inflamación a nivel coroideo pese al estado cicatricial del EPR, mostrando una discreta fuga persistente en tiempos tardíos.
-
Fase inactiva: Muestra una hipofluorescencia de bordes nítidos que se acentúa en tiempos tardíos (fig. 7).
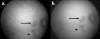
Fig. 6: Aspecto en ICGA (a) precoz y (b) tardía de paciente de la figura 4, con
lesión activa (flecha) e inactiva (punta flecha).

Fig. 7: Aspecto (a) oftalmoscópico, (b) angiográfico y (c) en ICGA de lesión
inactiva.
Por tanto, y en comparación con la AFG, la ICGA permite una mejor tinción de las lesiones de CS, con evidencia de alteraciones coroideas no visibles mediante AFG; una mejor identificación de las lesiones activas, que se muestran mayores que las propias lesiones retinianas; la demostración de tinción coroidea y fuga desde los vasos en la mitad de los pacientes; la identificación de actividad coroidea aún en ausencia de actividad retiniana; así como la reducción del tamaño de las áreas inactivas tras el tratamiento inmunosupresor. En definitiva, es una herramienta especialmente útil en la monitorización de la enfermedad, proporcionando un método muy sensible para identificar los diferentes estadios de la enfermedad, colaborando así en la toma de decisiones terapéuticas (2,6,17,18).
– Autofluorescencia: La autofluorescencia (AF) ha sido empleada para evaluar el estado del EPR en diversos trastornos inflamatorios, degenerativos y neoplásicos. Su señal deriva, primariamente, del acúmulo de lipofucsina a nivel del EPR, que es un indicador de alteración estructural y/o funcional. Un aspecto controvertido es la utilidad de la AF en la distinción de los distintos procesos incluidos dentro de los SMB, así como su capacidad para detectar actividad en dichos procesos. En el caso de la CS, el patrón de hipoautofluorescencia se corresponde con las áreas de atrofia coriorretiniana. En caso de actividad, se pueden apreciar áreas de hiperautofluorescencia coincidentes con los hallazgos angiográficos aunque de forma mucho más evidente, lo que convierte a la hiperautofluorescencia en un indicador muy sensible de actividad en los bordes de lesiones atróficas. Igualmente, permite identificar los focos de NVC como áreas de hiperautofluorescencia. Por otro lado, se ha demostrado de forma genérica en los SMB, una correlación negativa entre la extensión de las áreas hipoautofluorescentes foveales y la agudeza visual. La AF, por tanto, constituye un método no invasivo especialmente útil en la monitorización y seguimiento de los pacientes con CS. Recientemente se han podido identificar los cambios sobre los distintos patrones de autofluorescencia durante el curso de la CS. De esta forma, en estadios muy precoces se puede visualizar una discreta hipoautofluorescencia, que se acompaña de un tenue halo hiperautofluorescente en las lesiones activas para, al cabo de los días, dar lugar a un patrón de hiperautofluorescencia franco. Con el paso de las semanas y a medida que se va produciendo la resolución de la lesión, comienza a identificarse un borde hipoautofluorescente que se sigue de un patrón granular de la lesión y finalmente una hipoautofluorescencia definida. Por otro lado, las lesiones tratadas parecen mostrar menor hipoautofluorescencia, lo que sugiere que la inmunosupresión puede reducir el daño sobre el EPR. La AF se perfila, por tanto, como un método no invasivo útil para diferenciar entre sí diversos cuatros de SMB, así como detectar precozmente cambios en el EPR y ser determinante en la toma de decisiones terapéuticas (19,20).
– Tomografía de coherencia óptica (OCT): Las características tomográficas de la CS consisten en una hiperreflectividad aislada de la retina externa, lo que parece correlacionarse con los hallazgos histopatológicos, donde se ha demostrado una pérdida extensa del EPR, con destrucción secundaria de la retina adyacente. Aunque los hallazgos oftalmoscópicos y angiográficos puedan ser similares en la coroiditis multifocal y la CS, la OCT «en-face» permite identificar diferentes patrones morfológicos, confirmando las hipótesis sobre su patogenia (enfermedad de la coriocapilar con atrofia de los fotorreceptores y daño variable de la coroides). La OCT permite, no sólo identificar NVC secundaria, sino también mejorar el conocimiento de la localización y extensión de las lesiones coriorretinianas inflamatorias (21,22).
El diagnóstico diferencial se plantea fundamentalmente con otros SMB, como la EPPMPA o la coroiditis multifocal, así como con otros trastornos como la toxoplasmosis, tuberculosis, isquemia coroidea, sarcoidosis, sífilis, o histoplasmosis, entre otros (2).
La complicación más frecuente y con mayor impacto visual en la CS es la NVC, que se describe en el 13-35% de los casos y que puede constituir su forma de debut. Parece probable la relación entre la localización de las lesiones en el área papilo-macular y su especial sensibilidad a la acción de los agentes vasoproliferativos. Estas membranas pueden ser tratadas con éxito mediante fotocoagulación láser, terapia fotodinámica y antiVEGF intravítreos. Un aspecto esencial lo constituye el diagnóstico diferencial entre las membranas neovasculares subretinianas (MNVSR) y los focos de actividad. El aspecto funduscópico puede plantear dificultades especialmente en el caso de membranas con abundante líquido subretiniano. En la AFG, la NVC se presenta con un patrón de hiperfluorescencia precoz que aumenta a lo largo del angiograma, acompañándose de fuga en tiempos tardíos, mientras que en la ICGA se aprecia un punto caliente o con más frecuencia una placa hiperfluorescente a lo largo de toda la prueba. La OCT constituye una herramienta diagnóstica fundamental, al confirmar, en el caso de MNVSR, la presencia de una zona hiperreflectiva subretiniana, acompañada de un desprendimiento neurosensorial, con acúmulo de líquido subretiniano (fig. 8). Otras complicaciones incluyen: oclusión de ramas venosas retinianas, periflebitis, desprendimiento del epitelio pigmentario, desprendimientos serosos, edema macular quístico, neovascularización del disco óptico, fibrosis subretiniana y uveítis anterior (2).

Fig. 8: Aspecto (a) oftalmoscópico y (b) tomográfico de paciente con CS y NVC.
BIBLIOGRAFÍA
-
Laartikainen L, Erkkila H. Serpiginous choroiditis. Br J Ophthalmol 1974; 58: 777-783.
-
Lim W-K, Buggage RR, Nussenblatt RB. Serpiginous choroiditis. Surv Ophthalmol 2005; 50(3): 231-244.
-
Gupta V, Agarwal A, Gupta A, Bambery P, Narang S. Clinical characteristics of serpiginous choroidopathy in North India. Am J Ophthalmol 2002; 134: 47-56.
-
Caspers L. Serpiginous choroiditis. In: Gupta A, Gupta V, Herbort C et al. Uvetis, text and imaging. New Delhi: Jaypee; 2009.
-
Munteanu G, Munteanu M, Zolog I. Serpiginous choroiditis: clinical study. Oftalmologia 2001; 52: 72-80.
-
Jones BE, Jampol LM, Yannuzzi LA, Tittl M, Johnson MW, Han DP et al. Relentless placoid chorioretinitis: a new entity or an unusual variant of serpiginous chorioretinitis? Arch Ophthalmol 2000; 118: 931-938.
-
Wu JS, Lewis H, Fine SL, Grover DA, Green WR. Clinicopathologic findings in a patient with serpiginous choroiditis and treated choroidal neovascularization. Retina 1989; 9: 292-301.
-
Quillen DA, Davis JB, Gottlieb JL, Blodi BA, Callanan DG, Chang TS et al. The white dot syndromes. Am J Ophthalmol 2004; 137: 538-550.
-
Rodriguez-García A. Serpiginous choroiditis. In: Foster CS, Vital AT. Diagnosis and treatment of uveitis. Philadelphia: WB Saunders; 2002.
-
Priya K, Madhavan HN, Reiser BJ, Biswas J, Saptagirish R, Narayana KM, Rao NA. Association of herpesviruses in the aqueous humor of patients with serpiginous choroiditis: a polymerase chain reaction-based study. Ocul Immunol Inflamm. 2002; 10: 253-61.
-
Gupta V, Gupta A, Rao NA. Intraocular tuberculosis – an update. Surv Ophthalmol 2007; 52: 561-587.
-
Erkkila H, Laatikainen L, Jokinen E. Immunological studies on serpiginous choroiditis. Graefes Arch Clin Exp Ophthalmol 1982; 219: 131-134.
-
Vasconcelos-Santos DV, Rao PK, Davies JB, Sohn EH, Rao Na. Clinical features of tuberculous serpiginouslike choroiditis in contrast to classic serpiginous choroiditis. Arch Ophthalmol 2010; 128: 853-858.
-
Mackensen F, Becker MD, Wiehler U. QuantiFERON TB-Gold – a new test strengthening long-suspected tuberculous involvement in serpiginous-like choroiditis. Am J Ophthalmol 2008; 146: 761-766.
-
King DG, Grizzard WS, Sever RJ, Espinoza L. Serpiginous choroiditis associated with elevated factor VIII-von Willebrand factor antigen. Retina 1990; 10: 97-101.
-
Pilotto E, Vujosevic S, Grgic VA, Sportiello P, Convento E, Secchi AG et al. Retinal function in patients with serpiginous choroiditis: a microperimetry study. Graefes Arch Clin Exp Ophthalmol 2010; 248: 1331-1337.
-
García-Saenz MC, Gili Manzanaro P, Bañuelos Bañuelos J, Villarejo Díaz-Maroto I, Arias Puente A. Valoración de enfermedades inflamatorias coriorretinianas con angiografía y verde indocianina. Arch Soc Esp Oftalmol 2003; 78(12): 675-683.
-
Giovannini A, Mariotti C, Ripa E, Scassellati-Sforzolini B. Indocyanine green angiographic findings in serpiginous choroidopathy. Br J Opthalmol 1996; 80: 536-540.
-
Yeh S, Forooghian F, Wong WT, Faia LJ, Cukras C, Lew JC et al. Fundus autofluorescence imaging of the White Dot Syndromes. Arch Ophthalmol 2010; 128(1): 46-56.
-
Cardillo Piccolino F, Grosso A, Savini E. Fundus autofluorescence in serpiginous choroiditis. Graefes Arch Clin Exp Ophthalmol 2009; 247: 179-185.
-
Gallagher MJ, Yilmaz T, Cervantes-Castañeda RA, Foster CS. The characteristic features of optical coherence tomography in posterior uveitis. Br J Opthalmol 2007; 91: 1680-1685.
-
van Velthoven MEJ, Ongkosuwito JV, Verbraak FD, Schlingemann RO, de Smet MD. Combined en-face optical coherence tomography and confocal ophthalmoscopy findings in active multifocal and serpiginous chorioretinitis. Am J Ophthalmol 2006; 141: 972-975.