SEMINARIO DE CASOS CLÍNICOS
Neuropatía óptica isquémica anterior bilateral después de cirugía bypass
RIVERO V1, ACERO PEÑA A1
Sección de Retina. Departamento de
Oftalmología. HGU Gregorio Marañón. Madrid. España.
1 Licenciada en Medicina y Cirugía.
RESUMEN
Introducción: La incidencia de neuropatía óptica isquémica (NOI) después de cirugía bypass es del 0,06%.Múltiples factores se han implicado en su etiología: anemia por pérdida de sangre, tiempos quirúrgicos prolongados, hipotensión, factores de riesgos cardiovasculares previos..
Caso Clínico: Presentamos un caso de un varón de 61 años, dislipémico, diagnosticado de cardiopatía isquémica de tronco y tres vasos, sometido a cirugía de triple bypass coronario mediante técnica habitual y sin complicaciones, el cual ,a las 24 horas de la cirugía, experimentó una pérdida brusca de visión altitudinal, bilateral y asimétrica, llegando un día después a describir alucinosis visuales, sin focalidad neurológica ni déficits .El paciente fue diagnosticado de un síndrome de Charles Bonnet, resuelto, secundario a NOI anterior bilateral asimétrica.
INTRODUCCIÓN
La incidencia de neuropatía óptica isquémica después de cirugía bypass es de 0,06% (1,2).La frecuencia de neuropatía óptica isquémica anterior (NOIA) es mayor tras procedimientos cardiacos, mientras que la neuropatía óptica isquémica posterior (NOIP) es más elevada tras cirugía espinal (3).
Las neuropatías ópticas isquémicas se han convertido actualmente, en una de las causas más comunes de pérdida de visión postoperatoria permanente. El deterioro de la visión generalmente ocurre inmediatamente después de la cirugía y progresa en dos o tres días (3).
La neuropatía óptica isquémica anterior (NOIA) asociada a cirugía de bypass se ha relacionado con múltiples factores tanto predisponentes como perioperatorios entre los que podemos destacar: relación disco-excavación pequeña, diabetes mellitus (DM), hipertensión arterial (HTA), anemia, dislipemia (DL) como predisponentes y duración cirugía bypass, hipotermia, hipotensión sistémica, anemia, incremento presión intraocular,uso de drogas vasoactivas, hemorragia entre los perioperatorios (1-6).
CASO CLÍNICO
Paciente varón de 61 años, DL, fumador y bebedor moderado, acude a urgencias por dolor torácico y disnea. Debido al resultado de las pruebas realizadas (electrocardiograma, ecocardigrama y cateterismo) es diagnosticado de cardiopatía isquémica de tronco y tres vasos.
En la evaluación preoperatoria los datos analíticos fueron normales.
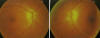
Fig. 1: Retinografía nervio óptico ojo
derecho y ojo izquierdo 18 días después de la cirugía.
Cuatro días después bajo anestesia general, circulación extracorpórea e hipotermia moderada, se somete a cirugía de triple bypass coronario, mediante técnica habitual y sin complicaciones. La hemoglobina y el hematocrito inicial fueron de 14,9 g/dl y 42,1% respectivamente y postquirúrgicos de 8,7 g/dl y 24,3%. Las tensiones arteriales se mantuvieron entre 120/75 mmhg y 95/50. La pérdida de sangre durante el procedimiento fue moderada, la reposición de volumen se realizó con 2.300 cc. de cristaloide y 300 cc. de coloide. El tiempo de clampaje fue de 55 minutos y el de circulación extracorpórea de 105 minutos. Durante la cirugía, no preciso el uso de drogas ionotropas ni de concentrados de hematíes, aunque si fueron ambos requeridos durante su estancia en planta.

Fig. 2: Retinografía nervio óptico ojo
derecho y ojo izquierdo 53 días después de la cirugía.
A las 24 horas de la cirugía, el paciente experimentó una pérdida brusca de visión altitudinal, bilateral y asimétrica que aumenta a lo largo del día, llegando un día después a describir alucinosis visuales, sin focalidad neurológica ni déficits .A la exploración presenta una visión de 0,1 ojo derecho (OD) y movimiento de manos a 20 centímetros (cm) ojo izquierdo (OI), motilidad intrínseca y extrínseca normales y fondo de ojo (FO) con edema de papila bilateral, sin hemorragias ni otras manifestaciones acompañantes .Las pruebas de imagen (TAC y RM ) y la velocidad de sedimentación fueron normales. El electroencefalograma no objetiva actividad asociada a alguna forma de epilépsia y los potenciales evocados presentan una latencia aumentada en el OD y ausencia de respuesta en OI.

Fig. 3: IZQUIERDA. OCT de papila ambos
ojos (AO) 18 días después de la cirugía: importante edema del nervio óptico con
engrosamiento de la capa de fibras nerviosas de la retina (CFNR). DERECHA. OCT
de papila AO 3 meses y 19 días después de la cirugía: inicio del adelgazamiento
de la CFNR en determinados cuadrantes y sectores horarios.
A los 4 días la agudeza visual mejoró por OD cesando las alucinosis visuales.
Dada la evolución clínica y el resultado de las pruebas el paciente fue diagnosticado de un síndrome de Charles Bonnet resuelto, secundario a una disminución brusca de visión asociada a NOIA.

Fig. 4: ARRIBA. Campimetría AO 18 días
después de la cirugía: pérdidas difusas intensas en AO. ABAJO. Campimetría AO 39
días después de la cirugía: persistencia de las pérdidas intensas en AO con
mejoría en la profundidad de los defectos centrales en OD.
Dos meses después de seguimiento mediante exploración clínica, campo visual y tomografía óptica computarizada (OCT), la agudeza visual con corrección es de 0,7 OD y cuenta dedos a 20 cm OI, con atrofia óptica marcada en temporal en ambos ojos.
DISCUSIÓN
La NOIA postoperatoria se presenta como una pérdida de visión indolora acompañada de edema pálido a nivel del nervio óptico.
Múltiples factores de riesgo han sido asociados con la NOIA entre los que cabe destacar una pequeña relación entre el disco y la excavación, ausencia de excavación del nervio óptico, presencia de drusas del nervio óptico entre los factores de riesgo oculares asi como factores de riesgo cardiovasculares. Por otra parte, existen casos publicados de NOIA perioperatoria en pacientes sin ningún factor de riesgo asociado, donde la patología es atribuida a una combinación de hipovolemia, hemodilución, hipotensión sistémica, anemia (2-4,6).
La etiología de la NOIA podría estar relacionada con un infarto generalizado o segmentario a nivel prelaminar o laminar del nervio óptico, causado por una vasoconstricción de las arterias ciliares posteriores, debido al aumento de la angiotensina y a la disminución del flujo sanguíneo en el contexto de una hipotensión sistémica y un cuadro de anemia (5).
La irrigación arterial de la cabeza del nervio óptico esta influenciada por la presión intraocular (PIO), por tanto una caída de la presión de perfusión arterial por debajo de la presión intraocular compromete la circulación del disco. Así mismo, sustancias como la angiotensina, importante vasoconstrictor, la hipotensión secundaria a las pérdidas por hemorragia, la hipotermia, la activación del sistema del complemento, el incremento de la presión venosa y la viscosidad, la anemia junto con la una disminución de la capacidad de transporte de oxígeno , contribuyen al disbalance entre ambas tensiones y en los sistemas de autorregulación (7-9).
El Síndrome de Charles Bonnet se manifiesta como alucinaciones puramente visuales. Generalmente se presenta en pacientes de edad, lúcidos y sin delirio. Los síntomas son intermitentes y de duración muy variable (de segundos a horas). Aparecen días o semanas después de la pérdida visual y pueden persistir desde minutos a años. Clásicamente no debería existir una lesión de la vía visual ni de la corteza cerebral y debe excluirse el consumo de fármacos. El compromiso de la visión generalmente es severo pero no es una ceguera total; los pacientes conservan una visión de bultos o cuenta dedos. Las patologías más frecuentemente asociadas con el desarrollo de este síndrome son la Degeneración Macular Asociada a la Edad, Retinopatía Dia
bética, Glaucoma y afecciones corneales (11).
CONCLUSIÓN
-
Describimos un nuevo caso de NOIA bilateral tras cirugía de bypass, en pacientes con DL y hábito tabáquico como únicos factores de riesgo, con consecuencias devastadoras y permanentes en la visión asociado a un cuadro agudo de síndrome de Charles Bonnet.
-
No existe un tratamiento efectivo, la medida más recomendable es la prevención, mediante el control de los factores de riesgo, asi como el manejo de técnicas de neuroprotección perioperatorias (3,9,10).
-
La evaluación de la susceptibilidad individual mediante la identificación de polimorfismo genéticos nos podría ayudar en un futuro a seleccionar los pacientes de riesgo e implantar medidas preventivas que permitan una adecuada neuroprotección (10).
BIBLIOGRAFÍA
-
Kalyani SD, Miller NR, Dong LM, Baumgartner WA, Alejo DE, Gilbert TB. Incidence of and risk factors for perioperative optic neuropathy after cardiac surgery.Ann Thorac Surg 2004 Jul; 78(1): 34-7.
-
Nuttall GA, Garrity JA, Dearani JA, Abel MD, Schroeder DR, Mullany CJ. Risk factors for ischemic optic neuropathy after cardiopulmonary bypass: a matched case/control study.Anesth Analg 2001; 93: 1410-1416.
-
Suárez-Fernández MJ, Clariana-Martín A, Mencía-Gutiérrez E, Gutiérrez-Díaz E, Gracia-García-Miguel T. Bilateral anterior ischemic optic neuropathy after bilateral neck dissection. Clin Ophthalmol 2010 Mar 4; 4: 95-100.
-
Shapira OM, Kimmel WA, Lindsey PS, Shahian DM Anterior ischemic optic neuropathy after open heart operations. Ann Thorac Surg 1996; 61: 660-666.
-
Sha’aban RI, Asfour WM. Visual loss after coronary artery bypass surgery. Saudi Med J 2000 Jan; 21(1): 90-2.
-
Robinson RJ, Cecere R, Chiu RC. Binocular blindness following dynamic cardiomyoplasty. J Card Surg 1996 Jan-Feb; 11(1): 75-8.
-
Larkin DF, Wood AE, Neligan M, Eustace P. Ischaemic optic neuropathy complicating cardiopulmonary bypass.Br J Ophthalmol 1987 May; 71(5): 344-7.
-
Larkin DFP, Connolly P, Magner JB, Wood AE, Eust P. Intraocular pressure during cardiopulmonary bypass. Br J Ophthalmol 1987; 71: 177-180.
-
Williams EL, Hart WM Jr, Tempelhoff R. Postoperative ischemic optic neuropathy. Anesth Analg 1995; 80: 1018-1029.
-
Díaz F, Hlavnika A. Complicaciones neurológicas de la cirugía cardíaca. CONAREC [serial on line] 2008 Sep-Oct; 24 (96). Disponible en: URL: http://www.conarec.org.ar/revista/96/complicaciones_neurologicas.pdf
-
Donoso A, Silva C, Fuentes P, Gaete G. Síndrome de Charles Bonnet: presentación de tres casos y revisión de la literatura. Rev. méd. Chile [online]. 2007, vol.135, n.8, pp. 1034-1039.