REVISIÓN ACTUALIZADA
Celulitis preseptal y orbitaria en edad pediátrica
BERASATEGUI FERNÁNDEZ B1, LERCHUNDI PLAZA TX1, IBARROLA VIDAURRE A2, PINAR SUEIRO S3
Hospital de Cruces. Vizcaya,
España. Grupo de Oftalmología Experimental (GOBE) Universidad del País Vasco
(UPV/EHU).
1 Licenciado en Medicina. Servicio de Oftalmología.
2 Licenciado en Medicina. Servicio de Pediatría.
3 Doctor en Medicina. Servicio de Oftalmología. Pertenece al IOB:
Instituto Oftalmológico Bilbao.
INTRODUCCIÓN
La órbita, además de albergar el globo ocular, contiene partes blandas susceptibles de sufrir inflamación o infección. La celulitis preseptal (CP) afecta a aquellos tejidos situados anteriormente al septum orbitario, mientras que la celulitis orbitaria (CO) implica la grasa y músculos intraorbitarios. La causa más frecuente es la extensión por continuidad de una infección de los senos paranasales adyacentes. Se trata de una patología habitual en la edad pediátrica no menospreciable debido a su potencial amenaza vital. En el presente trabajo, hemos llevado a cabo una revisión de los principales aspectos demográficos, microbiológicos, diagnósticos y terapéuticos de esta entidad patológica, considerando los principales artículos publicados desde el año 1985, momento en el que se universalizó en Occidente la vacuna para el Haemophilus influenzae tipo b (Hib), hecho que contribuyó a la modificación del espectro microbiológico implicado en la etiología de las CP y CO.
ANATOMÍA
La órbita constituye una cavidad ósea no expansible que alberga el globo ocular, la porción más anterior del nervio óptico, así como la musculatura extraocular y la grasa orbitaria. Se cierra anteriormente por los párpados y su tejido conectivo.
La diferenciación entre CO y CP se basa en la localización del proceso inflamatorio-infeccioso según una estructura anatómica que es el septum orbitario. Éste consiste en una lámina fibrosa, delgada y móvil, que une el borde orbitario con el borde periférico de los tarsos formando el arcus marginalis (1,2). Funciona como una verdadera barrera dificultando que procesos inflamatorios que afecten a los párpados y sus anejos penetren en el interior de la órbita (3,4).
La órbita puede dividirse en 3 espacios «quirúrgicos»: espacio intraconal, extraconal y subperióstico. Uno o varios pueden acoger el proceso patológico en caso de una CO. Los espacios intra y extraconal vienen delimitados por el tabique fascial muscular que constituye el cono orbitario. Este tabique en su parte más posterior y cercano al anillo de Zinn es incompleto facilitando de esta manera la extensión de la inflamación de un espacio al otro. El espacio subperióstico, sin embargo, es virtual pero con frecuencia se hace real en las CO. El periostio se inserta firmemente al esqueleto a lo largo de las suturas óseas y al borde orbitario pero deja áreas laxas entre estas inserciones donde la inflamación también puede localizarse y formar abscesos.
Tres de las cuatro paredes de la órbita forman parte de los senos paranasales. La pared medial forma parte del seno etmoidal, la inferior del maxilar y la superior del frontal. Tanto el seno maxilar como el etmoidal se encuentran completamente formados en el momento del nacimiento y no es hasta el quinto o sexto año de vida cuando se completa la neumatización del frontal. Los dos primeros comparten la peculiaridad de separarse de la órbita por una delgada capa ósea, que en el caso del seno etmoidal además presenta unos agujeros vásculo-nerviosos, que facilitarían la extensión intraorbitaria de una infección sinusal.
La característica vascularización avalvular de la órbita que atraviesa el seno cavernoso puede involucrar a este espacio con el consiguiente riesgo de diseminación intracraneal a través de las meninges adyacentes.

Fig. 1: Las imágenes corresponden a
un niño de 2 años afecto de celulitis orbitaria. A: Absceso subperióstico medial
(flecha) en órbita derecha acompañado de sinusitis etmoidal (asterisco). B:
Imagen en la que se evidencia la resolución del cuadro tras recibir tratamiento
intravenoso con amoxicilina-clavulánico y drenaje sinusal transnasal.
EPIDEMIOLOGÍA
La CP y CO es más frecuente en niños que en adultos. A su vez, la CP aparece en niños más pequeños y es hasta 3 veces más frecuente que la CO (3).
Los artículos publicados hasta el momento coinciden en la relación directa entre la edad del paciente y la gravedad del proceso, siendo la CP más frecuente en menores de 5 años y la CO, en mayores (5).
En una revisión de 315 pacientes pediátricos con ambos tipos de infección, el 94% fueron CP. La edad media de este grupo de Boston fue de 3 años para CP y de 5 años para CO (6).
En un estudio publicado por La Orden Izquierdo et al. en que se incluyeron 66 niños, la mediana de edad para CP fue de 38 meses (7). Otro grupo dirigido por Rodríguez Ferrán et al. que revisó 107 casos halló una mediana de 52 meses (8).
Por otra parte, en una revisión de 38 niños diagnosticados de CO realizada por McKinley et al. la edad media fue de 6,8 años (9). Y el grupo de Seltz identificó una media de 6 años en una revisión de 94 niños también diagnosticados de CO (10).
Este tipo de afectación orbitaria es más frecuente en varones (10-13). Suele acontecer en meses de invierno y de manera unilateral (14,15).
ETIOPATOGENIA
La causa más frecuente de celulitis es la infección bacteriana que puede tener tres orígenes: la extensión directa desde un foco de sinusitis adyacente, la inoculación directa tras un traumatismo o infección cutánea o la siembra bacteriémica desde un foco alejado (16,17).
En ausencia de traumatismo periorbitario o infección local, al menos el 75% de las CO se debe a una sinusitis, siendo el seno etmoidal la fuente de infección más habitual (16,18-20). En una serie de 315 niños recogida por Ambati et al. en 2000 se identificaron 44/297 casos de CP y 18/18 de CO con origen en una infección de senos (6).
La existencia de un drenaje venoso avalvular común entre los senos paranasales y la órbita, y unos orificios neurovasculares en la pared del seno etmoidal que se comprometen al edematizarse la mucosa sinusal, favorece que los microorganismos responsables de una sinusitis penetren en la órbita (16,18).
MICROBIOLOGÍA
Se puede establecer un antes y un después en la microbiología de las CO y este evento coincide con la estandarización de la vacunación contra Hib en 1985. Hasta ese momento, este germen tan virulento responsable de meningitis y bacteriemias era la primera causa de CO (21). Ambati et al. afirma no sólo la disminución de la incidencia de celulitis por Hib, sino que además sugiere una disminución de la incidencia global de celulitis. Esto lo explica al reconocer a este germen como facilitador de la entrada de otros organismos en la órbita como copatógenos (6). Actualmente se debe seguir considerando en niños con dudas de una adecuada inmunización.
En España la vacuna frente a Hib se hizo obligatoria en 1998 y desde entonces se incluye en el calendario vacunal, administrándose inmunización a todos los niños a la edad de 2, 4, 6 y 18 meses de vida en todas las comunidades autónomas por igual.
No existe unanimidad en cuanto al microorganismo más frecuentemente responsable, pero lo que sí parece común a todos los autores es que en ausencia de traumatismo se trata casi en el 100% de los casos de cocos grampositivos.
Varios han publicado que Staphylococcus aureus es el más predominante (9,13,22,23). Otros sin embargo, hacen referencia a Streptococcus pneumoniae (24-26). Tanto el equipo de Brook como el de Rudloe han identificado a Streptococcus viridans como el patógeno más habitual (11,18). Actualmente cada vez hay más autores que destacan el papel protagonista que está adquiriendo el grupo de Streptococcus anginosus (10,23).
Como es evidente, existe debate en identificar al microorganismo más frecuente, sin embargo, muchos autores coinciden en señalar a Streptococcus pyogenes como uno de los más habituales (10,11,18,23).
En áreas en que Staphylococcus aureus meticilin-resistente (SAMR) es prevalente se han identificado casos aislados de celulitis provocada por este patógeno (9,11,27).
Ante un paciente con una sospecha de CP o CO se puede tomar una muestra de sangre o bien, del material procedente de un absceso o seno en caso de que sea posible. Antes de que la inmunización frente a Hib se estableciese en los calendarios vacunales de los niños occidentales, los hemocultivos solían ser positivos mientras que actualmente suelen ser negativos, sobre todo en niños mayores (3,9,11,22). El escaso rendimiento de los hemocultivos lo ponen de manifiesto Rudloe et al. con 3/407 hemocultivos positivos y Seltz et al. con tan sólo un 3% de positivos (10,11). Sin embargo, en los niños en que se hace abordaje quirúrgico y se toma muestra directa, se identifica un patógeno hasta en el 81% de los casos (10).
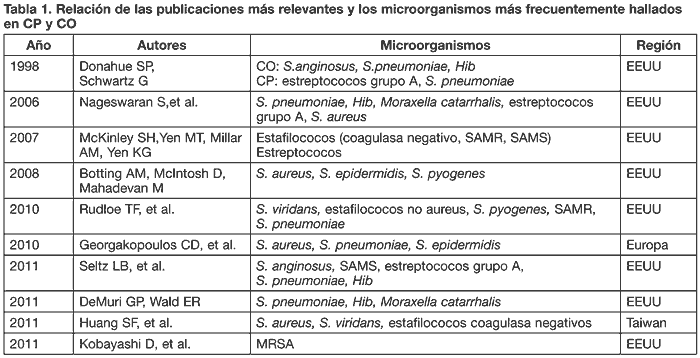
En la tabla 1 se presenta un resumen de los microorganismos más habituales según los autores más relevantes.
CLÍNICA
Dadas las implicaciones terapéuticas y pronósticas, resulta sumamente importante distinguir la CP de la CO en nuestros pacientes.
La CP se presenta con edema palpebral, que puede ser tan intenso que impida la apertura espontánea del ojo, y eritema de párpados. En general el globo ocular no está afectado y tampoco están alteradas la reactividad pupilar, la agudeza visual ni la motilidad ocular. No hay dolor con los movimientos oculares ni quemosis.
La CO se asocia a fiebre, proptosis, quemosis, oftalmoplejía asociada o no a diplopía y dolor con los movimientos del globo ocular. La disminución de la agudeza visual y las alteraciones pupilares indican afectación del vértice orbitario.
Según Sobol et al. la oftalmoplejía y la proptosis representan un valor predictivo positivo de infección orbitaria de un 97%. Su ausencia supone un valor predictivo negativo de 93% (28).
Estudios retrospectivos realizados hasta la fecha intentan orientar clínicamente el diagnóstico diferencial entre ambas entidades.
Botting et al. incluye una serie de 262 casos en niños observándose proptosis en un 94% de pacientes con CO frente a 0,9% de los que no la presentaban. La diplopía (54% frente a 0,9%) y la oftalmoplejía (11% frente a 0,4%) también parecen estar ligadas a la afectación de estructuras intraorbitarias (23).
La fiebre (temperatura> 38ºC) y la leucocitosis (total > 15.000 células/mm3) son menos comunes en los casos limitados, pero puede aparecer en niños con ambos procesos.
La recurrencia es poco habitual y suele deberse a una causa subyacente como por ejemplo anomalías en senos (29).
COMPLICACIONES
Las complicaciones son más frecuentes en los casos de CO, aunque pueden observarse en casos de CP extensa. Según series retrospectivas, la más frecuente es el absceso subperióstico (59%) seguida del absceso orbitario (24%) (10,23,26,28,30).
En una serie de 298 pacientes, sólo en un 2% de los casos en los que se realizó prueba de imagen se objetivó un absceso orbitario (11).
Otras complicaciones observadas son la disminución de la agudeza visual, trombosis del seno cavernoso, abscesos cerebrales, obstrucción de arteria central de la retina e incluso la muerte. Osguthorpe y Hochman describieron hasta un 11% de casos de disminución de la agudeza visual y hasta un 2% de fallecimientos por diseminación del proceso infeccioso en niños norteamericanos con CO (31).
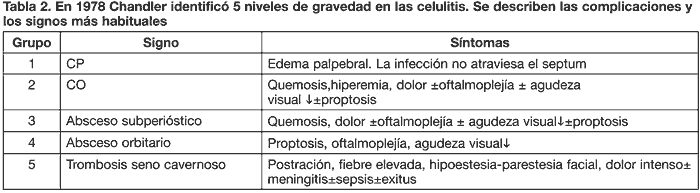
En 1978, Chandler, clasifica las complicaciones potenciales de las celulitis en edad pediátrica en 5 niveles de menor a mayor gravedad que se muestran en la tabla 2 (16).
Los abscesos subperiósticos no mediales tienen tendencia a aparecer en niños mayores y esto explica porqué niños de menos de 9 años responden mejor a terapia antibiótica aislada, y sin embargo, los mayores suelen requerir cirugía (30).
El absceso orbitario provoca un compromiso vascular y del nervio óptico que se traduce en disminución de la agudeza visual que puede ser irreversible.
La trombosis del seno cavernoso, que tiene origen en la diseminación de la infección a través de las venas avalvulares, requiere un manejo hospitalario urgente debido al riesgo vital.
DIAGNÓSTICO
El diagnostico de esta patología es principalmente clínico, siendo la anamnesis y la exploración física sus pilares fundamentales. Las pruebas de imagen pueden ser necesarias, aunque existe controversia sobre su utilización ya que la edad pediátrica es la principal afectada por esta patología y debe evitarse la radiación innecesaria siguiendo los criterios ALARA que se basan en emplear la mínima radiación que razonablemente sea necesaria para la realización de la prueba.
Respecto a las pruebas de imagen, la resonancia nuclear magnética (RNM) presenta mayor resolución en el diagnóstico de la afectación de tejidos blandos, sin embargo, no siempre se encuentra disponible. Es por ello que la tomografía computerizada (TC) es la más utilizada.
Se han definido unos criterios de indicación de pruebas de imagen: proptosis, oftalmoplejía, dolor con los movimientos, diplopía, pérdida de visión, edema, neutrofilia mayor de 10.000 células/mm3, afectación del sistema nervioso central, menores de 1 año o difícil exploración, ausencia de mejoría tras 24-48 horas de tratamiento antibiótico o empeoramiento (11,28,32). El cumplimiento de al menos uno justificaría la realización de una prueba de imagen en un niño.
Rudloe et al. realizó un estudio en 2010 en el que el 12% de los pacientes sometidos a TC presentaron hallazgos significativos. La afectación de senos maxilar y etmoidal fue la más encontrada apareciendo, respectivamente, en un 86% y 84% de los casos. La afectación múltiple de senos se observó en el 80% de los casos. Además, se evidenció que un 50,5% de los casos de absceso orbitario identificado por TC no referían clínica de oftalmoplejía, proptosis o dolor con los movimientos, de manera que se puede inferir que la vigilancia siempre hay que mantenerla a pesar de una clínica no muy florida (11).
El diagnostico precoz de las complicaciones de la CO es de gran importancia para el pronóstico visual de nuestros pacientes como bien indica Uzcátegui et al. Hasta un 10% de ellos pueden perder la visión. En su serie de 111 niños en los que se encontraron hallazgos en la prueba de imagen, 2 quedaron ciegos (34).
El grupo de Vu et al. recomienda el uso de RNM si existe sospecha de complicación intracraneal, como empiema o trombosis del seno cavernoso, debido a su mayor resolución (33).
Debido al conocimiento de la existencia de fibrosis renal post-gadolinio, el grupo americano de Sepahdari et al. estudió el papel de la DWI (Diffusion-Weighted Imaging), técnica ya utilizada previamente en patología orbitaria, frente al uso convencional de Gadolinio en el diagnóstico diferencial entre la celulitis orbitaria y el absceso orbitario. En una serie de 9 casos, constataron la presencia de complicación supurada en 6; siendo 2 de ellos pacientes pediátricos. Concluyeron que el uso de DWI aumenta la confianza en el diagnóstico de absceso orbitario, siendo una técnica rápida, por lo que proponen incluirla en todos los estudios de rutina de RNM intracraneales. Sin embargo, no ha sido capaz de desplazar al uso de Gadolinio aunque sí debe considerarse su utilización en pacientes con una insuficiencia renal ya diagnosticada para no agravar su patología (35-39).
TRATAMIENTO MÉDICO
La terapia médica se basa en antibióticos de amplio espectro orientados a tratar no sólo la celulitis, sino también los factores predisponentes como la sinusitis en caso de que existan. Los avances en la antibioterapia permiten actualmente haber reducido la morbi-mortalidad clásicamente asociada a esta patología (40). Conocer la flora local implicada es importante, ya que según el área geográfica en que nos encontremos los patógenos y sus resistencias antibióticas se modifican (3).
Tanto en la CP como en la CO varios autores proponen asociar tratamiento dirigido a la sinusitis en caso de que coexista. Estarían indicados corticoides intranasales para disminuir el edema de mucosa y facilitar el drenaje, e irrigación nasal (41).
El uso de corticoides intravenosos es controvertido ya que controla la reacción inflamatoria, aunque puede resultar peligroso al generar una inmunosupresión secundaria (3,7,42,43).
Celulitis preseptal
Respecto a los antibióticos seleccionados, debido a la escasa rentabilidad de los hemocultivos, se pautan terapias empíricas frente a los microorganismos más frecuentes ya comentados previamente (3). Además no existen estudios randomizados hasta la actualidad.
En niños mayores de un año sin problemas sistémicos asociados se inicia precozmente tratamiento antibiótico oral de amplio espectro con un seguimiento estrecho del paciente. Si en 24 horas no hay signos de mejoría, o todo lo contrario, empeora el estado, se sustituye la vía oral por la intravenosa. Siempre debe considerarse en estos casos la posibilidad de microorganismos resistentes (3).
El grupo de La Orden Izquierdo et al., a diferencia de lo comentado anteriormente, propone amoxicilina-ácido clavulánico intravenosa inicial en CP asociada o no a corticoides intravenosos en cualquier niño. Además propone tratamiento antibiótico tópico. Éste parece ser un tema controvertido (7).
Los antibióticos más usados en general son vancomicina, amoxicilina-ácido clavulánico, cefotaxima y ceftriaxona. Éstos se mantendrá entre 7 y 10 días hasta la completa desaparición de signos y síntomas (3).
Terapia parenteral inicial asociada a ingreso hospitalario se indica en menores de 1 año, pacientes no inmunizados frente a Hib y S. pneumoniae, pacientes inmunosuprimidos y aquellos que presenten evidencia de mayor severidad o toxicidad sistémica.
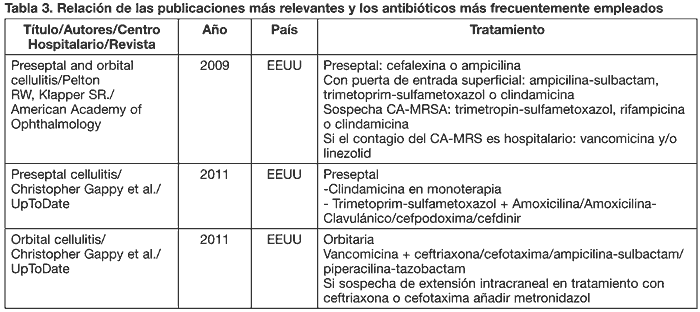
En la tabla 3 se reflejan distintas pautas terapéuticas.
Celulitis Orbitaria
Debido al número significativo de posibles complicaciones, incluyendo la muerte, el tratamiento intravenoso debe ser iniciado de forma precoz (20). La mayoría de pacientes responden bien al tratamiento antibiótico sin requerir abordaje quirúrgico.
Generalmente para conseguir cobertura amplia de cocos grampositivos, gramnegativos y anaerobios suele usarse cefotaxima y metronidazol o clindamicina simultáneamente. Otros posibles fármacos son la piperacilina-tazobactam, tiarcilina-clavulánico y ceftriaxona. En pacientes alérgicos a penicilinas puede usarse una combinación de vancomicina y una fluorquinolona (3).
Cannon et al. defiende el tratamiento de las CO mediante tratamiento antibiótico oral justificando su afirmación en la similar bioequivalencia entre la vía oral y la perenteral entre el ciprofloxacino y la clindamicina asociadas, evitando así los efectos secundarios del acceso intravenoso. Aunque su casuística es pequeña de tan sólo 36 pacientes, los resultados no son despreciables y futuras investigaciones en esta área serían interesantes (19).
No existe consenso en cuanto a la duración del tratamiento intravenoso y el paso a la vía oral pero parece razonable esperar a que el paciente se encuentre afebril con una sustancial mejoría de los signos orbitarios (39).
PROTOCOLO DEL HOSPITAL DE CRUCES
En la tabla 4 se expone el algoritmo de actuación en el Hospital Universitario de Cruces. A diferencia de la mayoría de publicaciones expuestas anteriormente, en nuestro centro el antibiótico de elección es la amoxicilina-ácido clavulánico, siendo la ceftriaxona de segunda elección.
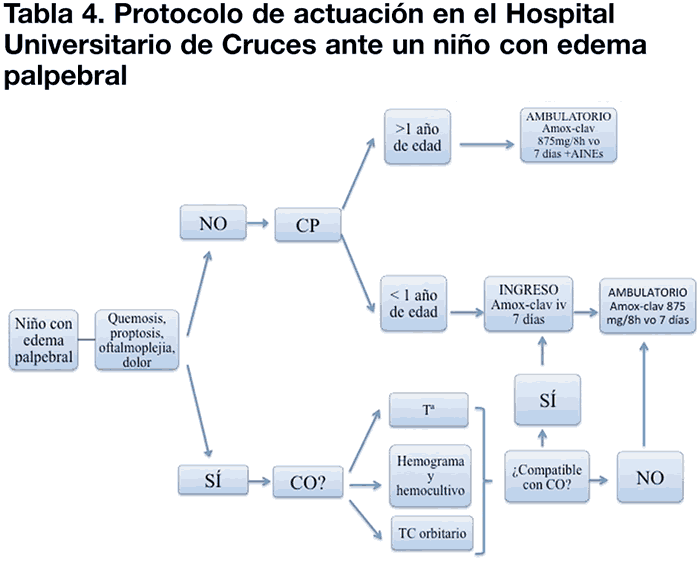
Los niños con sospecha de CP o CO son recibidos en el Servicio de Urgencias Pediátricas del Hospital Universitario de Cruces. Una vez se realiza una exploración general, los médicos pediatras envían al paciente al Servicio de Urgencias de Oftalmología del mismo centro para valoración específica de los signos y síntomas oftalmológicos. Los niños que requieren ingreso para tratamiento y control de la evolución lo hacen a cargo del Servicio de Pediatría. El Servicio de Oftalmología realiza controles diarios de agudeza visual, movimientos oculares, reactividad pupilar y exploración de polo anterior y fondo de ojo mientras el paciente se encuentre ingresado. El alta y posterior control ambulatorio se decide conjuntamente una vez haya resolución de la fiebre y de los signos oftalmológicos.
En caso de ser necesario el drenaje de un absceso orbitario y/o subperióstico, éste se realiza por un especialista en Órbita y Oculoplastia. El drenaje de senos es realizado por el Servicio de Otorrinolaringología.
TRATAMIENTO QUIRÚRGICO
Las intervenciones quirúrgicas están indicadas en casos de CO que asocian cuerpos extraños, y en algunas que se asocian a abscesos orbitarios y/o subperiósticos, pero la realidad es que no existen protocolos universalmente aceptados (20,32). Algunos cirujanos han propuesto un drenaje inmediato de abscesos, mientras que otros apuestan por la observación (20,32,44).
Los abscesos subperiósticos mediales en niños responden generalmente bien a los antibióticos siendo el drenaje quirúrgico una alternativa poco utilizada (45,46). En una serie publicada por Ryan et al. de 68 niños con absceso subperióstico, sólo 21 precisaron cirugía (30).
Según Harris, los abscesos subperiósticos pueden ser observados salvo que aparezca alguno de los criterios siguientes: edad mayor o igual a 9 años, sinusitis frontal, absceso subperióstico no medial, sospecha de infección por anaerobios, recurrencia tras drenaje quirúrgico, sinusitis crónica o compromiso del nervio óptico o retina (45).
El grupo de Todman establece el tamaño del absceso como criterio fundamental de indicar cirugía, de manera que pacientes con abscesos mayores de 10 mm de diámetro o más de 1.250 mm3 son drenados (47).
En cuanto a la técnica quirúrgica empleada, el abordaje puede ser externo o por vía endoscópica transcaruncular (48). La elección de una u otra vendrá determinada principalmente por la habilidad del cirujano y/o la localización del absceso subperióstico.
En el caso de abscesos orbitarios, que aparecen hasta en un 24% de CO según Rudloe et al., generalmente se requiere abordaje quirúrgico ya que con frecuencia asocian compromiso del nervio óptico y riesgo de complicaciones intracraneales (11,20,32).
En algunos casos es necesario drenar los senos afectados para controlar la infección. Desbridarlos sólo suele ser necesario en pacientes que presentan sinusitis destructivas. La colaboración multidisciplinar entre oftalmólogos y otorrinolaringólogos es por tanto básica en algunas ocasiones. El material drenado tanto de un absceso como de un seno debe enviarse para cultivo debido a su alta rentabilidad para así poder elegir con más exactitud la terapia antibiótica.
El manejo de las complicaciones intracraneales requiere ingreso en una unidad de cuidados intensivos, tratamiento antibiótico intravenoso enérgico y control por parte de un neurocirujano. Una terapia intensiva, sin embargo, no asegura la supervivencia del paciente debido a la elevada mortalidad de esta afección.
CONCLUSIONES
Las celulitis se clasifican en preseptales u orbitarias atendiendo a la localización del foco infeccioso-inflamatorio tomando como referencia el septum orbitario. Más frecuentes en la edad pediátrica, la etiología más habitual es la extensión por continuidad de una infección de los senos paranasales. Aunque no existe unanimidad en el microorganismo más habitual, los cocos grampositivos son los más hallados. La clínica de presentación con edema palpebral es similar en ambas aunque la CO clásicamente se caracteriza por oftalmoplejia, proptosis y dolor con los movimientos oculares. Además ésta se asocia a un mayor riesgo de complicaciones por lo que un diagnóstico exacto, apoyándose en pruebas de imagen, debe realizarse con prontitud para iniciar tratamiento antibiótico oral o intravenoso de inmediato minimizando así el potencial riesgo vital.
BIBLIOGRAFÍA
-
Rouvier H, Delmas A. anatomía humana descriptiva, topográfica y funcional.