COMUNICACIÓN SOLICITADA
Manejo clínico y quirúrgico del glaucoma congénito primario
MORALES-FERNÁNDEZ L1, MARTÍNEZ-DE-LA-CASA JM2, SAENZ-FRANCES F1, MÉNDEZ C2, GARCÍA-FEIJOO J2
Unidad de Glaucoma. Hospital
Clínico San Carlos. Madrid
1 Licenciada en Medicina.
2 Doctor en Medicina.
RESUMEN
El glaucoma congénito primario (GCP) es una enfermedad poco frecuente cuya incidencia se estima en 1 de cada 10.000/15.000 nacidos vivos (población mundial) sin embargo esta cifra parece ser sensiblemente inferior en nuestro país (2.85/100000 nacidos vivos) (1).
El GCP se caracteriza fundamentalmente por una alteración a nivel del ángulo iridocorneal y más específicamente de la malla trabecular que interfiere al flujo normal del humor acuoso con la consiguiente elevación de la presión intraocular (2).
Dada la corta edad al diagnóstico, este aumento de la presión intraocular (PIO) provoca un daño progresivo del nervio óptico como ocurre también en otros tipos de glaucoma, sin embargo como consecuencia de la gran distensibilidad de las estructuras oculares en los primeros años de vida, se produce un aumento de los diámetros corneales y de la longitud axial del globo (3).
La inmensa mayoría de estos cuadros son esporádicos, sin embargo se ha descrito un patrón de herencia autósomico-recesivo con penetrancia incompleta hasta en un alto porcentaje de los casos, lo que hace fundamental considerar el análisis de los genes conocidos así como el consejo genético en las familias afectadas (1).
A continuación se expone brevemente el manejo del glaucoma congénito primario (diagnóstico y tratamiento) así como las distintas mutaciones genéticas implicadas en esta patología.
DIAGNÓSTICO Y SEGUIMIENTO
La triada clásica (lagrimeo, fotofobia y blefarospasmo) es fundamental para el diagnóstico de sospecha del GCP. Estos síntomas no son exclusivos de este cuadro clínico por lo que el diagnóstico diferencial es fundamental (4).
La corta edad de estos niños y la dificultad para establecer el diagnóstico y su seguimiento, hace necesario que en la mayoría de los casos y hasta que la edad y colaboración nos lo permita, debamos realizar una exploración bajo anestesia general. La exploración ha de llevarse a cabo de un modo sistematizado, fundamentalmente atendiendo al momento de la medición como el tipo de anestesia utilizada puesto que puede hacer variar el resultado de ciertos parámetros, principalmente la PIO.
Toda exploración debe incluir (fig. 1):
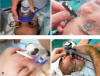
Fig. 1: La exploración bajo
anestesia (a) nos permite realizar las mediciones biométricas y explorar el polo
anterior y posterior (b). El tonómetro de aplanación Perkins es el más utilizado
(c) sin embargo existen otras alternativas útiles como Icare Pro (d).
-
Medición de los diámetros corneales: se realiza utilizando un compás de estrabismo. Se deben medir tanto el diámetro horizontal como el diámetro vertical.
-
Gonioscopia: La visualización del ángulo solo se puede llevar a cabo si existe una buena transparencia corneal (2). Gonioscópicamente podemos encontrar los siguientes hallazgos: a) membrana de Barkan, de aspecto transparente que tapiza la malla trabecular; b) Membrana de coloración blanquecina que tapiza el ángulo, probablemente sea la evolución de la anterior; c) Una inserción alta del iris, cerca o prácticamente a nivel de la linea de Schwalbe; y/o d) restos mesodérmicos.
-
Biometría. La medición de la longitud axial es útil tanto para el diagnóstico como para evaluar la progresión de la enfermedad.
-
Exploración del polo anterior utilizando el microscopio quirúrgico, para examinar las posibles alteraciones del segmento anterior, la transparencia corneal, estrías de Haab, el aspecto del iris, la presencia y posición del cristalino… (2-4).
-
Exploración del fondo de ojo: permite observar el nervio óptico y descartar cualquier posible alteración retinocoroidea asociada.
-
Tonometría. La realizaremos al final de la exploración para minimizar el efecto de los anestésicos. Se lleva a cabo de forma estandarizada, con el tonómetro de aplanación manual tipo Perkins, sin embargo en los últimos años han aparecido nuevos tonómetros que podrían considerarse de utilidad en este grupo de pacientes (tonometría de rebote Icare-Pro, Tonopen…) (5).
TRATAMIENTO
El tratamiento del GCP es principalmente quirúrgico dada la mala respuesta al tratamiento farmacológico. El tratamiento médico, a diferencia del adulto queda reducido a ciertos supuestos: en espera de una cirugía como tratamiento transitorio, tratando de recuperar la transparencia corneal ante la presencia de edema que dificulta la goniotomía o bien en pacientes con múltiples cirugías en los que el tratamiento médico logra demorar nuevas intervenciones.
Como tratamiento quirúrgico existen multitud de técnicas utilizadas en el GCP, sin embargo expondremos los procedimientos más frecuentemente utilizados.
Goniotomía
Es la técnica más utilizada en el glaucoma congénito, descrita ya desde el año 1938 y que ha sufrido pocos cambios desde entonces (6). El mecanismo de acción de la goniotomía es abrir una vía de drenaje del humor acuso hacia el canal de Schelmm, además de seccionar el tejido que en ocasiones recubre el ángulo iridocorneal. En los casos de inserción alta del iris, tras la goniotomía el iris puede descender, ensanchándose el ángulo irido-corneal.
Para conseguir una buena visualización del ángulo es precisa una luz coaxial y un gonioscopio. Existen múltiples gonioscopios (Barkan, Koeppe, Worst, Swan…). En nuestro caso, utilizamos la lente de Worst que se sujeta a la superficie ocular mediante 4 puntos de fijación y permite al propio cirujano controlar así los movimientos del globo ocular. Esta lente de Worst presenta un sistema de irrigación propia que mantiene buena visibilidad de la cámara anterior durante toda la cirugía. Del mismo modo, existe un gran número de goniotomos pero el más empleado en la actualidad es el hiodrostático de Worst. El goniotomo se introduce a nivel del limbo en el extremo opuesto a la zona en la que se quiere llevar a cabo la goniotomía. Se realizan aproximadamente 120º de ángulo, por lo tanto, se puede repetir hasta en tres ocasiones en un mismo ojo (fig. 2).

Fig. 2: Goniotomía: La lente de
Worst permite la visualización del ángulo (a) y la entrada a cámara anterior
(b). Tras la sección de hasta 120 grados utilizando el goniotomo (c), se cierra
mediante una sutura simple (d).
El éxito de la gonitomía convencional varía según la serie estudiada, aunque la tasa de control varía desde un 33% hasta un 100%. Sin embargo las mayores series publicadas fueron las de Bietti (7) y Shaffer (8) y todos ellos coinciden con un porcentaje de control entre el 68%-77%. Shaffer estudió 205 ojos intervenidos con goniotomía, obteniendo un porcentaje de control de 77%. Para Shaffer los resultados son mucho mejores (90% de control) cuando se diagnosticaron entre el nacimiento y los 2 años de vida, pero mucho peores cuando fueron diagnosticados fuera de este periodo (30% de control).
La complicación más frecuente de la goniotomía es sin duda el sangrado del ángulo durante la intervención y por tanto el hipema post quirúrgico que en la mayoría de los casos es escaso y se resuelve a los pocos días. Otras complicaciones más graves pero infrecuentes son la rotura de la cápsula anterior del cristalino o la sección accidental de la membrana de Descemet con el goniotomo.
Trabeculectomía
La trabeculectomía en el GC no es muy diferente a la cirugía del adulto. La técnica quirúrgica es la siguiente (fig. 3): se realiza un colgajo conjuntival con base fórnix (aunque algunos autores continúan prefiriendo la apertura clásica, base limbo) seguida de dos esclerotomías verticales que se unen mediante una horizontal aproximadamente 1 mm por delante de la inserción del recto superior. La disección del tapete superior se realiza a una profundidad de 2/3 del grosor total de la esclera y se continúa hasta haber penetrado 2 mm en córnea. El tallado del tapete profundo se realiza con vannas o cuchillete y a continuación se realiza la iridectomía basal y amplia. El cierre de la esclera será mediante sutura de Nylon 10/0 y la de la conjuntiva con Vicryl 8/0 (9).
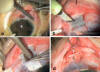
Fig. 3: Trabeculectomía: tras la
disección de la conjuntiva (a) se talla el tapete superficial (b). Tras
completar el tapete profundo y la iridectomía (c), se concluye con el cierre de
la esclera y conjuntiva (d).
Con respecto al glaucoma del adulto, la principal diferencia que encontramos es la extrema delgadez de la esclera, que dificulta notablemente la cirugía. Del mismo modo, la distensión del limbo esclerocorneal en estos pacientes nos obliga a penetrar más profundamente en córnea para asegurarnos que incluimos el trabeculum. Es importante considerar la alta probabilidad de reintervención en estos casos, por lo que es conveniente desplazar la trabeculectomía hacia nasal, permitiendo que haya espacio suficiente para una segunda trabeculectomía de ser necesario.
Varios autores como Dureau (9) nos muestras tasas de éxito de la trabeculectomía en este grupo de pacientes de un 69% tras una única cirugía durante un seguimiento de 57meses. En muchos de los casos nos encontramos ante la necesidad de una segunda trabeculectomía o incluso 3 ó 4, pudiendo realizarse en el cuadrante inferior, a pesar de ser una posición poco habitual (10,11) (posición controvertida según los autores). Es importante destacar la edad como un factor pronóstico fundamental, concluyendo que a menor edad de la primera cirugía, menor será la tasa de éxito y peor el pronóstico (9).
Las complicaciones de la trabeculectomía son más frecuentes y más graves que las asociadas a la técnica anterior (goniotomía). La aparición de hipotonías, hemorragias coroideas, vitreorragias e incluso endoftalmitis, es mas frecuente que en el caso de la goniotomía, por lo que la trabeculectomía no es, para la mayoría de los autores, la primera elección.
Implantes valvulares
Los implantes valvulares quedan reservados para aquellos pacientes que no han sido controlados a pesar de varias cirugías. Molteno fue el primero en utilizar estos implantes en el GCP. Actualmente existen varios tipos (Ahmed, Baerveldt…); sin embargo el modelo de elección es la válvula de Ahmed. Consta de un tubo de silastic conectado a unas membranas de silicona que actúan como válvula y que van unidas a una plataforma de polipropileno de 185 mm2. La válvula esta diseñada para permitir la salida de humor acuoso cuando la PIO supera los 8 mmHg.
La técnica quirúrgica es similar a la del adulto excepto ciertas salvedades. Se prefiere del mismo modo el cuadrante superotemporal. Tras la disección de la conjuntiva y tenon se realiza el purgado y comprobación del correcto funcionamiento de la válvula. Se coloca el cuerpo valvular entre el recto lateral y superior, y se fija a 8-9 mm de limbo mediante nylon 9/0. Tras determinar la longitud del tubo, se recorta con un trayecto biselado y se introduce en la cámara anterior o posterior, a través de la esclera a 1mm de limbo. Una vez recubierto el trayecto del tubo exterior con un parche de esclera se cierra la conjuntiva con sutura continua.
Según que estudio publicado, existen unas tasas de éxito variables desde un 90% a un 70 % de los casos al cabo de 12 meses de seguimiento (12,13), disminuyendo considerablemente a los 24meses, con resultados desde un 58% hasta un 64% (12,13). Por otro lado, si evaluamos el resultado de estos implantes en un plazo de 5 años, los resultados se reducen en torno a un 33% de éxito, estas tasas aumentan si consideramos un segundo implante, mejorando a un 69% (14). Cabe considerar el uso de Mitomicina-C en la cirugía de la válvula tal y como se utiliza en la cirugía del adulto (15). Sin embargo los resultados parecen ser contradictorios, puesto que la tasa de éxito es menor en los casos que se emplea esta sustancia. Podría deberse a un aumento de la fibrosis en torno al dispositivo en este grupo de pacientes.
Entre las complicaciones de los implantes valvulares merecen mención los secundarios al tubo: una mala posición (cerca del cristalino o del endotelio…), una dirección anómala del trayecto, la longitud u obstrucción del mismo. Otras serían la fibrosis perivalvular, la extrusión del implante o la diplopia.
ESTUDIO GENÉTICO EN EL GLAUCOMA CONGÉNITO PRIMARIO
Se consideraba que la mayoría de los casos de GCP eran esporádicos sin embargo los últimos estudios revelan que presenta un patrón de herencia autosómica recesiva con penetrancia incompleta y expresividad variable, siendo las mutaciones del gen CYP1B1 las más frecuentemente asociadas (16).
Existen tres locus genéticos que parecen estar directamente relacionados con el GCP: GLC3A (2p21) y GLC3B (1p36) (por mapeo se situó a esta región en 1p36.2-1p36.1 adyacente a los locus de neuroblastoma y Charcot-Mare-Tooth tipo 2A) y GLC3C (14q24.3) (17). A pesar de que estos 3 locus son bien referenciados en la literatura, hasta la fecha únicamente se ha relacionado el gen CYP1B1 con el locus GLC3A. El segundo y tercero por tanto, corresponden a genes no identificados.
El gen CYP450 se considera como el factor genético principal, implicado en el GCP y la frecuencia de mutación llega a representar el 85% de los casos. CYP1B1 forma parte de la superfamilia del citocromo P450, sintetizando una proteína con actividad catalítica expresada en el ojo fetal y adulto, especialmente en el iris, la red trabecular y el cuerpo ciliar y por ello su implicación en el GCP (18,1).
Si bien las mutaciones de CYP1B1 también han sido descritas en otras formas de glaucoma de inicio temprano asociadas a anomalías congénitas del segmento anterior, estas no son consideradas como GCP, así como la anomalía de Rieger o de Peters. Merece mención especial la posible relación del gen MYOC (myocilin) y el gen FOXC1 (forkhead box C1) con el GCP, que han sido mapeadas en los cromosomas 1q21-q31 y 6p25 respectivamente.
Para concluir, dada la alta asociación del gen CYP1B1 con el GCP y la potencial gravedad del cuadro actualmente consideramos aconsejable realizar un estudio genético detallado del entorno familiar y elaborar un adecuado consejo genético.
BIBLIOGRAFÍA
-
CYP 1B1 mutations in Spanish patients with primary congenital glaucoma: phenotypic and functional variability. Campos- Mollo E, López-Garrido MP, Blanco-Marchite C, Garcia-Feijoó J, Peralta J, Belmonte-Martinez J, Ayuso C, Escribano J. Mol Vis. 2009; 15: 417-31.
-
Allen L, Burion HM, Braley AE. A new concept of development of anterior chamber angle: Its relationship to developmental glaucoma an other structural anomalies. Arch Ophthalmol 1955; 53, 783-98.
-
Anderson DR. The development of the trabecular meshwork and its abnormality in primary infantile glaucoma. Am Ophthamol 1981; 79, 458-485.
-
Kupfer C, Kaiser-Kupfer M. Observations on the development of the anterior chamber angle with reference to the patogenesis of congenital glaucomas. Am J Ophthalmol 1979; 88, 424-26.
-
Martinez-de-la-Casa JM, Garcia-Feijoo J, Saenz-Frances F, Vizzeri G, Fernandez-Vidal A, Mendez-Hernandez C, Garcia-Sanchez J. Comparison of rebound tonometer and Goldmann handheld applanation tonometer in congenital glaucoma. J Glaucoma. 2009 Jan; 18(1): 49-52.
-
Shaffer RN. Goniotomy technique in congenital glaucoma. Am J Ophthalmol. 1959 May; 47(5, Part 2): 90-7.
-
Bietti GB, Quaranta CA. Indications for, and results of the operation of incision of the iridocorneal angle (goniotomy, goniotrabeculotomy or trabeculotomy). Vestn Oftalmol. 1968 May-Jun; 81(3): 9-21.
-
Shaffer RN. Prognosis of goniotomy in primary infantile glaucoma (trabeculodysgenesis). Trans Am Ophthalmol Soc. 1982; 80: 321-5.
-
Dureau P, Dollfus H, Cassegrain C, Dufier JL. Long-term results of trabeculectomy for congenital glaucoma. J Pediatr Ophthalmol Strabismus. 1998 Jul-Aug; 35(4): 198-202.
-
Mandal AK, Gothwal VK, Bagga H, Nutheti R, Mansoori T. Outcome of surgery on infants younger than 1 month with congenital glaucoma. Ophthalmology. 2003 Oct; 110(10): 1909-15.
-
Kothari M, Balankhe S. Inferior trabeculotomy and trabeculectomyfor refractory pediatric glaucomas. Indian J Ophthalmol. 2011 Jul-Aug; 59(4): 323.
-
Djodeyre MR, Peralta Calvo J, Abelairas Gomez J. Clinical evaluation and risk factors of time to failure of Ahmed Glaucoma Valve implant in pediatric patients. Ophthalmology. 2001 Mar; 108(3): 614-20.
-
Englert JA, Freedman SF, Cox TA. The Ahmed valve in refractory pediatric glaucoma. Am J Ophthalmol. 1999 Jan; 127(1): 34-42.
-
Ou Y, Yu F, Law SK, Coleman AL, Caprioli J.Outcomes of Ahmed glaucoma valve implantation in children with primary congenital glaucoma. Arch Ophthalmol. 2009 Nov; 127(11): 1436-41.
-
Al-Mobarak F, Khan AO.Two-year survival of Ahmed valve implantation in the first 2 years of life with and without intraoperative mitomycin-C. Ophthalmology. 2009 Oct; 116(10): 1862-5.
-
Vincent AL, Billingsley G, Buys Y, Levin AV, Priston M, Trope G, et al. Digenic inheritance of early-onset glaucoma: CYP1B1, a potential modifier gene. Am J Hum Genet 2002; 70: 448-60.
-
Batiyeva S, Marfany G, Gonzalez-Angulo O, Gonzalez-Duarte R. Mutational screening of CYP1B1 in Turkish PCG families and functional analyses of newly detected mutations. Mol Vis 2007; 13: 1458-68.
-
Stoilov IR, Costa VP, Vasconcellos JP, Melo MB, Betinjane AJ, Carani JC, Oltrongge EV, Sarfarazi M. Molecular genetics of primary congenital glaucoma in Brazil. Invest Ophthalmol Vis Sci 2002; 43: 1820-7.