Dres. Rivas L1, Oroza M.ªA1, Sanz AI1, Shalaby O2, Murube J3
(1) Servicio de
Oftalmología. Hospital Ramón y Cajal. Madrid.
(2) Departamento de Oftalmología. Hospital de Tanta. Tanta. Egipto.
(3) Departamento de Oftalmología. Facultad de Medicina. Universidad de Alcalá
de Henares. Madrid.
Introducción
El aparato lagrimal humano tiene como función principal mantener la córnea húmeda, produciendo un líquido acuoso salino rico en proteínas, que va a formar la capa intermedia de la película lagrimal. Está formado por tres regiones anátomo-funcionales: glándulas lagrimales, vías lagrimales y cuenca lagrimal. La glándula lagrimal es una estructura que se encuentra localizada en la porción superior-externa de la órbita, constituida por lóbulos cuya estructura es de tipo túbulo-alveolar compuesto, semejante a la de las glándulas salivales, organizadas en acinos secretores de células serosas y rodeadas por células mioepiteliales. Existe una red de conductos excretores, cada vez de mayor calibre por donde se elimina el producto secretado por las células acinares, hasta llegar a la cuenca lagrimal. En estos conductos se puede observar, entre las células cuboides típicas, células caliciformes secretoras de mucina (1-3).
El síndrome de Sjögren primario (SS1) es una enfermedad inflamatoria crónica multisistémica, de progresión lenta, de etiología desconocida y de patogenia autoinmune, que se define por la afectación linfocitaria de las glándulas exocrinas (4), lo cual provoca la disminución en la secreción lagrimal y salival, produciendo una queratoconjuntivitis seca (QCS) y una xerostomía (3,5). Es un síndrome con numerosas manifestaciones sistémicas extraglandulares; aproximadamente un tercio de estos enfermos presentan inicialmente manifestaciones ginecológicas, dermatológicas, respiratorias, gastrointestinales, neurológicas, renales, vasculares y musculares (6,7). El SS1 es una enfermedad que predomina en las mujeres (9:1), con un inicio mayoritario de la enfermedad (90%) entre los 40 y 60 años de edad, aunque es posible su comienzo a cualquier edad, incluso en la infancia (8). No se han descrito diferencias raciales, ni agentes medioambientales, aunque sí se ha observado una relación familiar, vírica o neuroendocrina (9).
Las glándulas exocrinas son los órganos diana de este proceso autoinmune (4). De forma general, se acepta que en el curso evolutivo del proceso inflamatorio se produce la pérdida del parénquima glandular funcional y la destrucción acinar, con la consiguiente hipofunción glandular (10,11). La glándula lagrimal principal muestra densos infiltrados linfocíticos, siendo los linfocitos B las células predominantes, porcentaje mucho más alto que en las glándulas salivales (11). Las células T CD4 son el siguiente tipo celular más común, rodeando a los agregados de células B, mientras que las células T CD8 y los macrófagos han sido encontrados en pequeña cantidad (5,12).
Este síndrome se asocia a un amplio número de autoanticuerpos, aunque ninguno de ellos es específico de la enfermedad. Los anticuerpos anti-Ro (SS-A) y anti-La (SS-B) son más prevalentes en los pacientes con SS1, principalmente el primero (13). La incidencia de estos autoanticuerpos contra Ro/SS-A y La/SS-B varía según los diferentes autores. La mayoría de los pacientes con SS1 también tienen títulos de anticuerpos antinucleares moderados o altos (5). La presencia de un factor reumatoide anormal, para muchos autores, es la determinación más frecuente (9). Por último, existe un incremento difuso de inmunoglobulinas policlonales; así, muchos de los pacientes tienen un aumento leve en la concentración sérica de IgG, IgA e IgM (14).
Los síntomas subjetivos oculares son muy variados e indican distinta agresividad ocular. La afección ocular más grave puede ocasionar úlcera corneal, vascularización con opacidad o perforación corneal (15). La manifestación oral más habitual es la sequedad bucal, a menudo asociada con sensación de quemadura y dificultad para deglutir comidas secas. La mucosa bucal está seca y eritematosa, la lengua tiene fisuras, está despapilada y se ulcera fácilmente (16). En el curso evolutivo de la enfermedad es posible que se produzcan episodios aislados o recurrentes de tumefacción de todas las glándulas salivales principales (7). La afectación de las glándulas parótidas en pacientes con SS1 no siempre está clínicamente presente, variando la frecuencia de aparición según los diferentes autores. Las glándulas submaxilares también sufren un aumento significativo de tamaño, aunque menos frecuentemente, con rápidas fluctuaciones intermitentes en su tamaño (5).
El diagnóstico del SS1 suele acompañarse de estudios anatomopatológicos, debido a la altísima sensibilidad y especificidad de las técnicas morfológicas, aunque generalmente se centran en la biopsia de glándulas salivales menores; así, se puede establecer un gradiente de intensidad de la enfermedad sobre el conjunto de las glándulas exocrinas (17,18).
En la literatura hay escaso número de trabajos sobre la morfología de las glándulas lagrimales en pacientes con SS1 y los pocos estudios realizados a nivel ultraestructurales fueron efectuados en glándulas lagrimales normales. Además, no existe ningún estudio morfométrico sobre las células acinares de la glándula lagrimal principal, ni en personas sanas ni en pacientes con SS1. Tampoco hay trabajos que estudien conjuntamente la glándula lagrimal principal con las estructuras epiteliales y del tejido conectivo próximas.
Por todo ello, la finalidad del presente trabajo consiste en realizar un estudio anatomopatológico profundo tanto de las alteraciones en el parénquima como en el tejido conectivo que lo rodea, un estudio pormenorizado de la población de células inflamatorias y un análisis morfométrico, inédito, de la glándula lagrimal en pacientes con SS1, comparándola con la de los pacientes con QCS, dentro del contexto de la reacción inflamatoria general de las glándulas exocrinas, con el fin de poder destacar el componente sistémico de la enfermedad, debido a las diferencias halladas en la involución morfo-funcional de la glándula lagrimal principal, tanto a nivel de los acinos como de los conductos secretores y del tejido conectivo que los rodea. Por último, se pretende estudiar todas las técnicas, a nuestro alcance, para poder describir lo mejor posible el estado funcional de la glándula lagrimal principal.
Pacientes, material y métodos
En la selección de los pacientes, técnicas aplicadas y manejo de las muestras se cumplieron todas las normas internacionales y nacionales para el estudio clínico, siendo avalada por el Comité Ético del Hospital. A todos los pacientes se les solicitó por escrito la aceptación de su participación en el presente trabajo.
Los pacientes con SS1 fueron diagnosticados en el Servicio de Reumatología del Hospital Ramón y Cajal, de Madrid y remitidos al Servicio de Oftalmología para su evaluación ocular, antes de iniciar cualquier tratamiento médico. Estos enfermos fueron enviados nuevamente al Servicio de Reumatología para su posterior tratamiento y seguimiento clínico. La severidad clínica de los 35 pacientes participantes fue graduada de acuerdo con los criterios de la Comunidad Europea (19); de ellos, 28 fueron mujeres (80%) y 7 hombres (20%), con edades comprendidas entre los 31 y 82 años (57 años de edad media). Los pacientes fueron clasificados en 3 grupos de severidad (9 pacientes con grado I; 12, con grado II; y 14, con grado III). El número de pacientes con QCS no asociada a enfermedad sistémica fue de 45, de los cuales 34 fueron mujeres (75,6%) y 11 fueron hombres (24,4%), con edades comprendidas entre los 30 y 85 años (60 años de media). Estos pacientes fueron divididos en 3 grupos de severidad clínica (cada uno compuesto por 14 pacientes) según el criterio de la clasificación clínica propuesta por Murube (20). Como controles, participaron otras 14 personas sanas (grado 0) sin alteraciones clínicas oftalmológicas ni orales, que iban a ser intervenidas quirúrgicamente de cataratas, de los cuales 11 fueron mujeres (78,6%) y 3 fueron hombres (21,4%), con edades comprendidas entre los 35 y 78 años (61 años de media).
A todas las personas, tanto enfermos como controles, se les realizó, en la Unidad del Ojo Seco de nuestro Servicio de Oftalmología, un protocolo que incluyó la historia clínica, un examen completo con lámpara de hendidura, pruebas clínicas, de laboratorio e histopatológicas. Las muestras fueron obtenidas en la misma secuencia, y en tres días consecutivos. El primer día se realizó el estudio con fentobiomicroscopia y la historia clínica. En el segundo día se realizaron las pruebas clínicas y de laboratorio. Por último, el tercer día se dedicó a la obtención de la citología de impresión y de la biopsia (la mitad de la pieza fue para el estudio mediante citometría de flujo y la otra mitad para el estudio morfológico).
Pruebas oftalmológicas clínicas y de laboratorio
Para el diagnóstico de la QCS hemos incluido las siguientes:
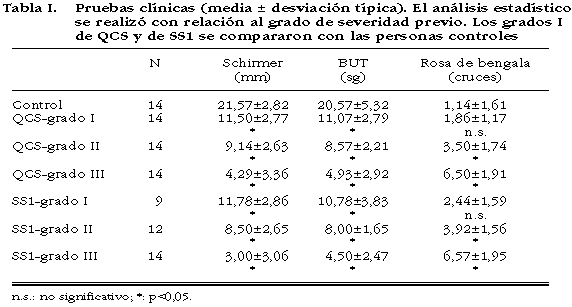
1. Prueba de Schirmer. Por debajo de 10 mm a los 5 minutos indicó sequedad ocular.
2. La tinción con rosa de bengala. Los ojos con más de 4 cruces, en una escala total de 0 a 9 cruces, indicaron alteraciones en la superficie ocular (21).
3. El tiempo de ruptura de la película lagrimal (BUT) por debajo de 10 segundos indicó una película lagrimal inestable (22).
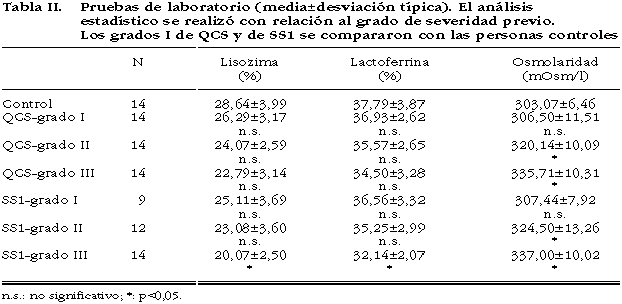
4. En el proteinograma de la lágrima, la fracción de lactoferrina junto a las inmunoglobulinas representó entre el 35 y el 45% de las proteínas lagrimales totales y la lisozima poseyó un porcentaje normal desde el 25 al 35% (14).
5. La osmolaridad de la lágrima tuvo un valor alterado por encima de 312 mOsm/l (23,24).
Citometría de flujo
La citometría de flujo permite analizar los marcadores de superficie de las células mononucleares aisladas por un clasificador de células. Es una técnica destinada fundamentalmente al estudio de las células sanguíneas, aunque se puede utilizar cualquier tipo de tejido, como en este caso la glándula lagrimal principal. Los antígenos fueron identificados mediante anticuerpos monoclonales conjugados con diferentes fluorocromos. El estudio de la población linfocitaria se realizó en el tejido periacinar de la glándula. La detección de los diferentes antígenos de superficie en los linfocitos se realizó utilizando una técnica de inmunofluorescencia directa y posterior análisis en un citómetro de flujo (FACScan; Becton Dickinson, Mountain View, CA). Las células se analizaron utilizando el programa LYSYS II (25).
Pruebas histopatológicas
Las pruebas histopatológicas incluidas en este trabajo consistieron en el estudio de biopsia de la glándula lagrimal principal y del fórnix conjuntival superior, recogidas a la vez en la misma muestra. La biopsia fue realizada bajo anestesia tópica seguida de una inyección subconjuntival y supratemporal de lidocaína al 2% con adrenalina. Se prolapsó el lóbulo palpebral de la glándula lagrimal y se extrajo un pequeño fragmento cilíndrico de tejido de unos 3-4 mm de diámetro y se colocó inmediatamente en el líquido fijador. No hizo falta sutura. La puntuación utilizada para la graduación de la severidad de las biopsias de la glándula lagrimal fue la misma que la utilizada en las biopsias de glándulas salivales menores, según la escala de Chisholm y Mason (26), siendo necesaria la aparición de una sialoadenitis con uno o más focos. El foco está definido como una acumulación de al menos 50 linfocitos, en 4 mm2 de tejido. En una escala de 0-III grados, el grado 0 es totalmente normal, sin apenas células inflamatorias. El grado I posee linfocitos dispersos, sin formar acúmulos. El grado II presenta un foco de 50 o más células mononucleares por 4 mm2 de tejido y en el grado III requiere que existan dos o más focos por 4 mm2.
El procesamiento instrumental de las biopsias siguió el protocolo habitual en un laboratorio de Anatomía Patológica. Las biopsias de las glándulas lagrimales se fijaron, por inmersión, en glutaraldehído al 1,5% tamponado en cacodilato sódico pH 7,4. Después de un lavado con el mismo tampón se realizó una segunda fijación en tetróxido de osmio al 1% en tampón Palade pH 7,4. A continuación se deshidrataron en concentraciones crecientes de acetona (30%, 50%, 70%, 90%, 100% y óxido de propileno). El medio de contraste consistió en una solución de acetato de uranilo al 2% añadido a la acetona al 70%, proporcionando así un mayor contraste a las membranas del tejido. La inclusión se realizó en Araldita (Durcupan-Ciba), comenzando por una mezcla de Araldita I en óxido de propileno en proporciones sucesivas de 1:3, 2:2 y 3:1, seguido por un paso en Araldita I 100% y otro paso en Araldita II (formada por los mismos componentes que la Araldita I más un acelerador). Por último, las muestras se endurecieron en cápsulas de gelatina cubiertas con Araldita II.
Los cortes histológicos para el estudio óptico se obtuvieron indistintamente de un grosor de 2 o de 10 micras, para observar la estructura semifina o habitual. La tinción para los cortes semifinos se realizó con azules de Richardson, mientras que los cortes de 10 micras de grosor se tiñeron con hematoxilina-eosina. Los cortes fueron observados y fotografiados en un microscopio óptico Nikon. El seccionamiento de las muestras para microscopia electrónica se realizó con un grosor entre 60-70 nm. Estos cortes se depositaron sobre rejillas cubiertas por una membrana transparente de «formvard», para su mejor extensión y soporte. Las muestras se tiñeron con citrato de plomo según el método de Reynolds. Los cortes ultrafinos fueron observados y fotografiados en un microscopio electrónico Jeol 1200.
Morfometría
Para el estudio morfométrico hemos trabajado sobre fotografías de tamaño 10x15 cm. Se emplearon, para su cuantificación, un equipo de análisis de imagen compuesto por un microscopio Nikon Ophtiphot-2 dotado de equipo de fotografía Microflex-Dx y de una videocámara en color EVI-1011P acoplada a un monitor Sony Black Trinitron KT-14 CP1. El sistema está basado en el software IPP-Plus de Image Pro/Media Cibermetics y el sistema CAD. Las fotografías fueron obtenidas a 40 aumentos. Las variaciones estudiadas fueron: la determinación del área celular, el perímetro celular, esfericidad celular, eje mayor y menor, diámetro celular medio, relación de radios celulares y la relación núcleo-citoplasma. Los estudios cuantitativos de las células caliciformes se realizaron sobre un retículo cuadriculado calibrado, a 400 aumentos. La densidad media de las células caliciformes se obtuvo contando 10 áreas de cada muestra, al azar, expresándose en milímetros cuadrados.
Análisis estadístico
Con el fin de recoger y almacenar los resultados de las diferentes pruebas se elaboró distintas bases de datos. El análisis estadístico de las bases de datos se realizó con el paquete de procesamientos estadísticos SPSS, cedido por la Unidad de Bioestadística Clínica del Hospital Ramón y Cajal.
Para la descripción de los datos finales se utilizó la media y las desviaciones típicas, tanto para la muestra total como para los grupos de individuos del mismo orden de severidad de la enfermedad. Las pruebas estadísticas aplicadas a nuestros resultados fueron: la prueba de la t de Student, para la comparación y correlación de las medias, y la prueba de correlación no-paramétrico de Spearman, con el fin de estudiar los datos de rango o continuos y así determinar la relación de los niveles de las distintas pruebas. Se consideraron resultados estadísticamente significativos a todos aquellos que mostraron una probabilidad superior al 95% (p<0,05).
Resultados
Todos los pacientes con SS1 presentaron más de una manifestación sistémica a la vez, mientras que ningún paciente con QCS o persona sana presentó manifestaciones sistémicas. Igualmente presentaron alteraciones en más de cuatro pruebas, entre las determinaciones séricas, lagrimales, orales y morfológicas realizadas en el presente estudio.
Los ojos de los pacientes con SS1 no tuvieron diferencias significativas con respecto a los pacientes con QCS al ser estudiados con lámpara de hendidura. Sólo 7 pacientes con SS1 y 6 con QCS presentaron una moderada hiperemia. En otros 3 pacientes con SS1 y en 1 con QCS se observó queratitis punctata con erosiones corneales, y otro paciente con SS1 mostró una queratinización casi total de la córnea.
Pruebas clínicas
Los resultados de las pruebas clínicas están descritos en la tabla I. En las pruebas de Schirmer, BUT y tinción con rosa de bengala se observaron diferencias significativas entre todos los grados de severidad, tanto en el SS1 como en la QCS. La tinción con rosa de bengala presentó el mismo patrón excepto entre las personas sanas y los pacientes con grados I en ambos síndromes, donde no hubo diferencias significativas. Al comparar los pacientes con SS1 y QCS no se observó diferencias significativas dentro del mismo grado de severidad, en ninguna de las tres pruebas clínicas estudiadas.

Pruebas de laboratorio
Los valores del proteinograma (lisozima y lactoferrina) y de la osmolaridad de la lágrima están descritos en la tabla II. Tanto en las determinaciones de la lisozima como de la lactoferrina sólo se observaron diferencias significativas entre el grado III de los pacientes con SS1 respecto a los anteriores grados de severidad. Al comparar el SS1 y la QCS sólo hubo diferencias significativas entre los grados III. La osmolaridad de la lágrima mostró diferencias significativas entre todos los grados de severidad en el SS1, no así entre el grado I y los controles. No hubo diferencias significativas entre el SS1 y la QCS (tabla II).
El diagnóstico oral fue realizado mediante la gammagrafía de las glándulas parótidas, consistente en una disminución de la captación y excreción, se observó en 6 pacientes (66,7%) con SS1-grado I, en 10 pacientes (83,3%) con SS1-grado II y en los 14 pacientes (100%) con SS1-grado III. Tanto en los pacientes con QCS como en las personas controles no hubo ningún caso de disminución en la captación y excreción glandular.
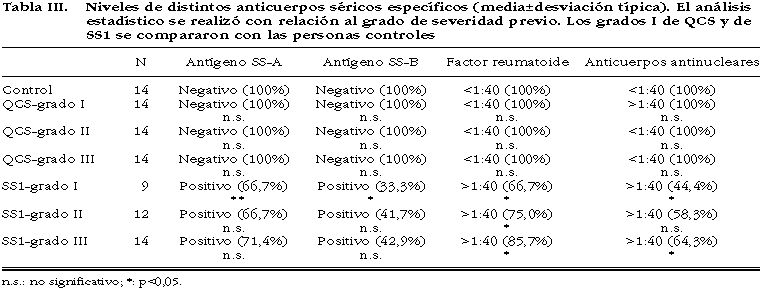
La presencia de anticuerpos contra el antígeno SS-A (anti-Ro) en el suero de pacientes con SS1 indicaron que no hubo diferencias significativas entre los tres grados de severidad. La presencia de anticuerpos contra el antígeno citoplasmático SS-B(anti-La) en suero tampoco mostró diferencias significativas entre los tres grados de severidad. El título de anticuerpos antinucleares (>1:40) sólo presentó diferencias significativas entre el grado III y los demás. Por último, el factor reumatoide (>1:40) tuvo diferencias significativas entre los tres grados de severidad. Ninguna persona control ni paciente con QCS presentó valores positivos para estos cuatro anticuerpos (tabla III).
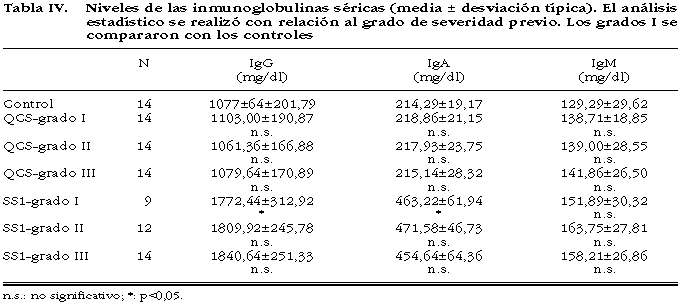
Los valores de las inmunoglobulinas están descritos en la tabla IV, observándose que en ninguna de las tres determinaciones existen diferencias significativas entre los distintos grados de QCS y de éstos respecto a los controles. Tampoco existieron diferencias significativas entre los distintos grados de SS1, pero sí de éstos respecto a los pacientes con QCS y las personas sanas. En la IgM no se observó diferencias significativas entre ningún grado.
Citometría de flujo
La mayoría de las determinaciones no dieron resultados positivos posiblemente debido al pequeño tamaño de las muestras o a su manipulación previa. Únicamente se pudo realizar la citometría de flujo en 4 controles, 15 pacientes con QCS (5 de grado I, 4 de grado II y 6 de grado III) y 13 pacientes con SS1 (4 de grado I, de grado II y 4 de grado III). Tanto en la determinación de linfocitos totales, como de linfocitos B CD20 y en linfocitos T CD4 y T CD8 en las glándulas lagrimales de los pacientes con SS1 el aumento fue significativo conforme aumentaba el grado de severidad. Al comparar el SS1 y la QCS, se observó que en los pacientes con SS1 hubo un incremento significativo en todas las poblaciones de linfocitos (tabla V).

Citología de impresión conjuntival
Los valores obtenidos en las muestras citológicas presentaron diferencias significativas en la densidad de células caliciformes, en el tamaño celular y en la relación N:C, entre todos los grados de severidad, tanto en el SS1 como en la QCS, así como en el mismo grado de severidad entre ambos síndromes (figs. 1-7). En algunos pacientes con SS1 se llegaron a observar células plasmáticas entre las células epiteliales (fig. 8), nunca observadas en los pacientes con QCS y mucho menos en las personas controles.
Biopsia conjuntival
La densidad de células caliciformes en el fórnix conjuntival superior está descrita en la tabla VI. Se observaron variaciones significativas entre los tres grados de severidad del SS1. Al comparar el SS1 y la QCS, en el mismo grado de severidad, se observaron diferencias significativas en todos ellos, excepto entre el grado I de ambos síndromes. No se encontró diferencia en la distribución de las células caliciformes a lo largo del epitelio, entre el mismo grado de ambos síndromes (figs. 9-13).

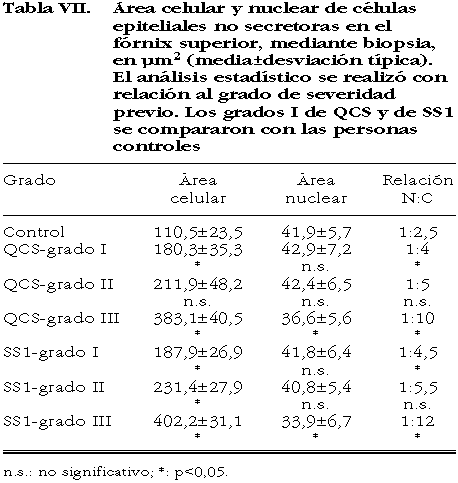
El tamaño celular de las células epiteliales no secretoras aumentó significativamente en los pacientes con SS1 conforme se incrementó el grado de severidad, sin hallar diferencias significativas con el mismo grado de QCS; en cambio, el área de los núcleos no presentó disminución significativa hasta el grado III, en ambos síndromes (figs. 9-13). La relación núcleo:citoplasma en las personas sanas fue significativamente menor que en el SS1 y que en la QCS; de igual forma, entre los grados III de ambos síndromes se observaron diferencias significativas respecto a los anteriores grados. No existieron diferencias significativas en el mismo grado de severidad entre ambos síndromes (tabla VII).
Biopsia de la glándula lagrimal principal
La estructura acinar de la glándula en los pacientes con SS1 presentó la misma morfología que en los pacientes con QCS y que en las personas controles. En ambos síndromes, las células acinares presentaron una disminución del número de gránulos de secreción, en función del grado de severidad de la enfermedad. De igual manera, los pacientes con SS1 mostraron una significativa disminución de estos gránulos de secreción respecto a los pacientes con QCS y mucho mayor respecto a los controles (figs. 14-16). La disposición de los gránulos de secreción en las células de las glándulas lagrimales sanas y de pacientes con QCS estuvo distribuida por toda la célula, mientras que en los pacientes con SS1 los gránulos de secreción se hallaron principalmente en el polo apical. Las células secretoras en los pacientes con SS1 estuvieron dispuestas en acinos bien definidos, rodeadas por las células mioepiteliales. Los conductos excretores finales poseyeron abundante número de células caliciformes normales, a pesar que el epitelio conjuntival estuvo muy alterado (fig. 17). Únicamente en el grado III se observó una disminución significativa del área celular y nuclear de las células acinares respecto a los grados de severidad anteriores. Al comparar el SS1 con la QCS sólo hubo diferencias significativas entre los grados III (tabla VIII).

El tejido conectivo en las muestras de los pacientes con SS1, dispuesto entre el epitelio de la superficie ocular y las células acinares de la glándula lagrimal principal, presentó una alta densidad de fibras de colágeno y abundante número de células inflamatorias, principalmente linfocitos y, en menor cantidad, células plasmáticas, observándose una disposición por todo el tejido conectivo, variando su número en función del grado de severidad de la enfermedad, llegando a formar densos acúmulos celulares. En los pacientes con SS1-grado I, las células plasmáticas fueron las células inflamatorias más abundantes (figs. 12 y 18). A partir del grado II predominaron los linfocitos sobre las demás células inflamatorias (fig. 19). Precisamente, en el tejido conectivo fue donde se encontró el mayor número de diferencias entre los enfermos con SS1, los pacientes con QCS y los controles (fig. 20), tanto en las zonas subepiteliales de la superficie ocular (figs. 12 y 13) como en las periacinares glandulares (fig. 21). El espacio interacinar glandular en tejidos de personas sanas fue pequeño, compuesto por escaso número de fibras (laxo) y alguna célula plasmática. En los pacientes con QCS y, de forma más acentuada, en el SS1 este espacio se hizo mayor y mucho más denso, con gran número de fibroblastos y un marcado incremento en el número de células plasmáticas y de linfocitos. También se observó un aumento del número de células adiposas en ambos síndromes respecto a los controles, más acentuado en los pacientes con SS1 (fig. 22). En los casos más graves se llegó a observar una intensa esclerosis interacinar. El calibre de la luz de los vasos capilares disminuyó significativamente, llegándose a observar casos de oclusión casi total y procesos de neovascularización (fig. 23). Los vasos linfáticos también sufrieron una disminución del tamaño de su luz. Las terminaciones nerviosas y las fibras nerviosas mielinizadas no sufrieron modificaciones, permaneciendo con una distribución muy parecida a la de las personas controles y pacientes con QCS.
La característica diferencial típica entre los grupos estudiados fue el significativo incremento de los linfocitos en los enfermos con SS1 con relación a los pacientes con QCS y las personas controles. La distribución de estos linfocitos se presentó en acúmulos periféricos a la glándula (figs. 21 y 24), en disposición subepitelial conjuntival (figs. 13 y 24), o bien en acúmulos interacinares (figs. 25-27). En los pacientes con grado I de SS1, los linfocitos estuvieron más o menos dispersos (fig. 25), formando agrupaciones más densas en el grado II (fig. 26), y densos acúmulos, que ocuparon la práctica totalidad del tejido periacinar, en el grado III (fig. 27). Los linfocitos también aparecieron en disposición periductal y perivascular, pero nunca entre las células epiteliales, ni de las glándulas, ni en los conductos excretores, ni de la conjuntiva (figs. 16 y 21). Estos linfocitos presentaron frecuentemente escasos orgánulos citoplasmática, aunque en el grado más severo se observaron abundantes polirribosomas, mitocondrias, membranas de REr, invaginaciones de la membrana nuclear, abundante heterocromatina y un prominente nucleolo (figs. 28 y 29).
Los mastocitos fueron ligeramente más abundante que en los controles y los pacientes con QCS, observándose ocasionalmente gránulos dispersos por el tejido conectivo. Las células plasmáticas solieron presentar cisternas de REr grandes y muy dilatadas, con material electrodenso en su interior (figs. 28 y 30).
Las células acinares tuvieron formas más alargadas y estrechas en los pacientes con SS1 que la de los pacientes con QCS y mucho más que en las personas controles. El polo basal de las células acinares en personas sanas fue liso y de mayor tamaño que el apical, uniéndose a la membrana basal mediante gran número de hemidesmosomas, mientras que en los pacientes con QCS y SS1 se observaron una superficie más irregular y con menor número de uniones celulares (figs. 31-33). El polo apical de las células sanas presentó microvellosidades, mientras que en los dos síndromes las células sufrieron una disminución creciente del número, llegando a desaparecer a partir del grado II. Las células normales se unieron entre sí mediante evaginaciones y desmosomas, disminuyendo su número en las células de los pacientes con ambos síndromes, lo que provocó un ensanchamiento progresivo del espacio intersticial, conforme aumentó el grado de severidad de la enfermedad (figs. 34 y 35).
A nivel ultraestructural, las células acinares de pacientes con SS1 presentaron los orgánulos típicos de una célula secretora, aunque en menor número que en el mismo grado de severidad de la QCS. Los gránulos de secreción en la mayoría de las células acinares en todos los grados de SS1 mostraron gran diversidad de tamaño, electrodensidad y aspecto, destacando que conforme aumentaba la severidad de la enfermedad los gránulos parecían estar vacíos, al menos en su zona central. En algunas células acinares de pacientes con SS1-grado III hubo células secretoras con moderado número de orgánulos subcelulares, pero con gránulos de secreción escasos y atípicos (figs. 36 y 37). Las células secretoras de la glándula lagrimal en la QCS presentaron gránulos de secreción más numerosos, de mayor tamaño y más electrodensos que en el SS1, sin apenas observarse la existencia de gránulos de secreción vacíos. En las personas sanas, los gránulos de secreción solieron ser muy electrodensos, grandes y de tamaño homogéneo. Los núcleos de las células acinares en el SS1 presentaron mayor número de invaginaciones y condensación de cromatina que en el QCS (fig. 38). Numerosas células en el SS1 estuvieron degeneradas, aumentando la cantidad conforme se incrementó la severidad, y fueron mucho más frecuentes que en los pacientes con QCS. La disminución de los orgánulos subcelulares en el SS1 estuvo acompañada por el aumento de material fibrilar (fig. 33). A pesar de la atrofia celular, la mayoría de los acinos no llegaron a perder su estructura típica.
A grandes aumentos, en ninguna muestra se observó depósitos inmunodensos en la membrana basal de los acinos, del epitelio conjuntival o de los vasos sanguíneos.
A lo largo de los conductos secretores de la glándula lagrimal se pudieron observar gránulos de secreción. En los controles y en los grados I de ambos síndromes fue fácil apreciarlos, mientras que a partir del grado II, sobre todo, en los enfermos con SS1, fue muy difícil su observación (fig. 39).
Discusión
Existen grandes diferencias en el diagnóstico del SS1 dependiendo de los distintos grupos de investigadores (8). Las discrepancias comienzan con el número de pruebas requeridas para el diagnóstico, que varía según el criterio utilizado. Para algunos investigadores tienen tanto valor los síntomas subjetivos como las pruebas objetivas (19), mientras que para otros autores son fundamentales los valores inmunológicos y de la biopsia de las glándulas salivales menores (8,14), considerando que los anticuerpos específicos anti SS-A y el anti SS-B son los marcadores serológicos más importantes para el diagnóstico de la enfermedad (27), mientras que para otros autores la presencia de estos dos autoanticuerpos no tiene gran valor de diagnóstico porque su frecuencia es baja y no son exclusivos del SS1, estando excluidos de algunos criterios (6,28). Sus valores sufren grandísimas variaciones que van desde el 96% hasta un 50% para el anticuerpo anti SS-A, y desde el 87% hasta el 40% para el anti SS-B (9). Nuestros resultados mostraron que la determinación sérica media del antígeno anti SS-A fue del 68% y la del anti SS-B fue del 39%, sensibilidades bajas, por lo que consideramos que sólo sirvió para el diagnóstico de un reducido número de pacientes. A pesar de ello, estas determinaciones tuvieron un importante valor predictivo positivo pero no así negativo. En cuanto a las demás determinaciones inmunológicas séricas nuestros valores son muy parecidos a los descritos por la mayoría de los autores; así, los pacientes con SS1 tuvieron títulos de anticuerpos antinucleares moderados (5) y del factor reumatoide, alto (7).
Estas determinaciones de anticuerpos séricos mostraron diferencias significativas entre los pacientes con SS1 y QCS. Si a ellas, se le añade las variaciones significativas encontradas en los niveles de IgA e IgG y la alteración de la gammagrafía de las glándulas parótidas, existen los suficientes argumentos para apoyar el diagnóstico diferencial, ya realizado en el Servicio de Reumatología, a pesar de tratarse de determinaciones poco sensibles e inespecíficas para el SS1, ya que la totalidad de ellas están presentes en otras enfermedades, incluso en porcentajes mayores (3). Además, el diagnóstico estuvo acompañado por un resultado alterado de las glándulas salivales menores, en 26 de los 35 pacientes con SS1 (74%). Este porcentaje moderado sirve para que los autores que no consideran a la biopsia de glándulas salivales menores una prueba de diagnóstico imprescindible, máxime cuando además existe un alto número de biopsias blancas y la dificultad expresada por los anatomopatólogos a la hora de diagnosticar el grado I de la enfermedad. Por ello, sería mejor realizar un diagnóstico del SS1 mediante la biopsia de las glándulas lagrimales principales, a pesar de los inconvenientes existentes (27,29), máxime cuando la respuesta inmunológica en la glándula lagrimal y en las glándulas salivales menores es diferente (27). Nuestros resultados confirman que todos los pacientes que habían sido diagnosticados con SS1, previamente al estudio oftalmológico, tuvieron alteraciones anatomopatológicas en la glándula lagrimal en todos los pacientes estudiados (100%), dando un valor de diagnóstico diferencial máximo a esta prueba.
La citología de impresión conjuntival sirve de forma notable a realizar un primer y rápido diagnóstico de los pacientes con SS1 respecto a la QCS. El epitelio conjuntival en pacientes con SS1, en su fase clínicamente activa, se caracterizó por un proceso de metaplasia escamosa que coincidió con el grado de severidad de la enfermedad (30).
Por el contrario, en cuanto a las diferentes pruebas estudiadas en el presente trabajo, que determinan la función de la glándula lagrimal, las clínicas (prueba de Schirmer, BUT y tinción con rosa de bengala) y las biológicas (proteinograma y osmolaridad) sólo sirvieron para indicar el componente de sequedad ocular propio de la enfermedad. A pesar de que el SS1 cursa con una QCS producida por alteraciones en la glándula lagrimal, coincidimos con los autores que no encontraron correlación entre ninguna de ellas y los signos funcionales de la SS1 (31), por lo que hay que descartar que el componente sistémico de la enfermedad influye en el volumen de la secreción lagrimal o en la concentración iónica de la lágrima, aunque sí existe influencia sobre el contenido proteico de la secrección lagrimal, incluidas las inmunoglobulinas, sobre todo en los pacientes con SS1 más graves. Esto nos hace pensar que el componente inmunológico de la enfermedad afecta fundamentalmente a la secrección proteica.
En el presente estudio, donde se está comparando una QCS asociada y no asociada a un síndrome sistémico, la alteración debida a cambios de la película lagrimal se ve acompañada por el factor intrínseco que afecta al epitelio conjuntival desde el tejido conectivo (32), así, se puede observar una marcada disminución de la densidad de las células secretoras conjuntivales (células caliciformes) y la aparición simultánea de graves epiteliopatías. Este proceso fue paralelo y semejante al observado en la glándula lagrimal, destacando que la densidad de linfocitos y de células plasmáticas, observándose que los focos de las células inflamatorias estuvieron correlacionados con el grado de severidad del SS1. El aumento del número de células plasmáticas con su producto de secreción, muy abundante en el interior de su REr, siendo observado por microscopia electrónica, apoya la participación humoral del proceso inflamatorio sobre las células acinares junto a la participación celular. Estos mediadores pueden llegar a amplificar la respuesta inflamatoria en las fases posteriores del estímulo, influyendo en la evolución de la enfermedad en ambas estructuras. También hay que tener en cuenta que las células y tejidos necróticos, cualquiera que sea la causa, pueden activar por sí mismos la elaboración de los mediadores de la inflamación (33,34). Esta destrucción tisular con intentos de reparación fue observada en nuestros pacientes, de forma similar a la reparación del tejido conectivo descrito por Contran et al. (35).
La gran presencia de los linfocitos T y B en el tejido intersticial y periglandular de la glándula lagrimal principal con SS1, resulta ser una de las mejores determinaciones para el diagnóstico diferencial de la enfermedad, destacando la ausencia de estos infiltrados entre las células epiteliales, resultados que coinciden con los obtenidos por Chomette et al. (17) y si, además, las alteraciones morfológicas en estas células acinares fueron muy numerosas, observamos que no fue posible ningún proceso regenerativo, estando agravado fundamentalmente por el proceso inflamatorio existente en el tejido conectivo.
En contra de lo manifestado por otros autores, mediante pruebas morfológicas y citometría de flujo, hemos observado que los linfocitos T fueron las células más abundantes en la glándula lagrimal principal de nuestros pacientes con SS1, así como un gran incremento del número de linfocitos B, que no fueron acompañados de la destrucción de los acinos g} andulares. Este mismo patrón fue descrito en otros estudios (3), observándose un patrón muy diferente al ofrecido por las glándulas salivales menores, lo que indica que no parece existir una misma respuesta celular entre ambas glándulas (5,36,37); por ello, al no haber un patrón único se llegó a observar un conjunto de anomalías inmunitarias no específicas que dan lugar a una enfermedad multisistémica, como en el SS1 (38), no siendo necesario realizar una biopsia labial para el diagnóstico diferencial de estos pacientes (29,39). Al igual que Kurrasch et al. (4) compartimos la idea de que los hallazgos en una glándula concreta no pueden generalizarse a todas las demás glándulas exocrinas, debiéndose aceptar la existencia de diferencias intrínsecas en cada glándula y la presencia de diferentes manifestaciones en el proceso de desarrollo (11,40).
El proceso común existente en la glándula lagrimal principal y en la conjuntiva se pudo comprobar morfológicamente al observar cómo el proceso inflamatorio se desplazaba desde los vasos sanguíneos hacia el epitelio conjuntival y hacia la glándula lagrimal, en proporción muy parecida, sin que permanezcan mucho tiempo alrededor de los vasos. Una vez próximos a la glándula lagrimal o en localización subconjuntival, llegan a formar focos, más densos conforme aumenta la severidad de la enfermedad, pudiendo llegar a afectar a casi toda la glándula. En las fases más severas del SS1 parte del parénquima atrofiado fue sustituido por tejido adiposo, con una severa disminución de la secreción lagrimal. El proceso degenerativo en el SS1 progresa lentamente, observándose en primer lugar un pequeño número de células mononucleares, principalmente células plasmáticas. Cuando la agresión autoinmune se hace más intensa los linfocitos constituyen el mayor porcentaje de las células inflamatorias.
En conclusión, el estudio de la glándula lagrimal principal en pacientes con SS1 no sólo permite el mejor diagnóstico diferencial que identifican la enfermedad al estudiar las distintas poblaciones de células inflamatorias, sino que además muestra la estructura íntima de la glándula lagrimal principal y del tejido conectivo periférico, y permite la graduación de la severidad de la enfermedad desde su inicio hasta las fases más graves, así como el seguimiento clínico.
Agradecimientos
Este trabajo ha sido realizado en el Hospital Ramón y Cajal de Madrid. El estudio se ha basado en una parte de la Tesis doctoral de la Dra. MA Oroza.
Agradecemos al Dr. A Mohino, del Servicio de Reumatología de Hospital, por las facilidades ofrecidas en todo momento y por toda la información facilitada, lo que ha hecho posible la realización de este estudio multidisciplinar.
A la Dra. R Carrillo, del Servicio de Anatomía Patológica del Hospital, por su ayuda en el diagnóstico y estudio de las glándulas salivales menores.
Al Dr. E García-Poblete, de la Facultad de Ciencias de la Salud, de la Universidad Juan Carlos I, de Madrid, por su colaboración en la realización de la citometría de flujo.
Resumen
Objetivos. La finalidad del presente trabajo es estudiar en profundidad la morfología normal y patológica de la glándula lagrimal, hasta ahora poco conocida en humanos, describiendo las alteraciones histológicas, la población de células inflamatorias en la glándula y realizando un inédito análisis morfométrico de las células de los acinos glandulares, con el fin de ahondar en el conocimiento de los parámetros celulares que definen el síndrome de Sjögren primario (SS1), comparándolos con los de los pacientes con QCS, lo que sirve para evaluar el componente sistémico de la enfermedad. De igual forma, se pretende estudiar cómo afecta el proceso inflamatorio a las estructuras epiteliales próximas y al tejido conectivo periglandular. Por último, se estudiarán diversas pruebas oftalmológicas y séricas que pudiesen servir como indicadores de la funcionalidad de la glándula lagrimal y sus correlaciones con la morfología glandular.
Material y métodos. En el estudio participaron 35 pacientes con SS1 (9, con grado I; 12, con grado II; y 14, con grado III), 45 pacientes con QCS (14, 14, y 14, respectivamente) y 14 personas sanas. A todo ellos se les realizó un protocolo clínico que incluyó una historia clínica, un examen con lámpara de hendidura, pruebas clínicas (prueba de Schirmer, tiempo de ruptura de la película lágrima y tinción con rosa de bengala), de laboratorio (lactoferrina, lisozima y osmolaridad), citometría de flujo (linfocitos T CD4, T CD8 y linfocitos B) e histopatológicas (citología de impresión, biopsia de la glándula lagrimal y biopsia de la conjuntiva).
Resultados. La estructura de la glándula lagrimal principal en los pacientes con SS1 presentó diferencias significativas respecto a la de los pacientes con QCS y personas sanas, con un menor tamaño de las células acinares, disminución del número de gránulos de secreción, mayores alteraciones de los orgánulos subcelulares citoplasmático, mayores alteraciones nucleares, disminución de las uniones intercelulares, menor tamaño de los vasos sanguíneos y linfáticos, aumento de la cantidad de fibras de colágeno y, sobre todo, un gran incremento de la densidad de linfocitos y células plasmáticas.
Entre todas las pruebas estudiadas, la gammagrafía de las glándulas parótidas, la determinación de anticuerpos contra el antígeno anti SS-A y anti SS-B, el título de anticuerpos antinucleares, el título del factor reumatoide, los valores de las IgA e IgG y la determinación de linfocitos B y linfocitos T CD4 y T CD8 en los pacientes con SS1 tuvieron diferencias significativas respecto a los pacientes con QCS y controles. La citología de impresión conjuntival también presentó diferencias significativas entre los enfermos con SS1 y con QCS. Por último, las biopsias de la glándula lagrimal y conjuntival mostraron un proceso paralelo y común ante el proceso de inflamación crónica, presentando semejantes alteraciones celulares.
Conclusiones. A pesar de la obtención de diversas determinaciones inmunológicas séricas alteradas y resultados positivos en la biopsia de las glándulas salivales menores, la biopsia de la glándula lagrimal principal permite el diagnóstico diferencial definitivo en los pacientes con SS1, ya que además de presentar un proceso de inflamación crónica, las células acinares glandulares sufren alteraciones morfológicas que se inician de forma lenta, con una respuesta de baja intensidad y, generalmente, asintomática, hasta presentar graves alteraciones que pueden llevan a la muerte celular, sin que se observen células inflamatorias entre las células epiteliales de los acinos. El proceso inflamatorio se desplaza lentamente desde los vasos sanguíneos hacia la glándula lagrimal y hacia el epitelio conjuntival, en proporción semejante, donde llegaron a formar focos, que llegaron a afectar a casi toda la glándula y al epitelio conjuntival, observándose que en las fases más severas de la enfermedad parte del parénquima atrofiado fue sustituido por tejido adiposo, llegando a cesar gran parte de la secreción lagrimal. Este proceso inflamatorio fue común al observado en la conjuntiva, pero no en las glándulas salivales menores, por lo que las características encontradas en la glándula lagrimal no puede generalizarse a todas las glándulas exocrinas. Por tanto, los conocimientos obtenidos en la glándula lagrimal deberían conducir a la realización de ciertas modificaciones en el actual planteamiento del diagnóstico diferencial del síndrome de Sjögren.
Palabras clave
Glándula lagrimal, conjuntiva, síndrome de Sjögren, queratoconjuntivitis seca, inflamación.
Bibliografía
Fawcett DW. Glándula y secreción. En: Chapman y Hall (ed). Tratado de Histología. 12.ª edición. McGraw-Hill e Interamericana. Nueva York, 1996; 94-120.
Fawcett DW. Tejido conjuntivo. En: Chapman y Hall (ed). Tratado de Histología. 12.ª edición. McGraw-Hill e Interamericana. Nueva York, 1996; 148-188.
Oroza MA. Estudio inmunohistoquímico y morfológico en ojos de pacientes con síndrome de Sjögren. Universidad Complutense de Madrid. Junio 2000. Tesis doctoral.
Kurrasch RHM, Wu AJ, Fox PC. Enfermedades orales asociadas al ojo seco. En: Friedlaender M (ed). International Ophthalmology Clinics. Little, Brown and Company Inc, CibaVision SA. 1995; 89-100.
Sesmone CD, Jackson WB. Sjögren’s syndrome. En: Tasman W (ed). Immunology of the external eye. Duanets Clinical Ophthalmology. Volumen 4. Lippincott-Raven Publishers. Philadelphia. 1997; capítulo 2.
Bloch KJ. Sjögren’s syndrome. En: Frank MM, Frank Austen K, Claman HN y Unanue ER (ed). Samter’s Immunologic Diseases. 5.ª edición, vol 2. Little, Brawn and Company Inc, Boston. 1995; 841-847.
Moutsepoulos HM. Síndrome de Sjögren. En: Harrison LM. Principios de Medicina Interna. 14.ª edición. McGraw-Hill e Interamericana. Madrid. 1998; 2.160-2.163.
Fox RI. Enfermedades sistémicas asociadas al oio seco. En: Dodick JM y Donnenfeld (ed). International Ophthalmology Clinics. Ojo Seco. CibaVisión. 1995; 71-87.
Sánchez-Rodríguez A, de Portugal-Álvarez J (1994). Síndrome de Sjögren. En: Díaz-Rubio M y Espinos D (ed). Tratado de Medicina Interna. Editorial Medica Panamericana. SA. Madrid. 1994; Vol. 2: 2.825-2.827.
Coll J (1995). Síndrome de Sjögren. En: Farreras y Rozman (ed). Medicina Interna. 13a edición, Editorial Mosby/Doyma Libros. Madrid. 1995; 1.101-1.102.
Jabs DA. Ocular manifestations of the rheumatic diseases. En: Rasman W (ed). Duane’s C1inical Ophthalmology, Vol 5. Lippincon-Raven Publishers. Philadelphia. 1997; Cap 26.
Sesmone CD, Jackson WB. Inmunology of the external eye. En: Tasman W, Jaeger EA (ed). Duane’s Clinical Ophthalmology, vol. 4. Lippincott-Raven Publishers. Philadelphia. 1996; 1-52.
Harley JB, Scofield RH, Reichlin M. Anti-Ro in Sjögren's syndrome and systemic lupus erythematosus. Rheum Dis Clin North Am 1992; 18: 337-357.
Liotet S, Morin Y. Técnicas de laboratorio. En: Guía Práctica de los Exámenes de Laboratorio en Oftalmología. Masson SA. Barcelona. 1990; 151-152.
Stites DP, Terr AI (1993). Enfermedades reumáticas. En: Inmunología Basica y Clínica. 7.ª edición. El Manual Moderno SA. Méjico. 1993; 513-542.
Fox RI, Kang HI. Pathogenesis of Sjögren’s syndrome. Rheum Dis Clin North Am 1992; 18: 517-538.
Chomette G, Auriol M y Liotet S. Ultrastructural study ofthe lacrimal gland in a case of Sjögren’s Syndrome. Scand J Rheumatology 1986; suppl 61: 71-75.
Rivas L, Álvarez MI, Rodríguez JJ y Murube J. Ophthalmological tests in patients with keratoconjunctivitis sicca with and without association of primary Sjögren’s syndrome. German J Opthalmol 1995; 4: 306-310.
Vitali C, Bombardieri S, Moutsopoulos HM, Coll J, Gerdi R, Hatron PY, Kater L et al. Assessement of the European classification criteria for Sjögren’s syndrome in a series of clinically defined cases: results of a propective multicentre study. The European Study Group on Diagnostic Criteria for Sjögren’s Syndrome. Ann Rheum Dis 1996; 55: 116-121.
Murube J. Clasificación clínica del ojo seco. En: Murube J (ed). Ojo Seco-Dry Eye. Tecnimedia Editorial. Granada. 1997; 39-44.
Bijsterveld van OP. A simple test for lacrimal gland function: a tear lactoferrin assay by radial immunodiffusion. Graefe’s Arch Clin Exp Ophthalmel 1983; 220: 171-174.
Murube del Castillo J, Cortés Rodrigo MD. Eye parameters for the diagnosis in xerophthalmos. Clin Exp Reumatol 1989; 7: 145-150.
Nelson JD, Wright JC. Tear film osmolality determination: an evaluation of potential errors in measurement. Curr Eye Res 1986; 5: 677-681.
Gilbard JP. Concentración de los electrolitos en la película lagrimal del ojo normal y el ojo seco. En: International Ophthalmology Clinics. CibaVisión. 1995; 27-36.
Preffer FI. Flow cytometry. En: Colvin RB, Bhan AK y McCluskey RT (ed). Diagnostic Immunopathology. 2.ª ed. Raven Press Ltd., Nueva York. 1995; 725-749.
Chisholm DM, Mason DK. Labial salivary gland biopsy in Sjögren’s syndrome. J Clin Pathol 1968; 21: 656-660.
Contran RS, Kumar V, Robbins SL. Trastornos de la inmunidad. En: Schoen FJ (ed). Patología Estructural y Funcional. 5.ª edición. McGraw-Hill e Interamericana de España. Nueva York. 1995; 191-269.
Fox RI. What is Sjögren syndrome? En: Rheumatic Disease Clinics of North America. Sjögren’s syndrome. WB Saunders Company. Vol. 18. Philadelphia. Pretace. 1992.
Manthorpe R, Oxholm P, Prause JU, Schiodt M. Sjögren’s syndrome: comments on the proposed criteria for classification. Arthritis Rheum 1987; 30: 954-955.
Rivas L, Oroza MA, Pérez-Esteban A, Murube J. Morphological changes in ocular surface in dry eyes and other disorders by impression cytology. Graefe’s Arch Ophthalmol 1992; 230: 329-334.
Watinuz MJ, Ginsbarg C, Giral P, Benuani M, Bigel P, Wioland M, Cabane J, Imbert JC. Syndrome de Geugerot-Sjögren primaire. Evolution spontanée sur un an des gignes cliniques, biologiques et histologiques. Press Med 1995; 24: 983-986.
Rivas L. Diagnosis throogh other assays. En: Murube J y Rolando M (ed). Dry Eye. A Systemic Approach to Therapy. CibaVision, 2000; 101-114.
Robbins CK. Lesión y adaptación. En: Patología Estructural y Funcional. Vol. 1, 4.ª edición, Interamericana/McGraw-Hill. 1990; 1-38.
Weissman SM. Gene therapy. Proc Natl Acad Sci USA, 1992; 89: 11.111-11.112.
Contran RS, Kumar V, Robbins SL. Inflamación y reparación. En: Schoen FJ (ed). Patología Estructural y Funcional. 5.ª edición. McGraw-Hill e Interamericana de España. Nueva York. 1995; 57-104.
Skoupouli FN, Fox PC, Galanpoulou V. T cell subpopulations in the labial minor salivary gland histopathologic lesion of Sjögren’s syndrome. J Rheumatol 1991; 18: 210-214.
Fox RI, Kang HI (1993). Sjögren’s syndrome. En: Kelly et al. (ed). Textbook of Rheumatology. 4.ª Edición, vol. 1. WB Sainders Company. Philadelphia. 1993; 931-942.
Markusse HM, Hogeweg M, Swank AJG, van Haerlegen NJ, Jong PTVM. Ophthalmological examinations of patients with primary Sjögren’s syndrome selected from a rheumatology practice. Br J Rheumatol 1992; 31: 473-476.
Proenca R. Sjögren laboratory analysis. En: Murube J y Rolando M (ed). Dry Eye. A Systemic Approach to Therapy. CibaVision. 2000; 115-118.
Jabs DA, Prendergast RA. Murine models of Sjögren’s syndrome: Evolution of the lacrimal gland inflammato¦y lesions. Invest Ophthalmol Vis Sci 1991; 32: 371-382.